骨代谢是由成骨细胞和破骨细胞参与的维持骨骼平衡和功能的重要过程。衰老、雌激素缺失和机体氧化损伤可导致成骨细胞的骨形成减少,破骨细胞的骨吸收增加,当骨吸收大于骨形成时导致骨质疏松症的发生。仙茅为常用中药,来源于石蒜科植物仙茅(Curculigo orchioides Gaertn.) 的干燥根茎,具有补肾阳、益精血、强筋骨和行血消肿的作用,用于肾阳不足、阳痿遗精、虚痨内伤和筋骨疼痛等病症[1]。仙茅含有酚苷、皂苷、黄酮和桉烷类化合物[2]。我们研究发现,仙茅提取物能够增加去卵巢骨质疏松大鼠的骨密度,显示出确切的抗骨质疏松作用,并经整体动物和细胞学实验明确了仙茅酚苷类成分为抗骨质疏松的有效成分[3]。然而,仙茅中存在3种结构类型的酚苷类成分,包括苯甲酸酯类酚苷、苔黑酚类酚苷和含氯苯酚衍生物,明确这3种酚苷类成分对成骨细胞和破骨细胞的作用及特点,可为仙茅的临床应用和资源开发利用提供科学依据。
1 材料和方法 1.1 药材仙茅购于上海华宇药材公司(产地:四川宜宾),经第二军医大学药学院生药学教研室张巧艳副教授鉴定为石蒜科植物仙茅(Curculigo orchioides Gaertn.)的干燥根茎。
1.2 仪器与试剂制备液相色谱仪(美国Agilent公司);Agilent XDBC-18(5 μm,9.4 mm×250 mm)(美国Agilent公司);Bruker DRX-500型核磁共振仪; Mat-212磁式质谱仪(EI-MS);Q-Tof micro (ESI-MS);MS(n),Agilent Series 1100 LCMSD (美国Agilent公司);ZF-1型三用紫外分析仪(江苏海门其林贝尔仪器制造有限公司);柱层析填料,硅胶H(200~300目),由山东烟台芝罘硅胶开发试验厂生产;Sephadex LH-20,Amersham Pharmacia Biotech;ODS RP-18反相硅胶(20~40 μm),YMC公司;D101大孔树脂,天津正大天成公司;柱色谱所用溶剂为分析纯,高效液相色谱法(HPLC)所用试剂为色谱纯,均由国药集团上海化学试剂公司生产。
新生1~2 d的SD大鼠由第二军医大学实验动物中心[许可证号:SCXK(沪)2007-0005]提供;Ⅱ型胶原酶、特级胎牛血清、胰蛋白酶、α-MEM培养基为美国Gibco公司产品;地塞米松购自美国Sigma公司。双人单面超净台(SW-CJ-2FD),苏州净化有限公司;CO2恒温培养箱(MCO-15AC),日本Sanyo生物医学电器公司;倒置相差显微镜(CKX41),日本Olympus公司;酶标仪(Bio-Tex ELx 800),美国Fisher公司。
1.3 仙茅酚苷类化合物的分离制备仙茅药材粉末10 kg,10倍量70%乙醇回流提取3次,每次120 min,合并提取液,抽滤后浓缩成浸膏至无醇味,加水溶解至体积为10 L(药液∶药材= 1∶1),按照1 BV上样量通入装有10 kg D101树脂的色谱柱中,用10%、30%的乙醇洗脱,制得D101大孔树脂10%乙醇洗脱部位、30%乙醇洗脱部位。采用Sephadex LH-20和制备液相从D101大孔树脂10%乙醇洗脱部位和30%乙醇洗脱部位得到化合物1~8。制备液相色谱条件:进样量0.8 mL,流速5 mL/min,流动相为水和乙腈。通过分析化合物的核磁共振 (包括1HNMR、13CNMR等)、质谱(ESI-MS)、红外光谱(IR)和紫外(UV)光谱图,并与文献对照,确定化合物1~8分别为5-羟甲基糠醛(1)、2-羟基-5-(2-羟乙基)苯基-β-D-吡喃葡萄糖苷 (2)、苔黑酚龙胆二糖苷(3)、苔黑酚葡萄糖苷(4)、苔黑酚-1-O-β-D-呋喃芹糖基-(1→6)-β-D-吡喃葡萄糖苷(5)、2,6-二甲氧基苯甲酸(6)、仙茅苷(7)和仙茅素A (8)。仙茅苷为苯甲酸酯类酚苷,仙茅素A为含氯苯酚衍生物,苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷为苔黑酚苷类成分,以这4个化合物为代表观察不同结构类型的仙茅酚苷类成分对成骨和破骨细胞的作用。
1.4 成骨细胞的增殖和碱性磷酸酶(ALP)活性测定参照刘祖德等[4]的方法,取新生2~3 d的SD大鼠颅顶盖骨分离制备成骨细胞。第4代大鼠颅盖骨成骨细胞消化为细胞悬液,以2×103/孔接种于96孔培养板,于37℃、5%CO2培养箱培养24 h后,换含有药物的培养基:阴性对照组为α-MEM培养基,其余各组分别加入药物浓度为10-10、10-9、10-8 mol/L仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,作用48 h后,以MTT法测定成骨细胞的增殖。以浓度为10-10、10-9、10-8 mol/L的仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷含药培养基处理成骨细胞,每3 d换一次培养基,培养6 d时,PBS震荡冲洗细胞3次后,每孔加100 μL 50 mmol/L的二乙醇胺、50 μL 2.5 mmol/L的对硝基苯酚磷酸二钠,37℃反应30 min后,再加0.3 mol/L的NaOH终止反应,于波长405 nm处测得光密度(D)值。以不同浓度的对硝基苯酚溶液在405 nm处的D值作标准曲线。每纳克蛋白释放的对硝基苯酚的微摩尔数表示ALP的活性。
1.5 成骨细胞微丝结构染色将第3代成骨细胞以5×105/mL的细胞数接种于48孔板内,用含10%胎牛血清的α-MEM培养基培养24 h,换含药培养基:阴性对照组为α-MEM培养基,其余各组分别加入药物浓度为10-9 mol/L的仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,培养基中含10-8 mol/L 1,25-二羟维生素D3[1,25-(OH)2-VD3]。48 h后对微丝和细胞核进行染色:PBS轻洗,加入4%甲醛(PBS稀释),室温固定30 min,PBS浸洗3次,每次3 min,1 mL/L Triton X-100透化细胞5 min,PBS浸洗,滴加1 μmol/L的罗丹明-鬼笔环肽于湿盒中避光室温孵育40 min,PBS浸洗,5 μg/mL的Hoechst 33258溶液于37℃染核10 min。PBS冲洗后用甘油封片,保存于湿盒。样品用Leica TCS SP2型激光共聚焦显微镜进行观察。
1.6 成骨细胞骨矿化结节的测定(茜素红染色)将成骨细胞以5×104/孔接种于24孔板内,用含10%胎牛血清的α-MEM培养基培养24 h,换含10%胎牛血清的骨结节诱导培养基(10 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 μg/mL抗坏血酸),每3 d换液1次,12 d后换浓度为10-9 mol/L的仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药的骨结节诱导培养基,空白对照组只加含有10%胎牛血清的骨结节诱导培养基。培养48 h后进行茜素红染色。染色前,用预冷的10%中性甲醛缓冲液固定10 min,蒸馏水冲洗3次;加入0.1%茜素红-Tris-HCl染液(pH=8.3),37℃下染色30 min;加蒸馏水冲洗,干燥,封片,倒置显微镜下观察拍照。
1.7 骨髓源性破骨细胞的诱导培养将新生3 d的SD大鼠脱颈椎处死,75%乙醇浸泡消毒5 min,在无菌操作台中分离胫骨,用α-MEM培养基(含10%胎牛血清、10-8 mol/L 1,25-(OH)2-VD3、10-7mol/L地塞米松)将骨髓腔内的细胞冲出,PBS冲洗细胞后即得新鲜的骨髓细胞[5-6]。将第4代成骨细胞和新鲜收集的骨髓细胞共同悬浮于α-MEM培养基(含10%胎牛血清、10-8 mol/L 1,25-(OH)2-VD3、10-7mol/L地塞米松)中,使成骨细胞的密度为1×105/mL,骨髓单核细胞为1×106/mL,将细胞悬液接种于预先放置灭菌的玻片或骨片的96孔培养板中,于37℃、5%CO2培养箱中培养,每3 d换一次培养基,8 d后破骨细胞分化成熟。
1.8 破骨细胞数目和抗酒石酸酸性磷酸酶(TRAP) 的活性测定将骨髓单核细胞接种于96孔培养板中,加入含10%胎牛血清、10-8 mol/L 1,25-(OH)2-VD3、10-7 mol/L地塞米松的α-MEM培养基,24 h后加入药物浓度为10-7、10-6、10-5 mol/L的仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,培养8 d后,进行破骨细胞TRAP染色,于显微镜下对TRAP阳性的多核细胞进行计数;或将骨髓单核细胞诱导培养8 d后,加入药物浓度为10-7、10-6、10-5 mol/L的仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,培养48 h后测定TRAP的活性:弃上清,PBS冲洗,20 μL细胞裂解液(0.1% Triton X-100)室温破碎细胞15 min,加入100 μL反应液(0.4 g对硝基苯基磷酸二钠用去离子水溶解,加入2.0 g酒石酸钾钠,加水溶解至150 mL,HCl调节pH至3.5,加水定容至200 mL),于37℃反应30 min,快速加入100 μL 1 mol/L的NaOH终止反应,于波长405 nm处测定其D值。以对硝基苯酚溶液作标准曲线,TRAP活性用每孔破骨细胞生成的对硝基苯酚的纳摩尔数表示。
1.9 骨吸收陷窝面积检测将骨髓单核细胞接种于96孔培养板中,加入含10%胎牛血清、10-8mol/L 1,25-(OH)2-VD3、10-7 mol/L地塞米松的α-MEM培养基,24 h后加入浓度为10-7、10-6、 10-5mol/L仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,每3 d换液一次,培养12 d后用甲苯胺蓝对骨吸收陷窝进行染色,于100倍光镜下观察,应用计算机图像分析系统测定每张骨片上20个随机视野内骨吸收陷窝的面积。
1.10 破骨细胞肌动蛋白环染色取骨髓单核细胞,加α-MEM培养基[含巨噬细胞集落刺激因子(M-CSF) 5 ng/mL和10%胎牛血清]悬浮、培养,24 h后收集未贴壁细胞培养于灭菌玻片上,3 d后换含50 ng/mL M-CSF和100 ng/mL RANKL的α-MEM培养基培养6 d,更换含10-6 mol/L仙茅苷、仙茅素A、苔黑酚龙胆二糖苷、苔黑酚葡萄糖苷的含药培养基,4 h后进行肌动蛋白环和细胞核染色,用Leica TCS SP2型激光共聚焦显微镜观察肌动蛋白环的形态。
1.11 统计学处理所有实验均重复2次,每种浓度的药物各设5个复孔。所有实验数据均采用SPSS 13.0软件进行统计学分析,计量资料用x±s表示,采用单因素方差分析,两两比较采用LSD-t法检验,检验水准(α)为0.05。
2 结 果 2.1 对新生大鼠颅盖骨成骨细胞增殖、ALP活性的影响如表 1所示,作用48 h后,仙茅苷在10-9和10-8 mol/L浓度下可促进成骨细胞的增殖(P<0.05);仙茅素A、苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷在10-10~10-8mol/L的浓度范围内在一定程度上抑制成骨细胞的增殖。仙茅苷在10-10 mol/L浓度下、仙茅素A在10-9 mol/L浓度下、苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷在10-10和10-9 mol/L浓度下均可促进成骨细胞ALP的活性(P<0.01)。
|
|
表 1 仙茅酚苷类成分对新生大鼠颅盖骨成骨细胞增殖和碱性磷酸酶(ALP)活性的影响 Tab 1 Effects of phenolic glycosides from Curculigo orchioides on the proliferation of osteoblast and alkaline phosphatase (ALP) activity in neonatal rat calvaria |
2.2 对成骨细胞微丝的影响
如图 1所示,在正常成骨细胞中,细胞骨架蛋白微丝充满整个细胞,以维持细胞的正常形态和结构(图 1A)。1,25-(OH)2-VD3处理后,成骨细胞的微丝萎缩,细胞结构破坏,形态呈细长的多角形,细胞铺展面积减小(图 1B)。仙茅酚苷类成分在10-9 mol/L浓度下作用48 h后,除仙茅素A外,均可在一定程度上使1,25-(OH)2-VD3损伤的成骨细胞细胞骨架结构得以恢复,从而维持成骨细胞的形态、结构和功能(图 1C~1F)。
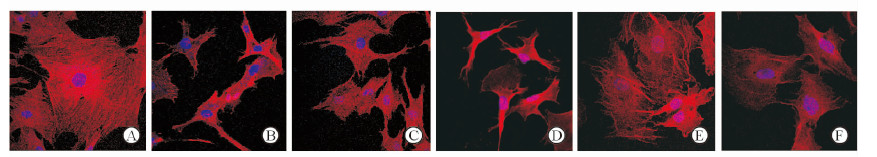
|
图 1 仙茅酚苷类成分对成骨细胞细胞骨架的影响 Fig 1 Effects of phenolic glycosides from Curculigo orchioides on the cytoskeleton of osteoblast A: Control group; B: 1,25-(OH)2-Vitamin D3 group; C: Curculigoside group; D: Curculigine A group; E: Orcinol glucoside group; F: Orcinol rhamnoside group. Original magnification: ×630 |
2.3 对成骨细胞骨矿化结节形成的影响
成骨细胞在矿化诱导液的培养下,细胞成层生长逐渐形成小集落,随着胶原堆积和钙盐沉积,集落最后形成不透光的矿化结节,经茜素红染色后形成紫红色或棕褐色块状沉淀,骨矿化结节的大小和密度代表了成骨细胞形成骨矿化结节的能力。如图 2所示,与空白对照组相比,仙茅酚苷类成分仙茅苷、仙茅素A、苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷在10-9 mol/L浓度下均可促进成骨细胞骨矿化结节的形成。

|
图 2 仙茅酚苷类成分对成骨细胞骨矿化结节形成的影响 Fig 2 Effects of phenolic glycosides from Curculigo orchioides on the bone mineralized nodule formation of osteoblast A: Control group; B: Curculigoside group; C: Curculigine A group; D: Orcinol glucoside group; E: Orcinol rhamnoside group. Original magnification: ×200 |
2.4 对破骨细胞形成、TRAP活性和骨吸收的影响
骨髓单核细胞在1,25-(OH)2-VD3和10-7 mol/L地塞米松诱导下,8 d后分化为破骨细胞。如表 2所示,仙茅苯甲酸酯类酚苷仙茅苷和苔黑酚类酚苷苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷均能减少破骨细胞的数目,抑制破骨细胞的形成(P<0.05,P<0.01),含氯苯酚衍生物仙茅素A对破骨细胞的数目没有显著的影响。对于分化成熟的破骨细胞,仙茅酚苷类成分作用48 h后,仙茅苷在10-7~10-5 mol/L的浓度范围内抑制破骨细胞TRAP的活性,另外3种酚苷类成分对破骨细胞TRAP的活性没有显著的影响。在开始诱导培养破骨细胞时,加入仙茅酚苷类成分12 d后,与对照组相比,4种酚苷类成分均可减少破骨细胞在骨片上形成的骨吸收陷窝的面积(P<0.05,P<0.01),具有抑制破骨细胞骨吸收的作用,其中仙茅苷的抑制作用最为显著。
|
|
表 2 仙茅酚苷类成分对破骨细胞抗酒石酸酸性磷酸酶(TRAP)和骨吸收的影响 Tab 2 Effects of phenolic glycosides from Curculigo orchioides on the tartrate-resistant acid phosphatase (TRAP) activity and bone resorption of osteoclast |
2.5 对破骨细胞肌动蛋白环形成的影响
如图 3所示,正常破骨细胞具有明显的伪足和肌动蛋白环,可吸附在骨组织表面进行骨吸收。仙茅苷、仙茅素A、苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷在10-6 mol/L浓度下作用4 h后,破骨细胞伪足消失,肌动蛋白环变细、结构遭到破坏甚至消失,破骨细胞的形态和结构也同时发生改变。
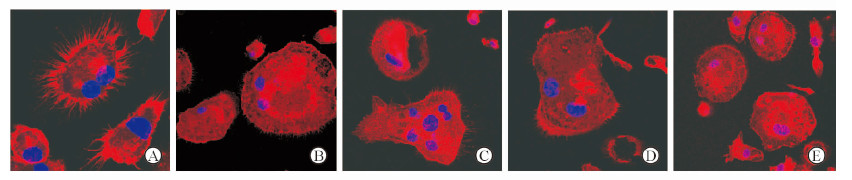
|
图 3 仙茅酚苷类成分对破骨细胞细胞骨架的影响 Fig 3 Effects of phenolic glycosides from Curculigo orchioides on the cytoskeleton of osteoclast A: Control group; B: Curculigoside group; C: Curculigine A group; D: Orcinol glucoside; E: Orcinol rhamnoside group. Original magnification: ×630 |
3 讨 论
仙茅作为壮阳、强壮健骨的中药,在中国、印度、日本和澳大利亚等地被广泛使用。仙茅乙醇提物对去卵巢大鼠的骨丢失有保护作用[3],可促进MC3T3-E1成骨细胞的增殖[7-8]。本研究发现仙茅3种结构类型的酚苷类成分均可促进成骨细胞的骨形成,抑制破骨细胞的骨吸收作用,从而明确了仙茅抗骨质疏松的有效成分,为仙茅的临床应用和开发利用提供了科学依据。
骨代谢是由成骨细胞和破骨细胞共同参与的代谢过程。成骨细胞和破骨细胞偶联的骨代谢活动出现异常,导致骨重建障碍。成骨细胞形成减少,骨形成功能减退;破骨细胞的形成和募集增加,骨吸收作用增强。成骨细胞和破骨细胞之间出现负平衡,使骨量减少。因此,观察药物对成骨细胞和破骨细胞的作用可明确其对骨代谢的影响。
成骨细胞的骨形成过程要经历4个阶段,即成骨细胞增殖、细胞外基质成熟、细胞外基质矿化和成骨细胞凋亡[9]。成骨细胞的增殖能力和产生骨基质的能力高低反映了成骨性骨形成的程度。ALP是成骨细胞分化过程中的标志酶,参与成骨细胞的分化和骨基质的矿化。苯甲酸酯类酚苷仙茅苷在10-8、10-9 mol/L浓度下促进成骨细胞增殖和分化;苔黑酚类酚苷和含氯苯酚衍生物仙茅素A对成骨细胞的增殖没有显著的影响,但可增加成骨细胞ALP活性;4种酚苷类成分均可增加成骨细胞骨矿化结节的形成,表明仙茅酚苷类成分可促进成骨细胞的骨形成作用。
破骨细胞是一种多核巨细胞,来源于由造血干细胞分化而来的单核巨噬细胞克隆形成单位。破骨细胞有丰富的胞质内酶系统,在破骨细胞前体细胞向成熟破骨细胞分化过程中产生的一系列标志性蛋白质可作为破骨细胞的识别及其分化阶段的标志。其中,破骨细胞产生的TRAP是破骨细胞成熟分化的标志酶。仙茅苯甲酸酯类酚苷仙茅苷在10-7~10-5 mol/L浓度范围内不仅可减少破骨细胞的数目,抑制破骨细胞的形成,还可抑制破骨细胞TRAP的活性;苔黑酚类酚苷苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷在10-7~10-5 mol/L浓度范围内仅可减少破骨细胞的数目,但对破骨细胞TRAP的活性没有显著的影响;含氯苯酚衍生物仙茅素A对破骨细胞形成和TRAP的活性均没有显著的影响。
在骨吸收的过程中,破骨细胞的溶酶体酶在破骨细胞与骨基质间形成一个局部酸性微环境,由此集中的不同酸性水解酶溶解骨基质中的无机盐和有机质,经破骨细胞吸收后排到细胞外液,使骨的局部形成吸收陷窝。观察破骨细胞在骨片上形成的骨吸收陷窝的数目和面积可直观反映破骨细胞的骨吸收作用。仙茅苷、仙茅素A、苔黑酚葡萄糖苷和苔黑酚龙胆二糖苷均可减少破骨细胞在骨片上形成的骨吸收陷窝的面积,显示出确切的抑制骨吸收作用。
细胞骨架是真核细胞中由微管、微丝、中间纤维等构成的三维网络结构,其主要功能为维持细胞的结构和形态,协同细胞运动[10],并在细胞的增殖、分化、凋亡等活动中发挥重要作用[11]。成骨细胞在1,25-(OH)2-VD3作用下,细胞骨架萎缩、解体,从而使细胞的形态发生改变,功能减退。仙茅苯甲酸酯类酚苷和苔黑酚类酚苷可对抗1,25-(OH)2-VD3对成骨细胞细胞骨架的破坏作用,维持其形态和功能。肌动蛋白环是破骨细胞特有的进行骨吸收的细胞骨架蛋白,仙茅3种结构类型的酚苷类成分均可破坏破骨细胞肌动蛋白环和伪足的结构,从而影响破骨细胞的黏附和迁移,抑制破骨细胞的骨吸收。
值得注意的是仙茅酚苷类成分仙茅苷在10-8mol/L和10-9mol/L浓度下促进成骨细胞的增殖,在10-10 mol/L的浓度下对成骨细胞的增殖没有显著的影响,但却能增加成骨细胞ALP的活性,这可能与成骨细胞在增殖分化的不同阶段受不同的基因调控有关。仙茅苷对成骨细胞增殖基因的调控作用弱于其对分化基因的调控作用,所以仙茅苷促进成骨细胞增殖的浓度高于促进ALP活性的浓度,但具体的机制有待深入研究。另外,仙茅酚苷类成分作用于破骨细胞的有效浓度(10-7~10-5 mol/L)远远高于作用于成骨细胞的浓度(10-10~10-8 mol/L),然而我们前期的MTT实验发现,在这种浓度下4种仙茅酚苷类成分对骨髓单核细胞和破骨细胞活力没有显著的影响。因此,仙茅酚苷类成分的抑制骨吸收作用不是由细胞毒作用引起的,而是抑制了破骨细胞的形成和分化。
本研究结果表明仙茅酚苷类成分为抗骨质疏松的有效物质,可促进成骨细胞的增殖、分化,抑制破骨细胞的形成、分化和骨吸收作用,这为仙茅资源的开发利用提供了科学依据。
| [1] | 国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2015:102. |
| [2] | He Y, Dong X, Jia X, Li M, Yuan T, Xu H, et al. Qualitative and quantitative analysis on chemical constituents from Curculigo orchioides using ultra high performance liquid chromatography coupled with electrospray ionization quadrupole time-of-flight tandem mass spectrometry. J Pharmaceut Biomed Anal[J]. 2015, 102 :236–245 . |
| [3] | Cao D P, Zheng Y N, Qin L P, Han T, Zhang H, Rahman K, et al. Curculigo orchioides, a traditional Chinese medicinal plant, prevents bone loss in ovariectomized rats. Maturitas[J]. 2008, 59 :373–380 . |
| [4] | 刘祖德, 臧鸿声. 新生大鼠颅骨成骨性细胞体外生长过程研究. 解剖学报[J]. 1995,26 :157–160. |
| [5] | Li B, Yu S. Genistein prevents bone resorption diseases by inhibiting bone resorption and stimulating bone formation. Biol Pharm Bull[J]. 2003, 26 :780–786 . |
| [6] | Zhang Q, Qin L, He W, Van Puyvelde L, Maes D, Adams A, et al. Coumarins from Cnidium monnieri and their antiosteoporotic activity. Planta Med[J]. 2007, 73 :13–19 . |
| [7] | Liu M, Li Y, Yang S T. Curculigoside improves osteogenesis of human amniotic fluid-derived stem cells. Stem Cells Dev[J]. 2014, 23 :146–154 . |
| [8] | Shen Q, Zeng D, Zhou Y, Xia L, Zhao Y, Qiao G, et al. Curculigoside promotes osteogenic differentiation of bone marrow stromal cells from ovariectomized rats. J Pharm Pharmacol[J]. 2013, 65 :1005–1013 . |
| [9] | 童安莉, 陈璐璐, 丁桂芝. 成骨细胞骨形成机制研究进展. 中国骨质疏松杂志[J]. 1999,5 :60–64. |
| [10] | Fletcher D A, Mullins R D. Cell mechanics and the cytoskeleton. Nature[J]. 2010, 463 :485–492 . |
| [11] | Yu B Y, Chou P H, Sun Y M, Lee Y T, Young T H. Topological micropatterned membranes and its effect on the morphology and growth of human mesenchymal stem cells (hMSCs). J Member Sci[J]. 2006, 273 :31–37 . |
 2016, Vol. 37
2016, Vol. 37


