2. 重庆市中医院药剂科, 重庆 400021
2. Department of Pharmacy, Chongqing Traditional Chinese Medicine Hospital, Chongqing 400021, China
溴吡斯的明(pyridostigmine bromide,PB)是一种可逆性的抗胆碱酯酶抑制剂,作用于胆碱能受体结合位点,可抑制乙酰胆碱酶的分解,从而引起副交感神经递质增加[1]。临床上,PB在重症肌无力的治疗中使用频率较高,可用于术后腹气胀和尿潴留治疗[2-4],也与其他药物联合应用治疗长春新碱引起的小儿神经病和血小板聚集[5-6]。目前PB片成人每次需服用1~2片(每片60 mg),每3~4 h口服1次,半衰期短,需要频繁给药,增大了药物发生不良反应的风险。因此,我们先将PB制备成磷脂复合物,再进一步制备成油包水型PB磷脂复合物纳米乳(pyridostigmine bromide phosphoipid complex nanoemulsion,PPNE),以提高其生物利用度,延长PB在体内有效血药浓度的作用时间,降低毒副作用;并根据PPNE在大鼠体内的吸收特征及变化规律,分析其体外释放与体内吸收的相关性。
1 材 料 1.1 仪器AG 135型电子分析天平(瑞士Mettler Toledo仪器公司);Agilent 1100型液相色谱仪(美国Agilent公司);Zetasizer Nano zs90型激光粒度电位仪(英国马尔文公司);DDB-303A型电导率仪(上海雷磁仪器厂);TGL-16B型台式高速离心机(上海安亭科学仪器厂);QL-901型旋涡混合器(海门市其林贝尔仪器制造有限公司);SHZ-82A型台式水浴恒温振荡器(江苏太仓市实验设备厂)。
1.2 药品与试剂PB(武汉远城科技发展有限公司,批号:20120302);油酸乙酯(南京都莱生物技术有限公司);吐温80(成都市科龙化工试剂厂);司盘80(成都市科龙化工试剂厂);甲醇(美国TEDIA天地试剂公司);聚乙二醇400(PEG400,天津精细化工有限公司);Milli-Q超纯水系统(美国Millipore公司);实验用水为超纯水,其他试剂为分析纯。
2 方法和结果 2.1 PPNE的制备取PB与磷脂适量,加入50 mL无水乙醇使其溶解,在40℃水浴中以600 r/min转速磁力搅拌2 h,转入250 mL圆底烧瓶中,中速40℃旋转蒸发(真空度为-70 kPa)挥干乙醇,即得到PB磷脂复合物。油酸乙酯为油相,将助乳化剂PEG400用超纯水配制成20% PEG400溶液,作为水相。按照油酸乙酯:混合乳化剂(司盘80:吐温80=2:1):20% PEG400溶液质量比=47.0:43.7:9.3,精密称取除水相以外的辅料,与干燥至恒质量的PB磷脂复合物混合均匀,再将水相用微量进样器逐滴滴入油相与乳化剂混合物中,搅拌均匀即得黄色透明的PPNE。
2.2 PPNE的zeta电位、粒径分布以及电导率的测定取适量PPNE加入油酸乙酯稀释5倍,混匀,用激光粒度电位仪测定PPNE的zeta电位和粒径分布,用电导率仪测定其电导率。测得PPNE的平均粒径为361.0 nm,zeta电位为32.2 mV,表明制剂的粒径较小。制备3批PPNE制剂,测得的平均电导率为(0.72±0.04) μs/cm。
2.3 体外分析方法的建立 2.3.1 色谱条件色谱柱采用大连伊利特Lichrospher C18柱(250 mm×4.6 mm,5 μm),检测波长:269 nm,流动相为乙腈:水相(0.01 mol/L庚烷磺酸钠,0.01 mol/L磷酸二氢钠,0.5%三乙胺,用磷酸调pH值至3.0)=21:79,流速1 mL/min,柱温30℃。
2.3.2 标准曲线的绘制精密称取PB 50 mg,以适量甲醇溶解并定容至50 mL作为标准品储备液。将储备液稀释得到浓度分别为5、25、45、65、85、105、125 μg/mL的系列PB甲醇溶液,各取100 μL进样,记录峰面积,以峰面积为纵坐标(Y)、PB的浓度为横坐标(X)绘制标准曲线。线性方程为:Y= 68.751 3X-0.514 6,r= 0.999 1,表明PB在5~125 μg/mL浓度范围内线性关系良好。
2.3.3 回收率与精密度考察取等量的9份PPNE,分别加入适量标准品,用甲醇溶解并定容,测定时取一定体积的样品,9 562×g离心10 min,取上清液进样,低、中、高3种浓度(PB质量浓度分别为36、45、54 μg/mL)样品的平均加样回收率分别为100.02%、99.07%、99.71%,RSD分别为0.87%、0.36%、0.50%。分别精密移取PPNE适量,配制成低、中、高3种浓度(PB质量浓度分别为42.94、57.25、71.56 μg/mL)的供试样品,每种浓度平行制备10份,测定日内精密度和日间精密度。日内精密度RSD分别为1.07%、0.83%、0.59%(n=5);日间精密度RSD分别为0.39%、1.03%、0.61%(n=5),精密度结果符合测定要求。
2.3.4 体外释放度的测定采用动态膜透析法[7-8]分析PB与PPNE在释放介质(pH 6.8的磷酸缓冲溶液)中的释放行为,将PB制备成与PPNE等浓度(1.8 mg/mL)的溶液,分别取1 mL的PB溶液和PPNE置于处理过的透析袋中,将透析袋分别投入20 mL的释放介质中,平行操作3份,释放温度为37 ℃,转速100 r/min,分别于0.083、0.167、0.25、0.5、1、2、4、6、8、12、24 h取样1 mL,同时补加同温、等量释放介质,按照2.3.1项下的方法进行测定,计算累积释放百分率并绘制释药曲线。PB在pH 6.8的磷酸缓冲溶液中释放迅速,而PPNE具有明显的缓释效果,见图 1。

|
图 1 PPNE与PB的体外释放曲线 PPNE:溴吡斯的明磷脂复合物纳米乳;PB:溴吡斯的明.n=3,x±s |
2.4 体内分析方法的建立 2.4.1 色谱条件
流动相为乙腈:水相= 45:55(1 000 mL流动相中含有十二烷基磺酸钠5 g、三乙胺1.375 mL、醋酸1.65 mL),流速1 mL/min,检测波长269 nm,色谱柱为大连伊利特Lichrospher C18柱(250 mm×4.6 mm,5 μm),柱温40℃。
2.4.2 血浆样品的处理方法精密量取血浆样品100 μL,加入20 μg/mL新斯的明(NEO)甲醇溶液100 μL作为内标,加0.1 mol/L苦味酸-氢氧化钠溶液(pH调至7.0)200 μL,涡旋混匀。加水饱和二氯甲烷1 mL,涡旋,9 562×g离心,取下层有机相,加入1 mmol/L的四丁基溴化铵溶液200 μL,涡旋,9 562×g离心,取上层水相100 μL作为供试品溶液进样测定。
2.4.3 标准曲线的绘制精密称取PB 50 mg,以适量甲醇溶解并定容至50 mL作为标准品储备液,将储备液稀释得到浓度分别为0.2、0.5、2.0、3.5、5.0 μg/mL的系列甲醇溶液,分别移取5种浓度溶液100 μL于2 mL EP管中,减压干燥后加入100 μL空白血浆,再按照2.4.2项下方法处理后进样,以PB浓度X(μg/mL)为横坐标、待测物与内标物的峰面积比值Y(As/Ai)为纵坐标进行线性回归,线性方程为:Y= 0.993X + 0.021 7,r=0.999 4,PB在0.2~5.0 μg/mL浓度范围内呈良好的线性关系,定量限为0.1 μg/mL。
2.4.4 方法回收率和精密度考察分别配制低、中、高3种浓度(PB质量浓度分别为0.50、1.50、4.50 μg/mL)的PB血浆样品溶液,每个浓度平行制备5份,然后按2.4.2项下方法处理。进样100 μL,测定PB和NEO的峰面积,将二者峰面积比代入线性方程计算样品中PB浓度,进而得出方法回收率,低、中、高3种浓度(0.50、1.50、4.50 μg/mL)样品溶液的方法回收率分别为97.65%、98.03%、97.36%,RSD分别为3.86%、2.73%、2.51%。取低、中、高(PB质量浓度分别为0.50、1.50、4.50 μg/mL)3种浓度的PB血浆样品溶液,按2.4.2项下方法进行处理后,1 d内连续测定5次考察日内精密度,连续测定5 d考察日间精密度。低、中、高浓度的样品溶液的日内和日间精密度RSD分别为3.24%、1.89%、2.03%和4.67%、4.09%、3.71%,表明精密度良好,符合测定要求。
2.4.5 大鼠体内药代动力学考察取12只体质量为(250±20) g的健康SD大鼠,雌雄各半,随机分成2组,禁食12 h,不禁水。一组给予PB(ig),另一组给予PPNE(ig),分别于给药后0.5、1、2、4、6、8、12、24、48、72 h进行眼底采血至肝素浸润过的离心管中,2 390×g离心10 min,取上层血浆按2.4.2项下方法处理后进样100 μL检测,所得结果代入线性方程计算血药浓度,血药浓度-时间曲线见图 2。从图 2可以看出PPNE在大鼠体内6 h达最大血药浓度,为(0.73±0.15) μg/mL。PB在2 h达到最大血药浓度,为(1.49±0.10) μg/mL,表明PPNE有明显的缓释特征。PPNE的t1/2为(5.48±1.61) h,是PB[(2.35±0.99) h]的2.33倍,克服了PB半衰期短的缺点;PPNE的Tmax为(6.00±0.00) h,约为PB的3倍。
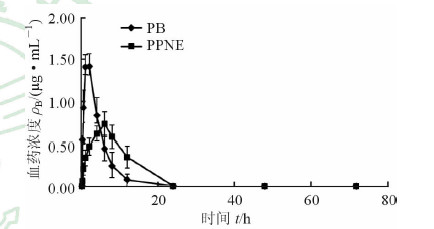
|
图 2 大鼠口服PB与PPNE后的血药浓度-时间曲线 PPNE:溴吡斯的明磷脂复合物纳米乳;PB:溴吡斯的明.n=6,x±s |
2.5 体内外相关性研究
采用室模型依赖法[9-11]进行体内外相关性的研究。将PPNE在大鼠体内血药浓度-时间数据用DAS 2.1软件进行拟合并以R2、AIC为判断依据,结果表明PPNE在大鼠体内药动学符合二室模型。以PPNE 0.5~24 h的体外累积释放率(X)为自变量,体内吸收百分数(Y)为因变量作线性回归,得到线性回归方程Y=1.376 9X-47.543 2,r=0.941 1,根据相关系数临界表r(6,0.001)=0.924 9,r大于相关系数临界值,表明PPNE体外累积释放率与体内吸收百分数具有良好的相关性。
3 讨 论PB是一种溶解性极强的生物药剂学分类系统第三类药物,即高溶解性、低渗透性药物,其口服吸收差、生物利用度低。本实验先将PB制备成磷脂复合物,增大PB的脂溶性[12]。在此基础上再制成W/O型纳米乳,可进一步增加渗透性,促进口服吸收。由药代动力学参数可知,PPNE的半衰期t1/2是PB的2.33倍,延长了药物在体内的作用时间。根据体外释放曲线可知,1 h内PB在pH 6.8的磷酸缓冲液中的累积释放率超过90%。本研究通过将PB制备成纳米乳,明显延缓了药物在释放介质中的释放,达到了药物缓释的目的。可能是由于PB磷脂复合物分布在PPNE的油水界面上,PB处于PPNE的内水相,PB的释放需要先穿过PPNE的油脂性基质,再进入到释放介质中,并且制剂的黏度要大于水溶液的黏度,进一步减缓了药物的释放。
2015版《中国药典》将对体内外相关水平分为3个层次:第一层次是指整个体外释放曲线与整个体内吸收曲线的相互关系。当体外释放曲线与体内吸收曲线上相应的各个时间点分别相关时为点对点相关,这是最高水平的相关;第二层次是体内外统计矩参数之间的相互关系,这种相关水平低于第一层次的相关性;第三层次是指在某一时间下体外药物特定的释放量或释放水平与体内某些动力学参数之间的关系[13]。这种相关仅代表部分相关,程度是最低的。本实验属于第一层次的相关性评价,可以根据体外溶出的质量控制和药物释放试验预测药物在体内的过程。
室模型依赖法和逆卷积分法均为点对点的相关性考察方法。本实验选用的室模型依赖分析方法是相关性评价水平较高的方法,该方法全面反映了制剂中药物的体外释放和体内吸收的相关性[14]。2015版《中国药典》规定,对于在体内吸收呈一室模型的药物,可以按照Wagner-Nelson方程计算体内吸收百分率,二室模型药物则采用Loo-Riegelman法计算[13]。将血药浓度数据通过DAS 2.1软件分析,并以R2、AIC为判断依据,得出PPNE在大鼠体内的血药浓度经时规律符合二室模型,所以本研究采用Loo-Riegelman法对PPNE的体内外相关性进行分析,并且根据相关系数r大于临界值(P<0.001),可以确定PPNE的体外累积释放率与体内吸收百分数有良好的相关性。
| [1] | De La Fuente R N, Rodrigues B, Moraes-Silva I C, Souza L E, Sirvente R, Mostarda C, et al. Cholinergic stimulation with pyridostigmine improves autonomic function in infarcted rats. Clin Exp Pharmacol Physiol[J]. 2013, 40 :610–616 . |
| [2] | Said S, Cooper C J, Alkhateeb H, Elhanafi S, Bizet J, Gosavi S, et al. Pyridostigmine-induced high grade SA-block in a patient with myasthenia gravis. Am J Case Rep[J]. 2013, 11 :359–361 . |
| [3] | Sieb J P, Köhler W. Benefits from sustained-release pyridostigmine bromide in myasthenia gravis:results of a prospective multicenter open-label trial. Clin Neurol Neurosur[J]. 2010, 112 :781–784 . |
| [4] | 熊华蓉, 谭群友, 罗文, 王睿, 赵春景, 张景勍. 美斯地浓缓释片体外释放与体内吸收的相关性. 中国医院药学杂志[J]. 2012,32 :999–1002. |
| [5] | Akbayram S, Akgun C, Doğan M, Sayin R, Caksen H, Oner A F. Use of pyridoxine and pyridostigmine in children with vincristine-induced neuropathy. Indian J Pediatr[J]. 2010, 77 :681–683 . |
| [6] | Leong C F, Aini-Ardena M, Cheong S K, Norris N. Effect of pyridostigmine (Mestinon) on human platelet aggregation. Malays J Pathol[J]. 2009, 31 :45–52 . |
| [7] | Tan Q Y, Wang N, Yang H, Zhang L K, Liu S, Chen L, et al. Characterization, stabilization and activity of uricase loaded in lipid vesicles. Int J Pharm[J]. 2010, 384 (1/2) :165–172 . |
| [8] | 孙全, 杨林, 陈学梁, 赵德璋, 张景勍. 溴吡斯的明纳米乳体外释放行为评价. 中国医院药学杂志[J]. 2015,35 :132–135. |
| [9] | Honório Tda S, Pinto E C, Rocha H V, Esteves V S, dos Santos T C, Castro H C, et al. In vitro-in vivo correlation of efavirenz tablets using GastroPlus®. AAPS PharmSciTech[J]. 2013, 14 :1244–1254 . |
| [10] | 钟萌, 冯悦, 孙全, 周云莉, 张景勍. 阿奇霉素泡囊体外释放与体内吸收的相关性. 第二军医大学学报[J]. 2014,35 :1034–1037. |
| [11] | 熊华蓉, 谭群友, 赵德璋, 王睿, 张景勍. 溴吡斯的明12 h缓释片的体外释放行为相关性研究. 第三军医大学学报[J]. 2012,34 :1411–1413. |
| [12] | Tan Q Y, Hu N N, Liu G D, Yin H F, Zhang L, Wang H, et al. Role of a novel pyridostigmine bromide-phospholipid nanocomplex in improving oral bioavailability. Arch Pharm Res[J]. 2012, 35 :499–508 . |
| [13] | 国家药典委员会.中华人民共和国药典[S].四部.北京:中国医药科技出版社,2015:通则369-370. |
| [14] | 金朝辉.HT缓释片的研制及体内外相关性评价[D].成都:四川大学,2004. |
 2016, Vol. 37
2016, Vol. 37


