2. 浙江大学医学院附属邵逸夫医院头颈外科, 杭州 310016;
3. 第二军医大学基础部免疫学教研室, 上海 200433
2. Department of Head and Neck Surgery, Sir Run Run Shaw Hospital, Zhejiang University, Hangzhou 310016, Zhejiang, China;
3. Department of Immunology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
肝脏移植是挽救各种终末期肝病最有效的方法,然而,越来越多的肝病患者由于供体短缺而在等待中死亡。心死亡器官捐献(donation after cardiac death,DCD)能够扩展供体来源,可在很大程度上解决供体短缺问题,因而受到广泛的关注和深入的研究。有报道称DCD能够扩展1.53倍供体来源[1]。与脑死亡器官捐献(donation after brain death,DBD)相比,DCD供体器官获取前不可避免会经历低血压和缺氧等病理过程,DCD肝移植术后原发性移植物无功能、肝动脉血栓形成和缺血性胆道病变等严重并发症的发生率明显增加[2]。目前对于DCD供肝质量的评估缺乏统一标准,一般认为供肝获取前低血压状态及其持续时间对于术后移植物功能的恢复具有重要影响。本研究拟建立一种小鼠肝脏持续低灌注模型,模拟DCD前的供肝状态,并研究持续低灌注肝脏对热缺血再灌注损伤的耐受性,为后续研究奠定基础。
1 材料和方法 1.1 实验动物及分组清洁级雄性6~8周龄C57BL/6小鼠,体质量18~20 g[第二军医大学实验动物中心提供,实验动物使用许可证号SYXK(沪)2007-0003]。首先随机分为5组:假手术组(Sham)、低灌注3 d组、低灌注7 d组、低灌注14 d组以及低灌注21 d组,每组8只。动物分笼饲养于第二军医大学实验动物中心,提供标准饮食,动物实验遵循学校及实验室相关规定。
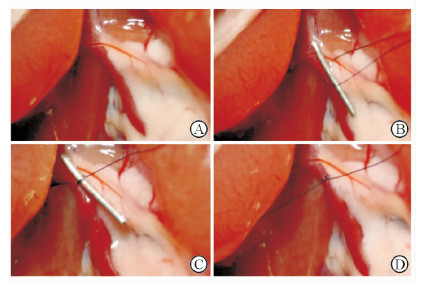
1.2 小鼠肝脏低灌注模型的建立小鼠经戊巴比妥钠(50 mg/kg)腹腔注射麻醉生效后,双目显微镜(日本Olympus公司)下,沿腹正中线切开,游离肝脏,暴露肝门,沿门静脉主干游离门静脉至门静脉左右支分叉处,在门静脉靠近肝门处平行放置一根钝针头(1 mL注射器针头),用8-0丝线在近肝门处连同门静脉一起结扎,移出钝针头(图 1)。假手术组开腹后仅做门静脉游离。
|
图 1 小鼠肝脏低灌注模型手术过程 Fig 1 Surgical procedure of hepatic hypoperfusion in mice A: Expose and separate the portal vein; B: Parallel a blunt syringe needle (1 mL) with the portal vein; C: Knot the blunt needle with the portal vein; D: Take out the blunt needle |
1.3 肝脏缺血再灌注损伤的诱导
70%肝脏缺血再灌注损伤的诱导方法按照Yang等[3]的方法进行,麻醉生效后,沿腹正中切口暴露肝脏,游离肝脏并剪开韧带及系膜,用小血管夹(上海医疗器械有限公司医疗设备厂)钳夹阻断供应左外叶及中叶的血管。60 min后松开血管夹以恢复肝脏血流进行再灌注,若肝脏颜色未发生变化则表明复流不顺畅,终止实验。假手术组按相同方法暴露游离肝脏,但不阻断血管。术后用4-0缝线分两层连续缝合切口。
1.4 肝功能检测沿小鼠下腔静脉采集血液0.5 mL于EP管中,静置30 min后离心并抽取上清液于另一EP管中,丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)的检测在长海医院临床检验科完成。
1.5 组织病理学检测取小鼠左外叶肝脏用4%多聚甲醛溶液固定后,将样本包埋于石蜡中。样本制备成4 μm厚的切片,H-E染色。
1.6 统计学处理使用SPSS 10.0软件进行统计分析。实验数据采用 x±s表示,正态分布的两独立样本均数比较使用t检验,非正态分布的两独立样本比较使用Mann-Whitney U检验,多个样本的比较使用Dunnett-t检验。检验水准(α)为0.05。
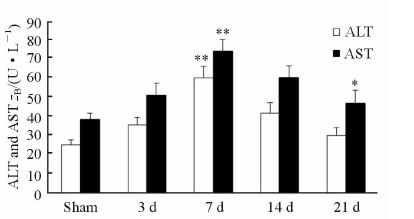
2 结 果 2.1 小鼠肝脏持续低灌注过程中肝功能的变化为了研究低灌注处理对小鼠肝功能的影响,我们在术后3 d、7 d、14 d和21 d取小鼠血清检测ALT和AST的变化(图 2)。Sham组小鼠在术后各个时间点的ALT和AST水平差异无统计学意义,因此我们采用Sham组小鼠各个时间点的ALT和AST平均值作为基线对照。与Sham组相比,经过肝脏低灌注处理的小鼠,术后ALT和AST均有不同程度的升高,并且在7 d达到最高峰[ALT:(60.8±6.2) U/L vs (25.5±2.8) U/L,P<0.001;AST:(74.9±6.1) U/L vs (39.1±3.2) U/L,P<0.001]。在21 d时,ALT基本恢复正常[(30.5±4.3) U/L vs (25.5±2.8) U/L,P=0.12],而AST仍稍高于Sham组[(47.4±6.9) U/L vs (39.1±3.2) U/L,P=0.03]。
|
图 2 小鼠肝脏低灌注后肝功能的变化 Fig 2 Liver function changes after hepatic hypoperfusion in mice ALT: Alanine aminotransferase; AST: Aspartate aminotransferase. *P<0.05, **P<0.01 vs sham. n= 8, x±s |
2.2 小鼠肝脏持续低灌注状态下肝脏形态学的变化
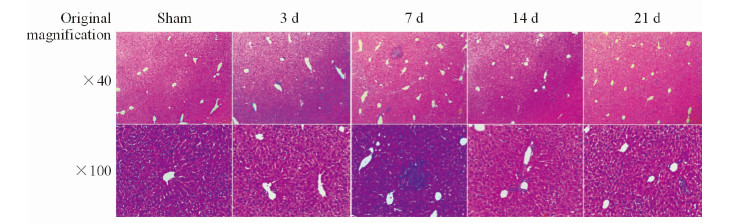
H-E染色显示(图 3),Sham组小鼠肝脏组织形态学表现正常,而经过3 d、7 d、14 d、21 d肝脏低灌注的小鼠出现异常表现,主要是局部区域出现肝细胞肿胀,不同程度的炎细胞浸润,而肝小叶结构基本正常,无明显肝细胞坏死、凋亡等严重肝损伤表现。与其他时间点相比,肝脏低灌注7 d的小鼠肝损伤相对较重,表现为大量淋巴细胞浸润,肝细胞肿胀明显。
|
图 3 小鼠肝脏低灌注时期肝脏组织形态学改变(H-E染色) Fig 3 Liver histomorphological changes during hepatic hypoperfusion in mice (H-E staining) |
2.3 持续低灌注肝脏对热缺血再灌注损伤的耐受性
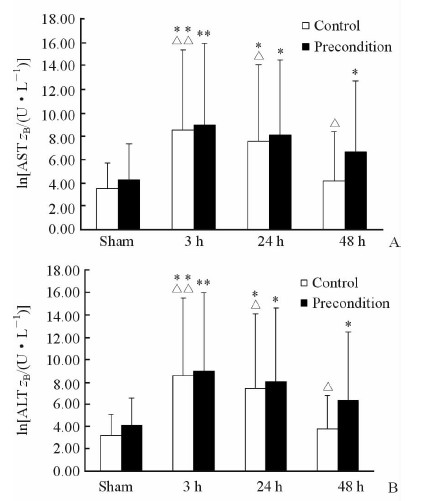
前述结果显示,肝脏持续低灌注7 d的小鼠肝损伤最严重,因此,我们以门静脉缩窄术后7 d的小鼠作为标准肝脏持续低灌注模型。另取20只同周龄雄性C57BL/6小鼠建立标准肝脏持续低灌注模型(预处理组),随机分为4组(每组5只),其中1组作为假手术组(预处理Sham组),另外3组经70%热缺血再灌注诱导,分别在再灌注3 h、24 h和48 h后取血清检测ALT和AST,并取肝脏样本进行组织病理学检查。对照组取20只正常同周龄雄性C57BL/6小鼠,随机分为4组(每组5只),其中1组作为对照Sham组,另外3组行热缺血再灌注手术,同样根据再灌注后3个时间点检测ALT、AST及肝脏病理。经过低灌注处理的小鼠热缺血再灌注(预处理+IR组)后,ALT和AST高于对照组(图 4),且在3 h达到高峰[ALT: (8 217.0±1 111.8) U/L vs (5 597.4±1 015.3) U/L,P=0.004;AST:(8 548.2±1 155.4) U/L vs (5 765.4±956.9) U/L,P=0.003];再灌注48 h时,对照组小鼠ALT和AST均恢复正常[ALT:(47.4±20.1) U/L vs (26.8±6.4) U/L,P>0.05;AST:(70.8±68.3) U/L vs (36.4±9.2) U/L,P>0.05],而经过低灌注处理的小鼠肝酶仍高于对照组[ALT:(608.8±442.9) U/L vs (47.4±20.1) U/L,P=0.008; AST:(861.8±442.8) U/L vs (70.8±68.3) U/L,P=0.008]。组织形态学改变(H-E染色)显示,再灌注3 h时,经过低灌注处理的小鼠肝损伤更严重,表现为肝细胞空泡样变性、坏死以及炎细胞浸润的程度更深(图 5),利用Suzuki半定量评分对预处理+IR组和对照+IR组的缺血再灌注损伤进行评估后发现,肝脏病理损伤和肝酶变化相一致,预处理+IR组和对照+IR组在再灌注3 h后的Suzuki评分分别为10.6±1.1和7.2±0.8,差异有统计学意义(P=0.001)。
|
图 4 小鼠低灌注7 d后及对照组热缺血再灌注处理后的肝功能变化 Fig 4 Transaminase levels in mice with 7 d-hepatic hypoperfusion precondition after warm ischemic-reperfusion injury A: Aspartate aminotransferase (AST); B: Alanine aminotransferase (ALT). *P<0.05, **P<0.01 vs sham; △P<0.05, P<0.01 vs precondition. n= 5, x±s |

|
图 5 小鼠肝脏低灌注7 d后缺血再灌注损伤的组织形态学改变(H-E染色) Fig 5 Liver histomorphological changes in warm ischemic-reperfusion (IR) injury mice preconditioned with 7 d-hepatic hypoperfusion (H-E staining) |
3 讨 论
DCD肝移植最早起源于20世纪60年代,由于术后移植物原发性无功能等并发症发生率较高,患者预后极差,再加之DBD肝移植的预后优于DCD,DCD肝移植一度遭摒弃不用。直至20世纪90年代,为了解决供体资源紧缺的问题,DCD肝移植在欧美国家重新开始使用,并且得到广泛而深入的研究。Chaib等[4]利用数学模型分析DCD对肝移植的潜在影响,认为假如有1%、5%和10%的死亡患者能成为DCD供体,那么供体队列名单将相应地减少8%、27%和37%。世界各移植中心报道的DCD肝移植占所有肝移植的比例为4%~10%[5]。我国DCD肝移植起步较晚,但发展较快,根据中国肝移植注册(CLTR)统计,截止到2013年12月,我国累计完成DCD肝移植1 120例,其中2013年DCD肝移植例数达到626例,占当年肝移植总数的26.02%[6]。
随着DCD肝移植的深入研究和广泛开展,DCD肝移植患者术后生存率不断提高,但移植物生存率仍不如DBD肝移植,究其原因,主要是DCD供体获取前存在较长时间的低灌注状况。DCD供体在临终前心肺功能不可逆丧失导致机体经历低血压、缺氧和休克过程,因而会对术后组织细胞活性和移植物功能产生显著影响[7]。目前对供体热缺血损伤的研究都集中在供体心脏停跳到冷灌注开始的这一段时间[8-9],而我们在临床上观察到某些DCD供体在入住ICU时即存在低血压和缺氧等情况,ICU停留时间与DCD肝移植预后存在一定关系。针对这一较长时间的器官低灌注损伤,目前研究尚不深入。
我们通过缩窄小鼠门静脉来模拟肝脏持续低灌注状态,严格控制小鼠体质量和周龄保证小鼠门静脉周径基本一致,进而通过钝针头结扎的方法使缩窄后的门静脉周径保持一致,以消除门脉结扎程度不一所导致的误差。实验结果显示,这一模型诱导出的肝损伤表现为肝酶轻度升高、肝细胞肿胀以及炎细胞浸润,并无明显肝细胞坏死、凋亡等严重肝损伤表现。这与DCD供体临床表现相一致,低灌注的DCD供肝主要是对缺血再灌注损伤的耐受能力下降,本身并不表现为严重的肝损伤。本研究发现,门静脉缩窄术后7 d肝功能损伤最为明显,可作为肝脏持续低灌注标准模型,在小鼠肝脏低灌注7 d的基础上对小鼠进行70%缺血再灌注手术,实验结果如实验前所料,经过低灌注热缺血损伤的小鼠缺血再灌注3 h(急性期)肝损伤比对照组更严重,且损伤恢复时间明显延长。
目前认为,机体血流动力学紊乱和肝细胞生物能量的缺乏是引发肝脏热缺血损伤一系列病理改变的主要诱因,其中涉及到的机制主要是氧自由基释放引起肝窦内皮细胞损伤、炎细胞浸润、血小板黏附等[10]。与传统的UW液等器官保存液相比,采用机械灌注的方法保存DCD供肝能明显改善器官功能。连续的机械灌注可以提供氧、糖、氨基酸和核苷酸等供体器官所必需的基本底物。然而机械灌注系统对DCD肝移植的临床疗效并不如DCD肾移植,这提示我们针对DCD供肝的保存仍有继续改进的必要。在本实验中,小鼠肝脏低灌注引起的热缺血损伤以及小鼠在低灌注后的缺血再灌注损伤中都存在大量以淋巴细胞为主的炎细胞浸润。炎细胞浸润是介导热缺血损伤的关键因素,减轻热缺血损伤时炎细胞浸润程度是改善DCD肝移植预后的重要介入点。我们猜测,炎细胞浸润可能与氧自由基损伤肝窦内皮细胞后趋化因子的激活、表达、释放以及蛋白转录后修饰有密切的关系。我们希望通过后续实验验证这一猜测,找到减轻炎细胞浸润的调控点,进而改善DCD供体的保存方法,减轻热缺血损伤,进一步提高DCD肝移植的预后。
| [1] | Grewal H P, Willingham D L, Nguyen J, Hewitt W R, Taner B C, Cornell D, et al. Liver transplantation using controlled donation after cardiac death donors:an analysis of a large single-center experience. Liver Transpl[J]. 2009, 15 :1028–1035 . |
| [2] | 范晓礼, 叶殿发, 王彦峰, 李玲, 钟自彪, 李弦, 等. 比较心脏死亡器官捐赠与脑死亡器官捐赠供肝肝移植预后的荟萃分析. 中华器官移植杂志[J]. 2014,35 :86–93. |
| [3] | Yang J, Wang X, Song S, Liu F, Fu Z, Wang Q. Near-term anti-CD25 monoclonal antibody administration protects murine liver from ischemia-reperfusion injury due to reduced numbers of CD4+ T cells. PLoS One[J]. 2014, 9 :e106892. |
| [4] | Chaib E, Massad E. The potential impact of using donations after cardiac death on the liver transplantation program and waiting list in the state of Sao Paulo, Brazil. Liver Transpl[J]. 2008, 14 :1732–1736 . |
| [5] | Reddy S, Zilvetti M, Brockmann J, McLaren A, Friend P. Liver transplantation from non-heart-beating donors:current status and future prospects. Liver Transpl[J]. 2004, 10 :1223–1232 . |
| [6] | 霍枫, 李鹏. DCD肝移植的过去、现在和未来. 肝脏外科杂志[J]. 2014,22 :84–86. |
| [7] | Massip-Salcedo M, Roselló-Catafau J, Prieto J, Avíla M A, Peralta C. The response of the hepatocyte to ischemia. Liver Int[J]. 2007, 27 :6–16 . |
| [8] | de Vera M E, Lopez-Solis R, Dvorchik I, Campos S, Morris W, Demetris A J, et al. Liver transplantation using donation after cardiac death donors:long-term follow-up from a single center. Am J Transplant[J]. 2009, 9 :773–781 . |
| [9] | 邰强, 何晓顺, 杨建安, 朱晓峰, 马毅, 巫林伟, 等. 大鼠肝移植供肝热缺血时间与胆道损伤的关系. 中华实验外科杂志[J]. 2010,27 :1457–1459. |
| [10] | Tsukamoto S, Ohkohchi N, Fukumori T, Satomi S. Microcirculatory disturbance is an obstacle to liver transplantation from agonal NHBD. Transplant Proc[J]. 1999, 31 (1/2) :1091–1093 . |
 2016, Vol. 37
2016, Vol. 37


