2. 福建省高血压研究所, 福州 350005
2. Hypertension Research Institute of Fujian Province, Fuzhou 350005, Fujian, China
目前,全世界有60多个国家的老年人口达到或超过人口总数的10%[1],进入了人口老龄化社会行列。中国也已步入老龄化社会,中老年人高血压、糖尿病、高血脂、冠心病、动脉粥样硬化等慢性疾病的发病率增高,这些疾病都可以引起肾脏损害,并且老年人还存在进行性生理性肾功能减退,慢性肾脏疾病的发病率增高,目前老年人肾功能衰竭进入透析的患者并不少见。腹膜透析(peritoneal dialysis,PD) 是终末期肾病的有效治疗方法之一,该技术的成功实施必须依赖于腹膜结构和功能的完整。目前的研究集中在长期透析或透析后腹膜炎导致的腹膜纤维化发病机制及干预措施,有关正常增龄对腹膜结构改变的影响及其机制的研究极少。腹膜组织与人体其他组织器官一样存在增龄性老化的现象,这种腹膜增龄性衰老是否影响腹膜透析的疗效?有何干预措施?这些是老龄化社会值得探讨的问题。已有研究显示,老龄是腹膜透析患者腹膜炎发生的重要危险因素[2,3]。随着现代遗传学、细胞生物学、分子生物学等学科的快速发展,衰老机制的研究已趋向于分子水平。本研究拟观察不同年龄组大鼠腹膜结构的组织学和分子病理学改变。锌指蛋白转录因子(Krüppel-like factors,KLFs)家族中的KLF15是新近被关注的抗氧化应激和抗纤维化因子,其在腹膜组织是否表达尚未见报道。本研究重点观察了增龄过程中KLF15在腹膜组织中的特征性变化。
1 材料和方法 1.1 实验动物分组与取材SPF级雄性SD大鼠,分为3组:幼年组(1个月龄)、青年组(8个月龄)、老年组(18个月龄),每组6只,由上海斯莱克实验动物有限责任公司提供[动物许可证号:SCXK(沪)2007-0005]。每只大鼠单笼饲养于比较医学科清洁级动物房。饲养条件:12 h光照、室温24℃、45%相对湿度,整个实验过程大鼠的饮食及饮水不受限制。饲养员具有实验动物从业人员岗位证书。处死后取腹部切口对侧壁层腹膜,用10%中性甲醛固定16~24 h后梯度乙醇常规脱水、二甲苯透明、浸蜡及石蜡包埋,4 μm切片行苏木精-伊红(H-E)染色及β-半乳糖苷酶(β-Gal)染色。另取肠系膜组织,剪碎后放入装有0.8 mL RNASafer的离心管中,4℃过夜后转入-70℃冰箱保存。
1.2 H-E染色将制作好的切片烤片过夜后脱蜡水化;苏木精染色8~10 min,流水洗净;1%盐酸分化数秒,流水洗净;氨水返蓝数分钟,75%乙醇数秒;伊红染色3~6 s,流水洗净;再梯度乙醇脱水;中性树胶封片。H-E染色后在×200倍镜下对每张切片随机选取20个不同视野,测定腹膜垂直厚度,计数腹膜间皮细胞和单位面积腹膜组织中血管。
1.3 β-Gal染色PBS冲洗切片,按衰老相关β-Gal染色试剂盒(Biovision,K802-250)说明书操作,染色后37℃无CO2孵育12 h,衰老的细胞染色后呈蓝色即阳性细胞。光镜下每只大鼠随机选2 张切片,每张切片选取细胞分布均匀的5 个高倍视野作为观察区,以阳性细胞总数除以计数的高倍视野总数,计算平均每个高倍视野内β-Gal染色的阳性细胞数。
1.4 腹膜组织转化生长因子β1(transforming growth factor-beta 1, TGF-β1)、 KLF15 mRNA的含量取100 mg肠系膜组织置于1.5 mL离心管中;加入1 mL TRIzol液中,冰浴充分匀浆,将组织匀浆液转移至1.5 mL离心管中室温孵育5 min;加入200 μL氯仿,剧烈震荡10下,室温下静置3 min;4℃、12 000×g离心15 min;再将上清转移至新的1.5 mL离心管中,再加入等量异丙醇,混匀后室温下静置10 min;4℃、12 000×g离心10 min;弃上清,底部可见白色的RNA沉淀,加入1 mL现配的75%乙醇混匀;4℃、7 500×g离心5 min;弃上清,RNA沉淀在室温中干燥10~20 min,加入30~50 μL的0.1%DEPC水,使沉淀溶解,-70℃冰箱保存备用,并检测RNA纯度和浓度,用M-MLV反转录酶反转录mRNA后进行PCR检测,所有操作均按实际说明书进行。引物序列如下:TGF-β1基因引物上游序列5′-CTT CAG CTC CAC AGA GAA GAA CTG-3′,下游序列5′-CAC GAT CAT GTT GGA CAA CTG CTC-3′;KLF15基因引物上游序列5′-TCC TCC AAC TTG AAC CTG TC-3′,下游序列5′-CTT GGT GTA CAT CTT GCT GC-3′;β-actin基因引物上游序列5′-AGG TCT TTA CGG ATG TCA ACG-3′,下游序列5′-GTC CCT GTA TGC CTC TGG TC-3′。循环条件:94℃ 5 min;94℃30 s,退火30 s(TGF-β1 57℃、KLF15 62℃、β-actin 58℃),72℃延伸30 s,TGF-β1、KLF15、β-actin分别运行35、40、35个循环;72℃终末延伸7 min。电泳后紫外灯下观察,Fluor-S凝胶成像系统(Bio-Rad)成像,图片用Gelpro软件分析处理,计算目的条带与β-actin的光密度比值。
1.5 腹膜组织TGF-β1 蛋白和KLF15蛋白的表达取大鼠肠系膜80 mg,玻璃匀浆器磨碎后,加入蛋白裂解液1 mL裂解20 min;将裂解液移至1.5 mL离心管中,4℃ 12 000×g离心20 min;取上清分装于0.5 mL离心管中并置于-70℃保存。BCA法检测样品蛋白含量;上样前将蛋白样品于100℃水中加热 3 min,使蛋白质变性;采用SDS-PAGE进行垂直板电泳,每孔加样20 μL;在5%浓缩胶电泳时采用低电压(80 V),在12%分离胶电泳时采用高电压(120 V),待溴酚蓝迁移到分离胶底部0.5 cm处时,关闭电源;使用湿式转膜装置,恒流300 mA,70 min,再将分离胶上的蛋白条带转移至硝酸纤维素膜上;将电转膜置于5%脱脂奶粉(TBS配制)中室温封闭2 h;TBST洗膜,加一抗(TGF-β1 1∶200,KLF15 1∶250,β-actin 1∶1 000),4℃孵育12 h;TBST洗膜,加1∶4 000稀释的酶标二抗,室温孵育1 h;TBST洗膜,ECL试剂化学发光并曝光显影、定影,应用成像系统对胶片进行拍照,Quantity One图像分析软件扫描条带灰度值,计算各组条带和内参照β-actin的比值。
1.6 统计学处理所有数据以x±s表示。采用SPSS 11.5软件包进行统计学处理,多组间均数比较采用单因素方差分析,组间两两比较采用LSD检验,检验水准(α)为0.05。
2 结 果 2.1 不同年龄组大鼠一般情况随着年龄增加,大鼠体质量逐渐增加,老年大鼠体质量与幼年、青年组差异有统计学意义(P<0.05);成年大鼠收缩压比幼年组增高(P<0.05);老年大鼠血糖、血脂、尿素氮、肌酐、天冬氨酸转氨酶、丙氨酸转氨酶等指标与幼年组比均升高(P<0.05),详见表 1、表 2。
|
|
表 1 各组大鼠体质量和血压 Tab 1 各组大鼠体质量和血压 |
|
|
表 2 各组大鼠血液生化指标改变 Tab 2 Changes of blood biochemical indices of rats in each group |
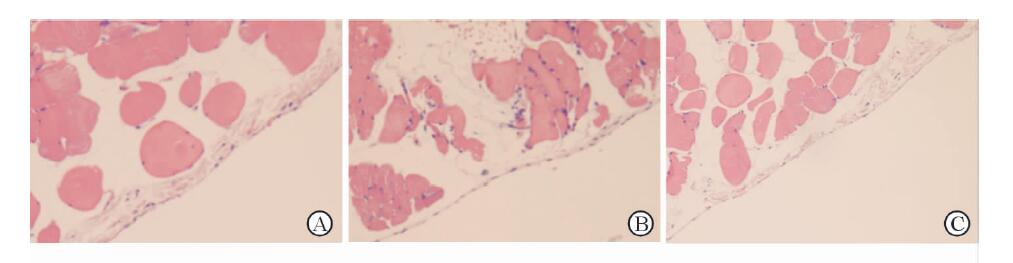
幼年组壁层腹膜表面覆盖一层完整密集的扁平腹膜间皮细胞,间皮下基质薄,间皮下基质内偶见成纤维细胞,间皮下血管并不丰富(图 1A);青年组腹膜表面间皮细胞连续,细胞稍细长,偶见间皮细胞脱落基质裸露,间皮下基质稍增厚,并可见部分成纤维细胞增生和血管增生(图 1B);老年组腹膜表面间皮细胞稀疏不完整,部分间皮细胞脱落基质裸露,间皮下基质明显增厚,并可见大量成纤维细胞增生,血管增生明显增多(图 1C)。半定量计数分析显示,随着年龄增长腹膜厚度逐渐增厚(P<0.05)、间皮细胞数量逐渐减少(P<0.05),间皮下基质血管增生更明显(P< 0.05)。见表 3。
|
图 1 大鼠壁层腹膜H-E染色 Fig 1 H-E staining of rat anterior abdominal wall A: Juvenile group; B: Youth group; C: Elderly group. Original magnification:×200 |
|
|
表 3 各组大鼠腹膜形态学改变半定量计数 Tab 3 Semi-quantitative analysis of rat peritoneum morphology in each group |
如图 2所示,β-Gal染色阳性表达细胞的细胞质呈现蓝色。随着大鼠年龄增长,腹膜组织中β-Gal阳性细胞逐渐增多,幼年组、青年组、老年组平均每个高倍视野内的阳性细胞数依次是10.1±3.3、22.2±2.8、31.0±2.8个,组间比较差异有统计学意义(P<0.05)。
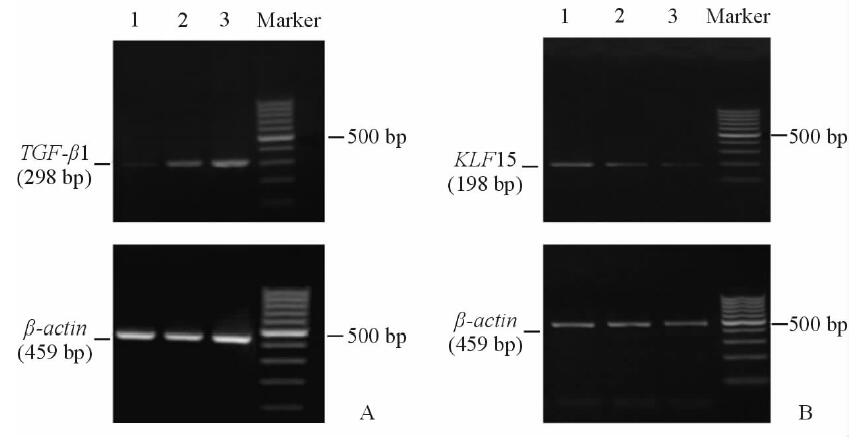
2.4 RT-PCR检测各组大鼠肠系膜组织TGF-β1 mRNA和KLF15 mRNA的表达TGF-β1 mRNA在幼年组、青年组、老年组的大鼠腹膜组织中表达,其D值半定量分析结果依次为0.11±0.02、0.46±0.04、0.85±0.04,随着年龄增加而递增(P<0.05,图 3A)。KLF15 mRNA在幼年组、青年组、老年组的大鼠腹膜组织中表达,其D值半定量分析结果依次为0.69±0.09、0.40±0.04、0.02±0.01,随着年龄增加而递减(P<0.05,图 3B)。

|
图 2 大鼠壁层腹膜β-半乳糖苷酶染色 Fig 2 β-Gal actosidase staining results of rat anterior abdominal wall A: Juvenile group; B: Youth group; C: Elderly group. Original magnification:×200 |
|
图 3 各组大鼠肠系膜TGF-β1 mRNA(A)和KLF15 mRNA(B)的表达 Fig 3 Comparison of TGF-β1 mRNA (A) and KLF15 mRNA (B) expression in rat mesentery in each group 1: Juvenile group; 2: Youth group; 3: Elderly group.TGF-β1:Transforming growth factor-beta 1; KLF15: Krüppel like factor 15 |
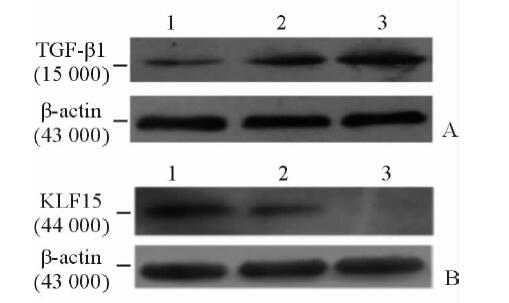
TGF-β1蛋白在幼年组、青年组、老年组的大鼠腹膜组织中表达,其半定量分析D值依次为0.08±0.03、0.42±0.36、0.81±0.60,随着年龄增加而递增(P<0.05,图 4A)。KLF15 蛋白在幼年组、青年组、老年组的大鼠腹膜组织中表达,其半定量分析D值依次为0.87±0.03、0.41±0.04、0.12±0.03,随着年龄增加而递减(P<0.05,图 4B)。
|
图 4 各组大鼠肠系膜TGF-β1(A)和KLF15(B)蛋白含量 Fig 4 TGF-β1 (A) and KLF15 (B) protein expression in rat mesentery in each group 1: Juvenile group; 2: Youth group; 3: Elderly group; TGF-β1:Transforming growth factor-beta 1; KLF15: Krüppel like factor 15 |
肠系膜TGF-β1与KLF15蛋白表达呈负相关(r=-0.97,P<0.05)。
3 讨 论衰老又称老化,是指生物体在生命后期的一种全身性、多方面、循序渐进的退化过程,这种退化过程在整体水平、组织、细胞以及分子水平均有体现。目前关于衰老机制相关的主要有端粒及端粒酶[4]、氧化应激[5]、衰老相关因子[6]等学说,尚没有一种学说能完全阐释衰老的机制。国内外有关腹膜衰老相关的研究均集中于由腹膜透析相关的物理、化学、炎症等应激因素诱导的“细胞应激性早衰状态”(stress-induced premature senescence,SIPS) 。这种形式的细胞衰老不依赖端粒的缩短,也与细胞的具体增殖代次无关[7],可能与腹膜增龄性衰老并不完全一致。然而未见腹膜增龄性衰老的文献报道,本研究试图发现腹膜增龄性老化的分子病理学特征。
腹膜主要由间皮细胞及间皮下基质和毛细血管网组成,腹膜间皮细胞丢失和基质毛细血管增生是病理性腹膜纤维化的特征性表现。在胚胎发育过程中,间皮细胞可以发育成冠状动脉,也可以分化为内皮细胞、血管平滑肌细胞和周细胞,成年的间皮细胞也保留了这部分潜能。此外,在间皮细胞分化过程中另一个关键事件是向间充质细胞转化(epithelial-mesenchymal transition,EMT)的潜能,转化的成纤维细胞样细胞具有分泌细胞外基质(extracellular matrix,ECM)的能力。在病理性刺激下促发间皮细胞的促血管增生和EMT是导致腹膜组织纤维化的关键[8],也是腹膜增龄性衰老的基础。本研究发现随着大鼠年龄的增大,老年大鼠腹膜与幼、青年大鼠相比腹膜增厚、表面间皮细胞稀疏、部分间皮细胞脱落基质裸露、间皮下基质明显增厚,成纤维细胞和血管增生明显增多,与长期腹膜透析或腹膜炎后腹膜早衰所致的腹膜纤维化表现类似[9]。
Dimri等[10]发现:在体外培养的人二倍体成纤维细胞中,β-Gal染色阳性率随代龄增加而增加,故把这种中性的β-Gal定义为衰老相关的β-Gal (senescence-associated-β-galactosidase, SA-β-Gal),同时在供体皮肤成纤维细胞及表皮角质细胞中,SA-β-Gal 的表达也发现有随增龄增长而增加的现象。SA-β-Gal在衰老细胞中特异性表达,这一特点在衰老前细胞、休眠细胞和静止状态细胞中都不出现,因此是目前应用最为广泛的鉴定细胞衰老的生物学指标。本研究结果显示,随年龄增大β-Gal染色阳性细胞增多(P<0.05),证实了腹膜存在增龄性衰老。
TGF-β1是一种多效性细胞因子,参与包括细胞生长和分化、衰老、肿瘤、炎症、血管生成、ECM沉积等一系列过程[11]。TGF-β1 通路似乎是多个组织衰老的主要元凶,它可以通过经典的Smads家族传递细胞周期抑制信号使不同器官的多个干细胞停滞于细胞周期G1期,从而诱导细胞发生衰老[12] 。TGF-β1也是目前公认的致透析相关性腹膜纤维化的共同通路,参与了腹膜纤维化启动和维持阶段的整个进程。近年研究结果证实,与腹膜纤维化紧密相关的细胞因子、炎症因子及腹膜EMT的激活均以TGF-β1的高表达为核心[13]。体外培养的人腹膜间皮细胞中TGF-β1的分泌增加,导致细胞氧化应激,加速了腹膜间皮细胞的衰老[14,15]。
KLFs家族,是真核生物中存在的一类调控基因转录的结合蛋白,它高度保守的羧基末端含3个串联的Cys2His2 型锌指结构,用于特异性结合富含GC盒(即 CACCC 盒)的靶分子启动子的 DNA 及 RNA 序列,进而调控基因表达,影响细胞增殖、 分化及胚胎发育。目前共有17个KLFs因子被确认。其中KLF15在组织器官尤其在心脏、肾、肝、脂肪细胞、骨骼肌中广泛表达。研究显示,KLF15通过调节糖代谢参与了糖尿病的发生机制,KLF15高表达能改善胰岛素抵抗,减少氧化应激[16,17,18]。KLF15被证实是抑制心肌纤维化、抗血管炎症、治疗心衰的新靶点[19,20,21,22]。 KLF15对肾脏纤维化同样有抑制作用[23],同时是足细胞的保护因子[24]。
本实验发现在不同年龄分组的大鼠腹膜组织中,TGF-β1表达水平随年龄增加而递增,而KLF15因子表达水平随年龄增加而递减,且两者表达呈现负相关性。推测KLF15因子是TGF-β1的拮抗因子,显示了大鼠腹膜自然衰老的分子病理学改变,KLF15可能成为将来干预腹膜衰老的靶点。
| [1] | 刘文,焦佩.国际视野中的积极老龄化研究[J].中山大学学报:社会科学版,2015(1):167-180. |
| [2] | Okayama M, Inoue T, Nodaira Y, Kimura Y, Nobe K, Seto T, et al.Aging is an important risk factor for peritoneal dialysis-associated peritonitis[J].Adv Perit Dial, 2012, 28:50-54. |
| [3] | Nessim S J, Bargman J M, Austin P C, Story K, Jassal S V.Impact of age on peritonitis risk in peritoneal dialysis patients:an era effect[J].Clin J Am Soc Nephrol, 2009, 4:135-141. |
| [4] | Matsuo T, Shay J W, Wright W E, Hiyama E, Shimose S, Kubo T, et al.Telomere-maintenance mechanisms in soft-tissue malignant fibrous histiocytomas[J].J Bone Joint Surg Am, 2009, 91:928-937. |
| [5] | Harper M E, Bevilacqua L, Hagopian K, Weindruch R, Ramsey J J.Ageing, oxidative stress, and mitochondrial uncoupling[J].Acta Physiol Scand, 2004, 182:321-331. |
| [6] | Zhou R, Han L, Li G, Tong T.Senescence delay and repression of p16INK4a by Lsh via recruitment of histone deacetylases in human diploid fibroblasts[J].Nucleic Acids Res, 2009, 37:5183-5196. |
| [7] | Toussaint O, Royer V, Salmon M, Remacle J.Stress-induced premature senescence and tissue ageing[J].Biochem Pharmacol, 2002, 64(5/6):1007-1009. |
| [8] | Witowski J, Ksiazek K, Jorres A.New insights into the biology of peritoneal mesothelial cells:the roles of epithelial-to-mesenchymal transition and cellular senescence[J].Nephron Exp Nephrol, 2008, 108:e69-e73. |
| [9] | 韦永光,林沁,戢晴,郑丰.舒洛地特对腹膜透析大鼠腹膜结构和功能的作用[J].第二军医大学学报,2011,32:276-281. WEI Y G, LIN Q, JI Q, ZHENG F. Effect of sulodexide on peritoneal morphology and function of peritoneal dialysis rats[J].Acad J Sec Mil Med Univ, 2011, 32:276-281. |
| [10] | Dimri G P, Lee X, Basile G, Acosta M, Scott G, Roskelley C, et al.A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J].Proc Natl Acad Sci USA, 1995, 92:9363-9367. |
| [11] | Blobe G C, Schiemann W P, Lodish H F. Role of transforming growth factor beta in human disease[J]. N Engl J Med, 2000, 342:1350-1358. |
| [12] | Yousef H,Conboy M J,Morgenthaler A,Schlesinger C, Bugaj L, Paliwal P, et al. Systemic attenuation of the TGF-β pathway by a single drug simultaneously rejuvenates hippocampal neurogenesis and myogenesis in the same old mammal[J]. Oncotarget, 2015, 6:11959-11978. |
| [13] | Hung K Y, Wu K D, Tsai T J. In vitro study of peritoneal fibrosis[J]. Perit Dial Int, 2007, 27(Suppl 2):S72-S75. |
| [14] | Ksiazek K, Mikula-Pietrasik J, Korybalska K, Dworacki G, Jorres A,Witowski J. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion:the role of oxidative stress-induced fibronectin[J]. Am J Pathol, 2009, 174:1230-1240. |
| [15] | Ksiazek K, Mikula-Pietrasik J, Olijslagers S, Jörres A, von Zglinicki T, Witowski J. Vulnerability to oxidative stress and different patterns of senescence in human peritoneal mesothelial cell strains[J]. Am J Physiol Regul Integr Com Physiol, 2009, 296:R374-R382. |
| [16] | Gray S, Feinberg M W, Hull S, Kuo C T, Watanabe M, Sen-Banerjee S, et al.The Krüppel-like factor KLF15 regulates the insulin-sensitive glucose transporter GLUT4[J].J Biol Chem, 2002, 277:34322-34328. |
| [17] | Nagare T, Sakaue H, Matsumoto M, Cao Y, Inagaki K, Sakai M, et al.Overexpression of KLF15 transcription factor in adipocytes of mice results in down-regulation of SCD1 protein expression in adipocytes and consequent enhancement of glucose-induced insulin secretion[J].J Biol Chem, 2011, 286:37458-37469. |
| [18] | Jung D Y, Chalasani U, Pan N, Friedline R H, Prosdocimo D A, Nam M, et al.KLF15 is a molecular link between endoplasmic reticulum stress and insulin resistance[J].PLoS One, 2013, 8:e77851. |
| [19] | Wang B, Haldar S M, Lu Y, Ibrahim O A, Fisch S, Gray S, et al.The Kruppel-like factor KLF15 inhibits connective tissue growth factor (CTGF) expression in cardiac fibroblasts[J].J Mol Cell Cardiol, 2008, 45:193-197. |
| [20] | Leenders J J, Wijnen W J, van der Made I, Hiller M, Swinnen M, Vandendriessche T, et al.Repression of cardiac hypertrophy by KLF15:underlying mechanisms and therapeutic implications[J].PLoS One, 2012, 7:e36754. |
| [21] | Haldar S M, Lu Y, Jeyaraj D, Kawanami D, Cui Y, Eapen S J, et al.KLF15 deficiency is a molecular link between heart failure and aortic aneurysm formation[J].Sci Transl Med, 2010, 2:26ra26. |
| [22] | Lu Y, Zhang L, Liao X, Sangwung P, Prosdocimo D A, Zhou G, et al.Kruppel-like factor 15 is critical for vascular inflammation[J].J Clin Invest, 2013, 123:4232-4241. |
| [23] | Gao X, Huang L, Grosjean F, Esposito V, Wu J, Fu L, et al.Low-protein diet supplemented with ketoacids reduces the severity of renal disease in 5/6 nephrectomized rats:a role for KLF15[J].Kidney Int, 2011, 79:987-996. |
| [24] | Mallipattu S K, Liu R, Zheng F, Narla G, Ma'ayan A, Dikman S, et al.Kruppel-like factor 15(KLF15) is a key regulator of podocyte differentiation[J].J Biol Chem, 2012, 287:19122-19135. |
 2016, Vol. 37
2016, Vol. 37


