慢性瘙痒正成为影响生命质量的健康问题。一项大型流行病学的调查表明,人群中大约有8%~12%的人遭受慢性瘙痒的痛苦[1]。其中,一些患者出现难以忍受的顽固性瘙痒症状,引起严重的睡眠剥夺,导致疲倦、疲劳、压抑甚至自杀倾向[2]。Sun等[3]的研究显示,背根神经节(dorsal root ganglia,DRG)内表达胃泌素释放肽(gastrin-releasing peptide, GRP)的中、小神经元的中枢突起投射到脊髓后角Ⅰ层,与Ⅰ层特异表达GRP 受体的神经元形成突触联系,将来自外周的痒信号向中枢传递,因此可将DRG中GRP 表达阳性神经元视作痒神经元。到2010年为止,虽然对痒的神经通路、致痒介质和受体等的研究取得了显著进展[4],但对全身性疾病引起的顽固性瘙痒的发病机制仍不清楚,如何治疗慢性瘙痒已成为临床医生面临的难题。
溶血磷脂酸(lysophosphatidic acid, LPA)是一种磷脂代谢产物。到目前为止,已发现6种对LPA敏感的受体亚型LPA1~ LPA6,它们都属于G蛋白偶联受体。研究表明,LPA与神经病理性疼痛的启动有关,主要通过LPA1受体介导[5]。LPA与慢性胆汁性瘙痒、Hodgkin 淋巴瘤瘙痒[6]以及皮肤损伤或术后皮肤切口愈合过程产生的局部瘙痒有关[7]。但LPA引起瘙痒的机制还不清楚,LPA的致痛与致痒是否存在关联尚待探索。
1 材料和方法 1.1 主要材料兔抗LPA1受体抗体购自Abcam公司;山羊抗GRP抗体和Ki16425 (LPA1和LPA3受体拮抗剂)购自Santa Cruz公司;FITC标记的驴抗兔IgG和TRITC标记的驴抗山羊IgG均购自Jackson公司;18∶1溶血磷脂酸(LPA 1-oleoyl-sn-glycero-3-phosphate)购自Sigma Aldrich 公司。
1.2 Real-time PCR检测LPA1~ LPA6 mRNA的表达用TRIzol试剂提取DRG组织的mRNA,用紫外分光光度仪进行纯度鉴定和定量。从GenBank中检索小鼠β-actin、小鼠LPA1~ LPA6型受体基因序列,应用Primer Premier 5.0软件设计引物如下。β-actin引物序列:上游5′-CCT CTA TGC CAA CAC AGT 3-′,下游5′-AGC CAC CAA TCC ACA CAG-3′。LPA1~ LPA6引物序列:LPA1,上游5′-GTG GTG GTG GTG ATT GTA GT-3′,下游5′-ATA GTC CTC TGG CGA ACA TAG-3′;LPA2,上游5′-CCG TCT GGT TCT CAA TCA T-3′,下游5′-CAC CTC TTC TGT CCC AAT AG-3′;LPA3,上游5′-ACA GAC ACA GCG GAC GAG T-3′,下游5′-CAG CAA TGA CCA GGG AGT TAG-3′;LPA4,上游5′-TGA AAA TGA GAA GTG AGA CGG-3′,下游5′-CGG AAG GGA TAG ACA ATG G-3′;LPA5,上游5′-GGG TGC TGA TGA TAA TGG TG-3′,下游5′-AGG TTG CGA AGG GTG TTA C-3′;LPA6,上游5′-TGT TTC TGT TTT GTG CCC TAC-3′,下游5′-AGT CAC TTC TTC TAA CCG ACC A-3′。取上述抽提的mRNA为模板,利用RNA反转录试剂盒(碧云天)按以下体系进行反转录反应: 42℃ 60 min,72℃ 10 min,合成的cDNA 4℃保存。取适量cDNA为模板进行PCR反应。反应条件:94℃ 5 min;94℃ 30 s,56~62℃ 30 s,72℃ 1 min,40个循环。利用其Ct值进行相对定量,然后通过公式2-ΔΔCt计算后,比较不同样本中LPA1~ LPA6 mRNA的表达量。
1.3 免疫荧光染色观察LPA1在DRG内痒神经元的表达小鼠灌流后取出L4、L5背根神经节,用4% 多聚甲醛(paraformaldehyde,PFA)固定4~6 h,然后用20%蔗糖-PBS、30%蔗糖-PBS溶液梯度脱水2 d。冰冻切片厚度10 μm,将其放入柠檬酸钠抗原修复液中,92.5℃水浴10 min,取出后冷却至常温。0.01 mol/L PBS漂洗3次,每次5 min。加二抗来源的封闭血清室温封闭1 h。吸去封闭血清,加入一抗LPA1受体抗体(1∶1 000)及GRP抗体(1∶1 000),4℃孵育16~18 h。0.01 mol/L PBS漂洗3次,每次5 min。加入二抗:FITC偶联的驴抗兔IgG(1∶100)、TRITC偶联的驴抗山羊IgG(1∶200),在二抗中加入Hoechst (Sigma),避光,室温孵育1 h。封片后荧光显微镜下观察。
1.4 区分痛和痒的“面颊模型”实验按照Shimada 和LaMotte[8]报道的方法操作,该方法已得到公认。实验前2 d,在乙醚快速麻醉下,将小鼠面颊处剃毛(面积约5 mm× 8 mm),然后将小鼠置于测试笼中适应40 min,之后每天均在测试笼中适应40 min。实验当天,小鼠放置测试笼中适应40 min,待其安静后观察并记录40 min基础行为。然后根据小鼠体质量腹腔注射30 mg/kg Ki16425,观察并记录30 min内小鼠行为。30 min后,实验小鼠于剃毛处皮内注射LPA(4 mmol/L,25 μL/只),立即放回笼中,记录小鼠的wiping(擦拭)及scratching(搔抓)行为。按照Shimada和LaMotte[8]报道的标准,前肢擦拭面颊为痛,后爪搔抓面颊为痒。分别记录40 min内前肢擦拭次数和后爪搔抓次数,进行统计分析。计数标准:擦拭为小鼠一侧的前肢由面颊后部向嘴部轻轻擦拭面颊部注射部位,擦1次计数1次(由耳后向面颊部的擦拭行为及两前臂同时或交替的擦拭行为不计入擦拭次数);搔抓为从小鼠后爪抬起开始搔抓剃毛处到搔抓完毕后爪落回笼底或放至嘴前舔舐,计数搔抓1次。
1.5 统计学处理数据以x±sx表示,采用SPSS16.0软件对数据进行处理。行为数据采用单因素方差分析(one-way ANOVA)比较组间差别。检验水准(α)为0.05。
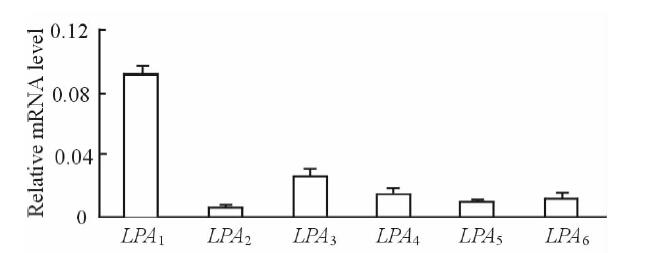
2 结 果 2.1 LPA1 mRNA在DRG的表达结果如图 1所示,虽然LPA1~LPA6型受体mRNA在正常小鼠DRG上均有表达,但LPA1受体mRNA表达量较多,其余5种亚型受体表达量较少。
2.2 LPA1在DRG痒神经元的表达结果如图 2所示,LPA1受体在DRG内的表达丰富,且LPA1受体在一些GRP阳性神经元表达,提示LPA1受体可能与瘙痒的发生有关。
|
图 1 正常小鼠LPA1~LPA6型受体mRNA表达 Fig 1 mRNA expressions of LPA1-LPA6 receptors in normal mice LPA1-6: Lysophosphatidic acid receptor 1-6. n=6, x±sx |

|
图 2 正常小鼠LPA1受体在GRP阳性神经元表达 Fig 2 Co-expression of LPA1 receptor and GRP-positive neurons in mice LPA1: Lysophosphatidic acid receptor 1; GRP: Gastrin-releasing peptide |
小鼠面颊皮内注射LPA,产生明显的疼痛行为(擦拭)。应用LPA1和LPA3受体特异性阻断剂Ki16425腹腔注射后,小鼠面颊皮内注射LPA产生的疼痛行为被抑制(P<0.01),搔抓行为增加(P<0.05,图 3),提示抑制LPA1介导的疼痛行为后导致痒行为的增加。

|
图 3 “面颊模型”实验结果显示抑制LPA1受体诱发瘙痒 Fig 3 nhibition of LPA1 receptor produced scratching in mouse “Cheek model” LPA:Lysophosphatidic acid; LPA1 :Lysophosphatidic acid receptor 1. *P<0.05, **P<0.01 vs LPA group.x±sx |
本研究结果表明,在外周感觉神经元中,LPA的6个亚型受体都有表达,其中LPA1受体表达最丰富。研究者发现在神经损伤的早期阶段,神经损伤可能会导致LPA的产生, LPA通过激活LPA1受体从而产生神经病理性痛,提示LPA1受体主要与慢性痛的发生有关[4,5]。
LPA除了启动神经病理性疼痛外,还可能参与瘙痒的产生。研究发现小鼠皮内注射LPA会产生显著的而且是剂量依赖性的搔抓行为[9]。在过敏性皮肤炎症出现瘙痒的小鼠,给予LPA1和LPA3的拮抗剂Ki16425可减轻搔抓行为[10],提示LPA1在过敏性皮炎瘙痒中可能发挥作用。最近,Kremer等[11]在胆汁淤积并出现慢性瘙痒症状的患者中发现,其血清能升高神经细胞株细胞内的游离Ca2+水平,而没有出现瘙痒症状的患者的血清则无此作用。血清中引起细胞内Ca2+升高的成分被确定为LPA,与无瘙痒患者相比,瘙痒患者血清的LPA水平升高,且LPA 升高的程度与瘙痒的程度正相关。此外,出现瘙痒的胆汁淤积患者的血清中,一种能将血清中的溶血磷脂酰胆碱水解成LPA 和胆碱的水解酶autotaxin (ATX)的活性升高,而且与瘙痒的程度正相关[11]。提示慢性胆汁性瘙痒的患者血清中ATX 酶活性升高引起的血清LPA 水平的升高,是慢性胆汁性瘙痒的关键因素。但LPA在慢性胆汁性瘙痒中的致痒作用是否通过LPA1 受体产生尚无研究报道。
近几年来,痒觉研究的一个重要进展是,在DRG或三叉神经节内的伤害性初级感觉神经元中,存在一小部分对各种致痒物质刺激产生反应的痒神经元,它们特异性地表达MrgprA3[12]以及GRP[3],其周围突起仅支配皮肤的表皮层,中枢突起在脊髓后角与表达GRP受体GRPR)的神经元形成突触联系。仅是这一小部分痒神经元兴奋,则产生痒信号传向中枢,产生痒觉;如果包括痒神经元在内的多数伤害性感觉神经元兴奋,则产生痛信号传向中枢。本研究发现,LPA1在GRP阳性的神经元有表达,这一结果提示了激活LPA1产生瘙痒的可能性。但在正常小鼠皮内注射LPA产生的是疼痛反应,并未诱发小鼠产生瘙痒反应。令人感兴趣的是,小鼠被给予LPA1和LPA3受体拮抗剂Ki16425腹腔注射后,皮内注射LPA诱发的疼痛反应被抑制,同时出现了明显的搔抓反应,提示了LPA1受体激活与瘙痒产生的相关性。
在正常小鼠,LPA激活LPA1后产生的是疼痛反应,LPA1产生的疼痛反应被抑制后出现瘙痒反应的可能机制之一是在正常情况下外周痛信号在脊髓对痒信号的抑制被解除,而出现了搔抓反应。Ross等[13]的研究表明,来自外周的痛信号在脊髓通过一种表达Bhlhb5 的中间神经元抑制痒信号的传递,但若痛信号的传导被阻止,痒信号可传向中枢。例如,正常小鼠皮内注射辣椒素产生痛反应,但若敲除DRG神经元的谷氨酸囊泡转运体基因VGLUT2 后,痛信号在脊髓的传递被阻止,皮内注射辣椒素则产生明显的瘙痒反应[14]。
在伤害性感觉神经元内可能存在特异性的区分痛和痒的细胞内信号通路[15,16]。例如对诱发瘙痒的组胺产生反应的感觉神经元对致痛物质辣椒素也产生反应[17],致痒介质氯喹敏感的神经元也对致痛物质辣椒素和芥末油敏感[18]。多数有害化学物质既能诱发疼痛又能产生瘙痒,如致痒物质组胺、5-羟色胺、内皮素-1 及LPA等均能产生疼痛,提示同一个伤害性感觉神经元内分别存在痛和痒的不同信号通路。研究发现,合成肽Ser-Leu-Ile-Gly-Arg-Leu (SLIGRL)激活神经元MrgprC11受体则产生痒,激活蛋白裂解酶激活受体2(protease-activated receptor 2, PAR2)可诱导疼痛的产生[16,19]。这一研究提示,既能致痛又能致痒的化学物质所携带的痛信号和痒信号可选择性地被同一个神经元不同的膜受体识别,并通过不同的细胞内信号通路转导。本研究中免疫荧光染色结果显示,LPA1在GRP阳性的神经元表达。因此,抑制LPA1后出现瘙痒反应的另一可能机制是,外周痒神经元内存在LPA1激活的痛信号通路和痒信号通路,在正常情况下LPA1介导的痛信号通路抑制了痒信号通路,注射LPA产生痛而不产生瘙痒,当LPA1受体介导的痛信号通路被抑制后,痒神经元输出的是痒信号而产生搔抓反应。
| [1] | Weisshaar E, Dalgard F. Epidemiology of itch:adding to the burden of skin morbidity[J]. Acta Derm Venereol, 2009, 89:339-350. |
| [2] | Kremer A E,Oude Elferink R P,Beuers U. Pathophysiology and current management of pruritus in liver disease[J]. Clin Res Hepatol Gastroenterol, 2011, 35:89-97. |
| [3] | Sun Y G,Chen Z F. A gastrin-releasing peptide receptor mediates the itch sensation in the spinal cord[J]. Nature, 2007, 448:700-703. |
| [4] | Patel K N,Dong X. An itch to be scratched[J]. Neuron, 2010, 68:334-339. |
| [5] | Inoue M,Rashid M H,Fujita R,Contos J J,Chun J,Ueda H. Initiation of neuropathic pain requires lysophosphatidic acid receptor signaling[J]. Nat Med, 2004, 10:712-718. |
| [6] | Baumforth K R, Flavell J R, Reynolds G M, Davies G, Pettit T R, Wei W, et al. Induction of autotaxin by the Epstein-Barr virus promotes the growth and survival of Hodgkin lymphoma cells[J]. Blood, 2005, 106:2138-2146. |
| [7] | Balazs L, Okolicany J, Ferrebee M, Tolley B, Tigyi G. Topical application of the phospholipid growth factor lysophosphatidic acid promotes wound healing in vivo[J]. Am J Physiol Regul Integr Comp Physiol, 2001, 280:R466-R472. |
| [8] | Shimada S G, LaMotte R H. Behavioral differentiation between itch and pain in mouse[J]. Pain, 2008, 139:681-687. |
| [9] | Hashimoto T, Ohata H, Momose K. Itch-scratch responses induced by lysophosphatidic acid in mice[J]. Pharmacology, 2004, 72:51-56. |
| [10] | Shimizu Y, Morikawa Y, Okudaira S,Kimoto S, Tanaka T, Aoki J, et al. Potentials of the circulating pruritogenic mediator lysophosphatidic acid in development of allergic skin inflammation in mice:role of blood cell-associated lysophospholipase D activity of autotaxin[J]. Am J Pathol, 2014, 184:1593-1603. |
| [11] | Kremer A E, Martens J J, Kulik W,Ruëff F, Kuiper E M, van Buuren H R, et al. Lysophosphatidic acid is a potential mediator of cholestatic pruritus[J]. Gastroenterology, 2010, 139:1008-1018. |
| [12] | Han L,Ma C, Liu Q, Weng H J, Cui Y, Tang Z, et al. A subpopulation of nociceptors specifically linked to itch[J]. Nat Neurosci, 2013, 16:174-182. |
| [13] | Ross S E, Mardinly A R, McCord A E, Zurawski J, Cohen S, Jung C, et al. Loss of inhibitory interneurons in the dorsal spinal cord and elevated itch in Bhlhb5 mutant mice[J]. Neuron, 2010, 65:886-898. |
| [14] | Liu Y,Abdel Samad O, Zhang L, Duan B, Tong Q,Lopes C, et al. VGLUT2-dependent glutamate release from nociceptors is required to sense pain and suppress itch[J]. Neuron, 2010, 68:543-556. |
| [15] | Lumpkin E A, Caterina M J. Mechanisms of sensory transduction in the skin[J]. Nature, 2007, 445:858-865. |
| [16] | Han S K, Simon M I. Intracellular signaling and the origins of the sensations of itch and pain[J]. Sci Signal, 2011, 4:pe38. |
| [17] | Shim W S, Oh U. Histamine-induced itch and its relationship with pain[J]. Mol Pain, 2008, 4:29. |
| [18] | Wilso S R, Gerhold K A, Bifolck-Fisher A, Liu Q, Patel K N, Dong X, et al. TRPA1 is required for histamine-independent, Mas-related G protein-coupled receptor-mediated itch[J]. Nat Neurosci, 2011, 14:595-602. |
| [19] | Liu Q, Weng H J, Patel K N, Tang Z, Bai H, Steinhoff M, et al. The distinct roles of two GPCRs, MrgprC11 and PAR2, in itch and hyperalgesia[J]. Sci Signal, 2011, 4:ra45. |
 2016, Vol. 37
2016, Vol. 37


