子宫内膜异位症(endometriosis,EM)是指子宫内膜组织(腺体和间质)存在于子宫体以外部位,导致痛经、盆腔痛和不孕等临床表现的一种常见妇科疾病。EM在育龄妇女中发病率为10%~15%[1],严重影响患病妇女的生活质量,但其发病机制仍不清楚,治疗也主要局限于内分泌治疗和手术治疗,远期效果欠佳。因此,亟需开发新的治疗方案,治愈疾病,防止复发以及提高生育能力。
大多数妇女在出现临床表现时EM就已经存在,无法对患病妇女进行全过程的观察,并且由于伦理原因,无法在人体身上做侵袭性的实验,因此,建立实验动物模型是研究EM的发病机制以及新的治疗方案的最好方法。Vernon和Wilson[2]首次通过手术诱导自体移植的方法成功建立了EM大鼠模型,此后国内外学者通过大量的实验,创建了多种建模方法。EM大鼠模型建立操作相对简单,成功率高,被广泛采用。手术移植是目前报道的建立EM模型的主要方法,但移植部位各有不同,如腹膜、子宫卵巢韧带、宫骶韧带、大网膜、肠壁、肠系膜等部位均可种植[3]。本实验将SD大鼠自体子宫内膜移植于EM常见的发病部位,比较不同部位子宫内膜移植后的建模效果,寻找更有效的建模部位。
1 材料和方法 1.1 实验动物雌性、成熟未交配SD大鼠40只,体质量200~240 g,鼠龄8~10周,由第二军医大学实验动物中心[许可证号:SCXK(沪)2012-0003]提供。予标准光照周期(12 h白光,12 h黑夜),室内温度18~25℃、湿度50%~65%、氨浓度≤14 mg/m3、标准饲料和水喂养。本实验流程及相关人员均经过第二军医大学伦理委员会批准。
1.2 主要器械、仪器和试剂普通手术器械及眼科手术器械,游标卡尺,光学显微镜(Thermo公司),电子天平(梅特勒托利多公司,GB204)。戊酸雌二醇(拜耳医药保健有限公司,批号:J20080036),庆大霉素(上海现代哈森药业有限公司,批号:H20045446),10%水合氯醛,生理盐水,多聚甲醛,H-E染液,常规消毒药品等。
1.3 EM建模方法选用非动情期大鼠,术前1 d予戊酸雌二醇0.2 mg/只灌服。手术在室温28~32℃环境下进行,无菌操作。以10%水合氯醛3 mL/kg进行腹腔注射麻醉,将麻醉后的大鼠仰卧位固定于手术板上,腹部备皮,常规消毒铺巾。大鼠下腹正中耻骨联合上1 cm处以上取长约2~3 cm纵行切口,进腹后在膀胱背侧找到“Y”字型子宫,游离右侧子宫,近端离子宫角1 cm处结扎,远端离卵巢1 cm处结扎,剪下右侧子宫。将剪下的子宫组织放入盛有无菌生理盐水的培养皿中,纵向剖开。将子宫内膜与肌层分离,剪取3块3 mm×5 mm的内膜组织,用4-0号可吸收线将内膜面贴于种植部位,分别缝合在左侧卵巢、宫骶韧带以及左侧远离腹部切口的腹壁上。随后用庆大霉素稀释液冲洗腹腔,最后用0号丝线分层缝合腹部切口,常规关腹。术后密切观察大鼠呼吸、心率,待其自然苏醒,正常喂养,观察大鼠伤口及生活情况。术后第1天开始每只大鼠肌内注射庆大霉素0.1 mL,每天1次,连续7 d。术后第10天开始每天予戊酸雌二醇0.02 mg/kg灌服,连续5 d。
1.4 观察指标大鼠建模28d后再次手术,腹腔麻醉后固定,腹部备皮,消毒铺巾,取原切口旁开腹,取出3个不同部位的移植物。记录移植物大体特点。用游标卡尺测量移植物的长度、高度与宽度,按公式计算体积:体积=0.52×长×宽×高[4]。用电子天平称取移植物质量。将取出的移植物和左侧子宫的在位内膜标本用10%多聚甲醛固定,常规石蜡包埋,H-E染色,显微镜下观察组织病理学变化。
1.5 移植成功的判断标准肉眼可见移植物体积明显增大,呈暗红色或透亮的小囊泡,有些形成多房的囊肿,囊肿内充满暗红色或澄清液体;移植物表面有血管形成,移植物可与周围组织形成粘连。显微镜下见移植物生长成腔样结构,可见腺上皮及间质细胞生长,并肩腺体形成,腔内壁所衬的上皮细胞层以柱状上皮或立方状细胞形成环形或锯齿状生长,部分上皮细胞可见核下空泡。腺体结构与大鼠正常子宫内膜腺体结构相似。根据公式计算成模率:成模率(%)=移植成功的大鼠只数/造模大鼠总只数×%。
1.6 统计学处理采用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,组间差异的比较采用单因素方差分析;计数资料以百分比表示,组间差异的比较采用χ2检验。检验水准(α)为0.05。
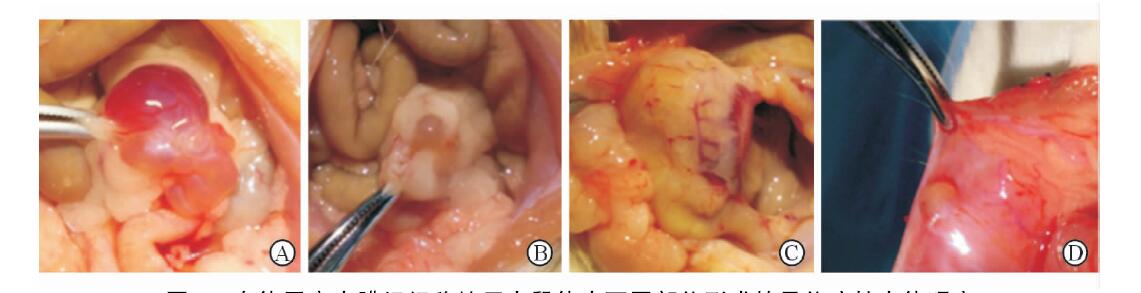
2 结 果 2.1 大体观察40只大鼠中有3只大鼠在建模后1~2周死亡,死亡原因为肠梗阻,死亡率为7.5%。存活的37只大鼠左侧卵巢部位移植物均生长良好,体积明显增大,形成暗红色的或透亮的囊肿,内部充满积液,表面血管清晰可见,与周围组织无粘连(图 1A)。宫骶韧带部位移植物生长良好,形成透亮的囊肿,内部充满积液,表面血管清晰可见,与周围组织粘连(图 1B),其中2只大鼠移植部位未形成囊肿,2只大鼠移植部位形成黄白色的脓肿,切开脓肿可见黄白色膏脂样物(图 1C)。左侧腹壁部位移植物生长良好,形成透亮的囊肿,内部充满积液,表面血管清晰可见,与周围组织无粘连(图 1D),其中3只大鼠移植部位未形成囊肿。
2.2 组织病理学观察光镜下观察大鼠正常子宫内膜(图 2A)以及3个不同的移植物(图 2B,图 2C,图 2D),3个部位的移植物均见有内膜腺体和间质形成,符合镜下成模标准,并且与正常子宫内膜腺体结构相似。
|
图 1 自体子宫内膜组织移植于大鼠体内不同部位形成的异位病灶大体观察 A: 左侧卵巢部位异位病灶; B: 宫骶韧带部位异位病灶; C: 宫骶韧带部位形成脓肿; D: 左侧腹壁部位异位病灶 |

|
图 2 自体子宫内膜组织移植于大鼠体内不同部位形成的异位病灶病理学形态 A: 正常子宫内膜; B: 左侧卵巢部位异位病灶; C: 宫骶韧带部位异位病灶; D: 左侧腹壁部位异位病灶. H-E染色,original magnification: ×400 |
根据大体观察和组织学成模标准,左侧卵巢部位成模率为92.5%(37/40),宫骶韧带部位成模率为82.5%(33/40),左侧腹壁部位成模率为85.0%(34/40),3组成模率差异无统计学意义(P>0.05)。对3个不同部位移植物的体积和质量进行比较,结果显示左侧卵巢部位的移植物体积和质量最大,并且与其他两个部位的移植物相比差异有统计学意义(P<0.05),而宫骶韧带及左侧腹壁部位的移植物体积及质量差异无统计学意义(P>0.05)。详见表 1。
|
|
表 1 3个部位移植物的体积和质量比较 Tab 1 Imaging parameters for multi-sequence 3.0 Tesla HR-MRI scan |
EM是一种极常见的妇科疾病,呈雌激素依赖,好发于育龄期女性。虽然组织病理学诊断EM是良性的,但其临床生物学行为却类似恶性肿瘤,具有种植、侵袭及远处转移等特点。异位内膜可侵犯全身各个部位,但绝大多数位于盆腔脏器,以卵巢、宫骶韧带最为常见。EM发病原因仍不清楚,常见的发病机制理论有异位内膜种植学说、体腔上皮化生学说、氧化应激、遗传因素以及免疫与炎症因素等,但到目前为止,尚没有一种学说能完整解释这种疾病。目前EM的治疗仍以缓解症状为主,治疗远期效果欠佳。因此,需要一个良好的实验动物模型阐明疾病机制和测试新的治疗方案。
用于EM模型的动物主要有灵长类动物和啮齿类动物,以及家兔、巴马香猪、鸡胚尿囊膜等。灵长类动物是唯一与人类相似、能自发形成EM的动物,因此是研究EM最合适的动物模型。然而, 由于实验动物缺乏、价格昂贵、饲养条件高、成模率低、实验周期长以及伦理学等多种原因限制了灵长类动物EM模型实验的研究。啮齿类动物由于价格便宜、易于获得、成模率高,被广泛采用。啮齿类动物包括大鼠和小鼠,其中免疫缺陷小鼠可进行异体移植[5,6,7],直接接受人体子宫内膜的移植,并且保留其原有特性,更接近人类疾病的病理变化,但由于其免疫功能缺陷,不能用来研究机体免疫方面的改变,且不能耐受多次手术和采血检验。近年来,荧光EM小鼠模型的应用日益广泛,荧光动物模型是活体无创观察模型,其主观性小,病灶定位准确,能动态无损伤量化观察病灶生长情况,操作简单[8],但荧光表达时间有限,最长仅为4周,缺乏定量种植及观察标准。
大鼠繁殖力强,性周期短而规律,对性激素敏感性高,因而对移植内膜的成活极为有利。本实验选择SD大鼠作为模型动物,在术前1 d给大鼠灌服雌激素,模拟动情期,使大鼠在手术时统一在动情期。因为EM为雌激素依赖性疾病,术后再予雌激素,促进异位子宫内膜种植及生长。术中、术后予抗生素,避免感染。将自体子宫内膜移植于3个不同的部位,卵巢、宫骶韧带以及腹壁,此为EM的好发部位,分别模拟卵巢子宫内膜异位症(OMA)、深部浸润型子宫内膜异位症(DIE)以及表浅腹膜子宫内膜异位症(SUP)。结果发现,3个部位的移植物均可呈现暗红色或透亮的小囊泡,成功地形成内膜异位病灶,其中左侧卵巢部位的成模率为92.5%,宫骶韧带部位的成模率为82.5%,左侧腹壁部位的成模率为85.0%,其成功率均较高,且3个部位成模率差异无统计学意义。镜下见3个不同部位的移植物中均有子宫内膜上皮细胞、腺体和间质,符合EM病理表现,表明建模成功。但左侧卵巢部位的移植物体积和质量最大,与其他两个部位的移植物相比差异有统计学意义。可见,自体子宫内膜移植于卵巢部位效果最佳,这可能是由于卵巢部位局部雌激素含量较高、而EM是雌激素依赖性疾病所致。故我们认为建立EM大鼠模型时将内膜移植于卵巢部位,更利于治疗效果的观察以及机制研究,有助于开发EM新的治疗方法,尤其适用于需大样本的研究。但大鼠与人类种属差异性较大,其实验结果与临床一致性仍需进一步考证。
| [1] | Wang G, Tokushige N, Markham R, Fraser I S. Rich innervation of deep infiltrating endometriosis[J]. Hum Reprod, 2009, 24:827-834. |
| [2] | Vernon M W, Wilson E A. Studies on the surgical induction of endometriosis in the rat[J]. Fertil Steril, 1985, 44:684-694. |
| [3] | Pelch K E, Sharpe-Timms K L, Nagel S C. Mouse model of surgically-induced endometriosis by auto-transplantation of uterine tissue[J]. J Vis Exp, 2012(59):e3396. |
| [4] | Zulfikaroglu E, Klllc S, Islimye M, Aydin M, Zergeroglu S, Batioglu S. Efficacy of anti-tumor necrosis factor therapy on endometriosis in an experimental rat model[J]. Arch Gynecol Obstet, 2011, 283:799-804. |
| [5] | Xu H, Lui W T, Chu C Y, Ng P S, Wang C C, Rogers M S. Anti-angiogenic effects of green tea catechin on an experimental endometriosis mouse model[J]. Hum Reprod, 2009, 24:608-618. |
| [6] | Wang C C, Xu H, Man G C, Zhang T, Chu K O, Chu C Y, et al. Prodrug of green tea epigallocatechin-3-gallate (Pro-EGCG) as a potent anti-angiogenesis agent for endometriosis in mice[J]. Angiogenesis, 2013, 16:59-69. |
| [7] | Fu G, Che X, Sun Y, Huang X, Xu H, Zhou C, et al. Pigment epithelial-derived factor expression in endometriotic lesions in a rat model of endometriosis[J]. Acta Histochem, 2013, 115:301-307. |
| [8] | Wang N, Hong S, Tan J, Ke P, Liang L, Fei H, et al. A red fluorescent nude mouse model of human endometriosis:advantages of a non-invasive imaging method[J]. Eur J Obstet Gynecol Reprod Biol, 2014, 176:25-30. |
 2016, Vol. 37
2016, Vol. 37


