2. 中国科学院上海硅酸盐研究所无机涂层材料研究实验室, 上海 200050
2. Key Lab of Inorganic Coating Materials, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China
天然骨组织无机构成主要是羟基磷灰石(hydroxyapatite,HA),同时含有Si4+、F-、CO32-、Sr2+、Zn2+、Al3+、Na+等微量成分,研究认为这些微量成分在天然骨理化性质、生物学功能等方面发挥着重要作用[1]。人工合成HA的组分与结构单一,无法完全实现天然硬组织的功能。因此,HA无机离子掺杂改性广受关注。
硅(silicon,Si)是人体必需的微量元素,在骨形成、矿化和骨功能代谢中起着重要作用,缺Si后可导致骨骼异常、畸形、牙齿釉质发育不良等[2,3]。Si掺杂改性HA的研究发现,SiO44-取代部分PO43-导致HA晶格畸变、降低了结晶度,促进了材料的骨诱导再生能力[4]。但是,Si在HA中的掺杂量是有一定量度的,为0.1%~5%(质量分数),超过最大量度时HA晶体相组成出现杂相,但0.5%和1%的掺杂时HA的生物活性明显提高[5]。Jokic等[6]研究认为,Si-HA促进成骨细胞增殖最佳掺杂量是0.8%(质量分数),高于此量产生一定细胞毒性,对细胞增殖有抑制作用。研究发现,2.2% (质量分数)的Si掺杂量是提高其生物活性的最佳浓度[7]。目前关于Si-HA中最佳掺杂量仍存在着争议,而以Si在天然骨中的含量为掺杂量的Si-HA的研究鲜有报道。
本实验通过水热法制备以天然骨Si含量为掺杂量的Si-HA,对比研究HA、Si-HA对MG63成骨细胞黏附、增殖、碱性磷酸酶(ALP)活性及成骨特异性基因表达的影响,全面评价微量Si离子掺杂改性的Si-HA对成骨细胞功能活性的影响。
1 材料和方法 1.1 主要试剂及仪器场发射扫描电镜(S-4800,日本);X射线衍射仪(XRD,Ultima IV,日本);YJ-875超净工作台(苏州净化设备厂);倒置荧光显微镜(Axiovert 200,德国);CO2细胞培养箱(Forma Scientific,美国);DMEM培养液(Gibco,美国);新生牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶(Sigma,德国);CCK8试剂盒(Dojindo Laboratories, 日本);DAPI 染色剂(Invitrogen,美国);ALP检测试剂盒(Lab Assay ALP,日本);ELX800酶联免疫检测仪(Bio-TEK,美国);PCR扩增仪 (Bio-Rad,美国);低温高速离心机(Beckman Coulter, 美国)。
1.2 材料制备及实验分组HA由中国科学院上海硅酸盐研究所无机涂层材料研究实验室提供;硅源选用SiO2。按照骨骼中Si4+的含量进行配比,取x=0.002,使Si在HA中的质量分数约为0.005 6%。以Ca(H2PO4)2·H2O、Ca(OH)2和纳米SiO2为反应原料,通过以下方程式,采用水热法制备Si-HA粉体:(3- 0.5x)Ca(H2PO4)2+(7+0.5x)Ca(OH)2+xSiO2→Ca10(PO4)6-x(SiO4)x(OH)2-x+12H2O。将粉体压片制备成10 mm×10 mm×1 mm实验用圆片。制片参数为0.2 g粉体在10 MPa压力下保压 1 min,并在1 000℃下烧结1 h。分为实验组(Si-HA)和对照组(HA)两组。
1.3 材料表征的检测使用XRD进行材料表面晶相分析。扫描参数每步0.02°,起始角20°,终止角60°。片状材料固定在样品台上,其表面喷金,扫描电镜(SEM)完成对样品的形貌观察和比较。
1.4 CCK8方法检测Si-HA对MG63成骨细胞黏附、增殖的影响MG63成骨细胞来自中国科学院上海硅酸盐研究所无机涂层材料研究实验室。将传代至第3代且生长良好的MG63细胞以5×103/cm2和2×103/cm2密度分别接种于含两组样品的24孔细胞培养板中,成骨细胞黏附实验于1、6、12 h终止培养,成骨细胞增殖实验于1、4、7、14 d终止培养。弃上层培养液,每孔加入100 μL PBS溶液及10 μL CCK8反应液,在细胞培养箱内继续孵育3 h后,吸取10 μL上层液体至96孔酶标板中,采用酶标仪测量450 nm波长的光密度值(D值)。记录结果,以时间为横轴、D值为纵轴绘制相对细胞生长柱状图。
1.5 成骨细胞在材料表面黏附数量定性观察(DAPI染色法)如1.4项下细胞黏附培养方法,培养1、6、12 h,以PBS冲洗3次,室温下用4%多聚甲醛溶液固定细胞20 min,DAPI (5 μg/mL) 核染10 min,晾干后通过倒置荧光显微镜(蓝光激发) 观察黏附细胞的细胞核。
1.6 Si-HA对ALP活性的影响MG63细胞以2×104个/cm2密度接种于含2组样品的24孔细胞培养板中,1、4、7、14 d后终止培养,弃培养液,PBS清洗3次,加细胞裂解液(0.25%Triton X-100),1 000×g离心15 min,取上清液,根据ALP试剂盒使用说明,酶标仪在405 nm读取D值,根据取得的标准曲线换算ALP活性。同一样本采用BCA蛋白检测法检测总蛋白,酶标仪在570 nm读取D值,根据标准曲线计算得出细胞总蛋白浓度。以相应的细胞总蛋白浓度校准各实验组ALP活性,获得ALP相对活性值。
1.7 RT-PCR方法检测Si-HA对成骨细胞特异性基因表达的影响以1×104/孔细胞密度接种于含有2组样品的24孔板中,培养1、4、7、14 d后终止培养,弃培养液,PBS清洗3次,TRIzol溶解材料表面细胞并收集胞内总RNA,每组2 μg的总RNA用TaKaRa公司的cDNA合成试剂盒反转录为cDNA。在GenBank中查得ALP、Ⅰ 型胶原(Col-Ⅰ)、骨钙素(OC)目的基因RNA引物序列,以Primer express 6.0根据引物设计原则设计特异性引物对。目的基因ALP、Col-Ⅰ、OC的扩增采用SYBR GREEN法扩增,以GAPDH作为内参基因。ALP F: 5′-AAC GTG GCC AAG AAC ATC ATC A-3′, R: 5′-TGT CCA TCT CCA GCC GTG TC-3′;Col-Ⅰ F: 5′-GTG GAA ACC CGA GCC CTG CC-3′, R: 5′-CAG ACG GGA CAG CAC TCG CC-3′;OC F: 5′-CCT ATT GGC CCT GGC CGC AC-3′,R: 5′-CGC TGC CCT CCT GCT TGG AC-3′;GAPDH F: 5′-GGC ACA GTC AAG GCT GAG AAT G-3′,R: 5′-ATG GTG GTG AAG ACG CCA GTA-3′。ΔCT=目的基因CT-内参基因CT。目的基因相对表达量=2-ΔCT。
1.8 统计学处理采用SPSS 16.0软件行统计学分析,以±s表示定量数据,应用独立样本t检验比较组间差异,检验水准(α)为0.05。
2 结 果 2.1 Si-HA的相组成XRD结果表明,图谱中每个衍射峰都属于HA相,没有观察到其他杂相峰(图 1),说明所得产物是纯HA相,掺入Si以后没有引入杂相,符合实验预期,并且峰形尖锐,说明产物结晶性良好。

|
图 1 HA和Si-HA的X射线衍射分析图 Fig 1 XRD analysis of HA and Si-HA materials HA: Hydroxyapatite; Si: Silicon; XRD: X-ray diffraction |
如图 2所示,Si-HA与文献[8]报道的纯HA形貌相似,产物HA纳米颗粒有序排列组装成微米级的片状结构。可以看到在片状颗粒的表面20~50 nm宽、100~200 nm长的HA短棒状结构沿着长轴方向整齐排列(2C)。

|
图 2 HA(A、B)及Si-HA(C、D)的扫描电镜结果 Fig 2 Scanning electron microscopy results of HA (A, B) and Si-HA (C, D) materials HA: Hydroxyapatite; Si: Silicon |
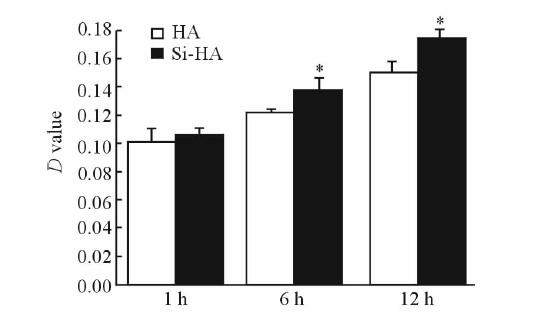
细胞在材料表面培养1 h时,两组材料表面黏附细胞数量的差异无统计学意义(P>0.05);随着培养时间延长,两组材料表面黏附细胞数量均上升,6、12 h时Si-HA表面细胞附着数量高于HA(P<0.05),见图 3。可见微量Si的掺杂促进了成骨细胞在HA表面的附着。
|
图 3 两组材料对成骨细胞黏附活性的影响 Fig 3 Effect of two materials on the adhesion activity of osteoblasts HA: Hydroxyapatite; Si: Silicon. *P<0.05 vs HA group. n=6, x±s |
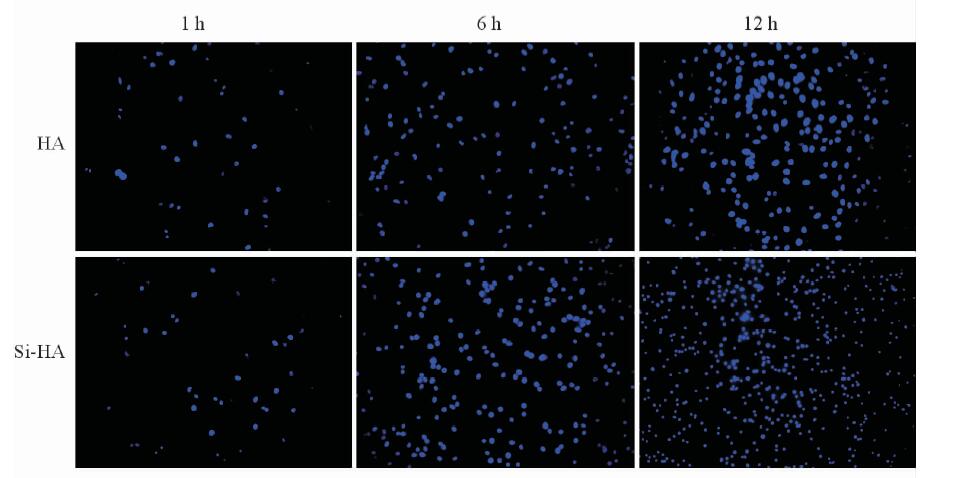
由图 4可见,MG63细胞随着培养时间延长附着在两组材料表面的数量增加,提示HA及Si-HA有良好的生物相容性,成骨细胞能够有效黏附、铺展。细胞培养1 h,两组材料细胞黏附的数量较少且数量近似;培养6、12 h时,Si-HA表面附着细胞数量高于HA表面,与CCK-8检测定量结果一致。
2.5 成骨细胞在材料表面增殖情况从图 5可以看到,MG63成骨细胞在培养第1天,两种材料表面增殖细胞数量差异无统计学意义(P>0.05);随着培养时间延长到第4、7天时,Si-HA较HA表面增殖细胞数量增多(P<0.05);第14天时,Si-HA表面生长细胞数量仍高于HA,但差异无统计学意义(P>0.05)。提示Si能促进成骨细胞的增殖活性。
|
图 4 不同时间点MG63细胞在不同材料表面的黏附的数量(DAPI染色法) Fig 4 Adhesion of MG63 cells on the surface of different materials at different time points (DAPI staining) HA: Hydroxyapatite; Si: Silicon. Original magnification: ×10 |

|
图 5 两组材料对成骨细胞增殖活性的影响 Fig 5 Effects of two materials on the proliferation activity of osteoblasts HA: Hydroxyapatite; Si: Silicon. *P<0.05 vs HA group. n=6, x±s |
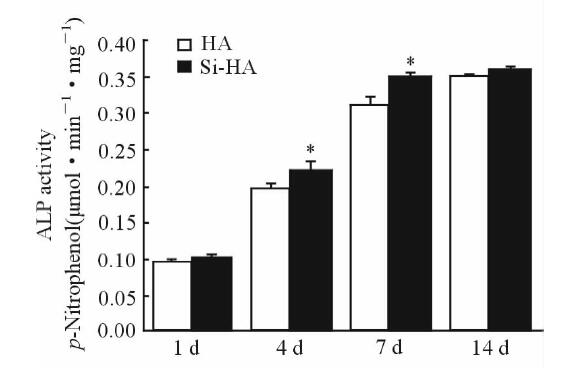
由图 6可见,细胞接种1 d,ALP的表达在两组材料表面差异不明显;在4、7 d时,Si-HA材料表面ALP活性高于HA表面(P<0.05);而在14 d时,Si-HA表面ALP活性高于HA表面,但差异无统计学意义(P>0.05)。提示Si的掺杂促进了MG63细胞ALP活性,但随着时间延长到一定程度,这种促进作用减弱。
|
图 6 不同时间两组材料表面MG63成骨细胞ALP的活性检测 Fig 6 ALP activity of MG63 cells cultured on the surface of the two materials at different time points HA: Hydroxyapatite; Si: Silicon. *P<0.05 vs HA group.n=6, x±s |
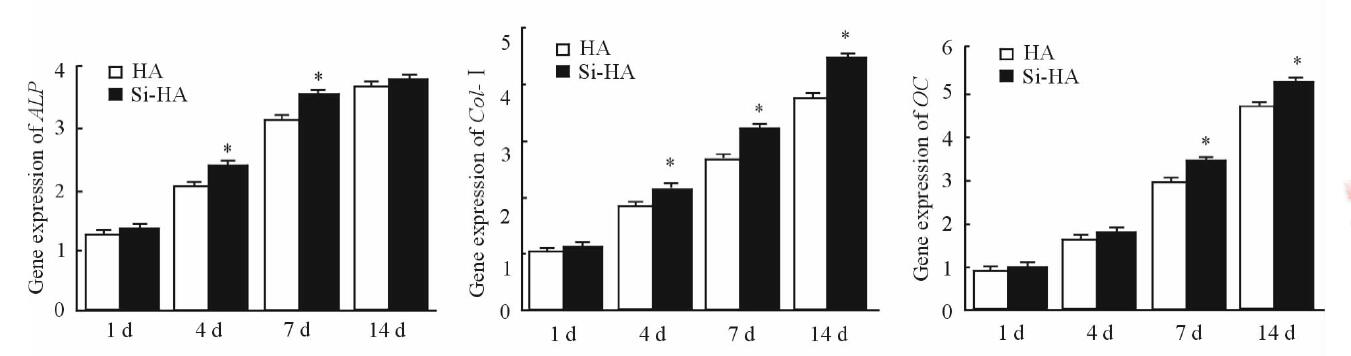
由图 7可以看到:细胞培养1 d,两组材料表面均有ALP、Col-Ⅰ及OC基因表达,但两组间无明显差异;随着细胞培养时间的延长,在4、7 d时Si-HA材料表面ALP表达量明显高于HA表面(P<0.05),而在14 d时两组材料表面ALP表达差异无统计学意义(P>0.05),与CKK8检测ALP活性结果相同。在4、7、14 d时,Col-Ⅰ在Si-HA表面的表达量高于HA表面(P<0.05)。OC在两组材料表达的差异出现在细胞接种的7、14 d (P<0.05)。说明Si4+的掺杂促进MG63成骨细胞成骨特异性基因的表达。
|
图 7 成骨细胞特异性基因ALP、Col-Ⅰ和OC在两组材料表面表达结果 Fig 7 Expression of osteogenic specific genes ALP, Col-Ⅰ and OC in osteoblasts cultured on the surface of two materials ALP: Alkaline phosphatase; Col-Ⅰ: Collagen Ⅰ; OC: Osteocalcin; HA: Hydroxyapatite; Si: Silicon. *P<0.05 vs HA group. n=6, x±s |
本实验以SiO2为硅源制备Si-HA,既能够提供Si,又能作为反应物参与反应,有利于Si4+进入到HA晶格中。反应体系副产物只有水,HA结构中不会引入除了Si以外的外源离子,因而可以消除杂质离子的影响。本实验以水热法制备的Si-HA,晶粒有序排列,大小均匀,与天然骨组织中HA大小相当,其微观构型表征与以往报道相同[6,9]。
成骨细胞黏附是在特定信号因子及相关蛋白介导下完成的,是其在植入物表面发挥增殖、分化及成骨功能的基础[10]。我们以Si在天然骨中含量为掺杂量制备的Si-HA,微量Si离子的析出同样促进了成骨细胞在材料表面的黏附活性。微量Si的掺杂使HA晶粒变小,增加了接触能,同时形成了硅酸,碱化了细胞微环境,致使细胞跨膜蛋白结构发生了改变,更易于材料表面蛋白、细胞的结合,促进成骨细胞在Si-HA表面黏附[7,11]。
植入材料对成骨细胞增殖的影响是其生物学功能研究的重要内容[12],Si掺杂改性的HA能够促进成骨细胞的增殖[11]。本实验通过CCK8检测MG63成骨细胞在HA、Si-HA表面增殖,结果表明Si能促进成骨细胞在HA表面的增殖,但在后期这种促进增殖能力减弱。我们认为微量Si掺杂Si-HA与体液接触初期及后期Si离子析出量小,其促进成骨细胞增殖作用不明显;而在中期,Si析出浓度增大,其促进成骨细胞增殖的作用逐渐显现出来。
成骨细胞分化经过细胞增殖、胞外基质成熟、基质矿化3个阶段,在分化成熟的过程中密切相关的成骨细胞表型标记物序列表达,共同协调细胞外骨基质分泌和矿化。通过对这些特异性标记物检测,可以了解成骨细胞分化情况。
ALP通过磷酸代谢的调节,在骨代谢中局部形成较高浓度磷离子,为HA结晶、沉积提供必需条件,从而启动成骨细胞外的基质矿化和钙磷沉积的骨形成过程[13,14]。本实验发现,Si-HA表面ALP活性与基因表达高于HA表面,且本实验Si掺杂量少,表明以微量Si掺杂同样能够提高Si-HA表面成骨细胞ALP蛋白活性及基因表达,促进了成骨细胞的早期分化。
成骨细胞在分化阶段分泌大量Col-Ⅰ,其致密的结构相互立体交联构成了细胞外基质中的支架,在骨细胞增殖和分化、组织张力维持及钙盐沉积等方面起着重要作用[15,16]。本实验结果发现,在4、7、14 d时,Col-Ⅰ在Si-HA表面的表达量高于HA表面(P<0.05)。其可能的机制为析出的Si4+可以造成一个碱化的细胞超微环境,细胞微环境变化促进了脯氨酰羟化酶与糖胺的结合,同时抑制胶原蛋白酶的降解,促进了Col-Ⅰ基因的表达[17]。
OC是成骨细胞分化成熟的标志,在成骨细胞成熟、矿化、骨形成中起着重要作用,随成骨细胞分化、矿化过程其表达增加[18,19]。本实验中,细胞接种的1、4 d即出现了OC基因的表达,但微量Si掺杂并未明显促进OC表达,可能由于在成骨细胞培养初期基础OC蛋白表达较低,且Si析出量较少。在接种7、14 d,OC在两组材料表达均增加,且Si-HA组表达量高于HA组表达量(P<0.05)。 证明微量Si4+的掺杂促进了OC基因的表达,成骨细胞后期分化成熟。
本实验表明以Si在天然骨中含量为掺杂量制备的Si-HA具有良好的生物学活性,促进了成骨细胞的黏附、增殖及分化。Si掺杂是HA改性的较好选择,Si-HA可能成为与天然骨更加匹配的硬组织植入材料。但Si促进成骨细胞活性的细胞分子机制及其在天然骨组织中的生理机制仍需深入研究。
| [1] | Shi D L. Introduction to biomaterials[M]. Beijing:Tsinghua University Press, 2006:16-28. |
| [2] | Bissé E, Epting T, Beil A, Lindinger G, Lang H, Wieland H. Reference values forserum silicon in adults[J]. Anal Biochem, 2005, 337:130-135. |
| [3] | Carlisle E M. Silicon:an essential element for the chick[J]. Science, 1972, 178:619-621. |
| [4] | Vallet-Regí M, Arcos D. Silicon substituted hydroxyapatites. A method to upgrade calcium phosphate based implants[J]. J Mater Chem, 2005, 15:1509-1516. |
| [5] | Gibson I R, Bonfield W. Novel synthesis and characterization of an AB-type carbonate-substituted hydroxyapatite[J]. J Biomed Mater Res, 2002, 59:697-708. |
| [6] | Jokic B, Mitric M, Popovic M, Sima L, Petrescu S M, Petrovic R, et al.The influence of silicon substitution on the properties of spherical- and whisker-like biphasic α-calcium-phosphate/hydroxyapatite particles[J]. J Mater Sci Mater Med, 2011, 22:2175-2185. |
| [7] | Thian E S, Huang J, Best S M, Barber Z H, Brooks R A, Rushton N,et al. The response of osteoblasts to nanocrystalline silicon-substituted hydroxyapatite thin films[J]. Biomaterials, 2006, 27:2692-2698. |
| [8] | Wang M, Gao J, Shi C, Zhu Y, Zeng Y, Wang D. Facile one-pot synthesis of oriented pure hydroxyapatite with hierarchical architecture by topotactic conversion[J]. Cryst Growth Des, 2014,14:6459-6466. |
| [9] | Aminian A, Solati-Hashjin M, Samadikuchaksaraei A,Bakhshi F, Gorjipour F, Farzadi A, et al. Synthesis of silicon-substituted hydroxyapatite by a hydrothermal method with two different phosphorous sources[J].Ceram Int, 2011, 37:1219-1229. |
| [10] | Webster T J, Ergun C, Doremus R H, Siegel R W, Bizios R. Specific proteinsmediate enhanced osteoblast adhesion on nanophase ceramics[J]. J Biomed Mater Res, 2000, 51:475-483. |
| [11] | Liu X, Morra M, Carpi A, Li B. Bioactive calcium silicate ceramics and coatings[J]. Biomed Pharmacother, 2008, 62:526-529. |
| [12] | MacDonald D E, Rapuano B E, Schniepp H C. Surface oxide net charge of a titanium alloy:comparison between effects of treatment with heat or radiofrequency plasma glow discharge[J]. Colloids Surf B Biointerfaces, 2011, 82:173-181. |
| [13] | Han P, Ji W P, Zhao C L, Zhang X N, Jiang Y. Improved osteoblast proliferation, differentiation and mineralization on nanophase Ti6Al4V[J]. Chin Med J (Engl), 2011, 124:273-279. |
| [14] | Ker E D, Chu B, Phillippi J A, Gharaibeh B, Huard J, Weiss L E, et al. Engineering spatial control of multiple differentiation fates within a stem cell population[J]. Biomaterials, 2011, 32:3413-3422. |
| [15] | Lynch M P, Stein J L, Stein G S, Lian J B. The influence of type Ⅰ collagen on the development and maintenance of the osteoblast phenotype in primary and passaged rat calvarial osteoblasts:modification of expression of genes supporting cell growth, adhesion, and extracellular matrix mineralization[J]. Exp Cell Res, 1995, 216:35-45. |
| [16] | Karsenty G. The genetic transformation of bone biology[J]. Genes Dev, 1999, 13:3037-3051. |
| [17] | Reffitt D M, Ogston N, Jugdaohsingh R, Cheung H F, Evans B A, Thompson R P, et al. Orthosilicic acid stimulates collagen type Ⅰ synthesis and osteoblastic differentiation in human osteoblast-like cells in vitro[J]. Bone, 2003, 32:127-135. |
| [18] | Nakamura A, Dohi Y, Akahane M, Ohgushi H, Nakajima H, Funaoka H, et al. Osteocalcin secretion as an early marker of in vitro osteogenic differentiation of rat mesenchymal stem cells[J]. Tissue Eng Part C Methods, 2009, 15:169-180. |
| [19] | Barrère F, Mahmood T A, Groot K D, Blitterswijk C A V. Advanced biomaterials for skeletal tissue regeneration:instructive and smart function[J]. Mater Sci Eng R, 2008, 59:38-71. |
 2016, Vol. 37
2016, Vol. 37


