炎症性肠病(inflammatory bowel disease, IBD)是一种多种病因引起的、异常免疫介导的肠道慢性及复发性炎症,具有慢性迁延、难以治愈以及终生复发的倾向等特点,溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn disease, CD)是其主要的疾病类型。其病因和发病机制十分复杂,可能是由多种因素相互作用所致,包括环境、遗传、感染和免疫等。患者主要表现为反复发作的腹泻、腹痛、体质量下降以及血便等,但是临床上还没有彻底的根治策略。
临床以及基础研究证实雌激素具有调节多种炎症性疾病的能力,比如自发性高血压、骨性关节炎、牙周炎、慢性非细菌性前列腺炎、类风湿性关节炎、系统性红斑狼疮、多发性硬化症等,雌激素水平改变时,炎症的发生、发展都会受到影响[1,2,3,4]。近年研究发现,IBD的发病率和患病的严重程度存在着明显的性别差异,女性比男性更容易患有此病[5,6],这种差异提示雌激素可能与IBD有关。生物体内雌激素水平改变,如怀孕、口服避孕药、绝经后都会引起IBD的变化[5],进一步提示雌激素在IBD发生和发展过程中发挥重要的调节作用。
雌激素作为一种类固醇激素,参与生物体内多种生理功能与病理过程的调控。临床现象表明机体雌激素的水平可以影响炎症,雌激素水平增高会加重炎症[6,7,8],也有研究表明雌激素对于炎症起到一定的保护作用[5,9],其机制还不明了。雌激素与膜受体GPR30结合后发挥快速效应,雌激素与雌激素受体(ER)α或ERβ结合,通过激素反应元件(ERE)启动转录和翻译过程,产生广泛的生物学效应[10,11,12]。ERα在女性生殖系统中高表达[13],结直肠中也有ERα表达[14,15],同时许多研究也证实ERα与炎症的关系非常密切[16,17]。
本实验通过建立大鼠IBD模型,观察分别应用雌激素和ERα特异性激动剂PPT、雌激素+ERα特异性拮抗剂MPP之后IBD大鼠炎症改变情况,探讨雌激素是通过何种途径影响IBD。
1 材料和方法 1.1 实验动物及试剂成年雌性Sprague-Dawley大鼠,体质量160~200 g,购自上海西普尔-必凯实验动物有限公司,动物许可证号:SCXK(沪)2013-0016,所有动物均可以自由饮食和饮水。在IBD模型建立成功后,大鼠随机分为生理盐水组和致炎组;在研究雌激素对IBD鼠的调节作用中,大鼠随机分为致炎对照组和雌激素处理组;在研究PPT对IBD鼠的调节作用中,大鼠随机分为致炎对照组和PPT处理组。在研究MPP对雌激素处理的IBD鼠调节作用中,大鼠随机分为雌激素处理组和雌激素+MPP组。2,4,6-三硝基苯磺酸(TNBS)和雌激素购自Sigma公司,PPT和MPP购自Tocris公司。
1.2 动物模型的建立实验性结直肠炎利用30%的TNBS乙醇溶液(40 mg/kg)灌肠进行诱导,在灌肠之前大鼠禁食24 h。将直径为6-Fr的塑料软管连接到1 mL的注射器,经肛门置入大鼠结直肠内,至软管前端距离肛门8 cm处缓慢注入TNBS乙醇溶液,轻轻取出塑料软管后保持大鼠不低于60°角静置30 s。在TNBS灌肠之后每天记录不同组大鼠体质量及疾病活动指数(disease activity index, DAI)评分,连续4 d后将大鼠处死,取结直肠组织进行H-E染色。
1.3 炎性指标测定检测记录大鼠体质量、粪便性状、有无便血,取大鼠结肠进行H-E染色,确定结肠炎造模是否成功。TNBS致炎后大鼠体质量下降,DAI评分升高,结直肠长度变短,H-E染色可见明显炎性细胞浸润,结直肠髓过氧化物酶(MPO)浓度降低,即为结肠炎模型成功。DAI评分计分标准:体质量无减轻,粪便呈正常粒状,无便血,均计0分;体质量下降≤5%计1分;体质量下降>5%且≤10%,粪便松软(轻微粘连),粪便带血,均计2分;体质量下降>10%且≤20%计3分;体质量下降>20%,稀便(水样便),便血,均计4分。DAI评分为体质量变化、粪便性状以及有无便血情况3个参数评分的总和。
1.4 给药方法在注射TNBS乙醇溶液或生理盐水后的第4天,也即是结直肠炎症发展的顶峰时,分别给予不同组大鼠皮下注射生理盐水(500 μL),雌激素(1 mg/kg, 溶于500 μL生理盐水)、PPT(3 mg/kg, 溶于500 μL生理盐水),雌激素(1 mg/kg,溶于500 μL生理盐水)+MPP(1 mg/kg, 溶于500 μL生理盐水),继而观察不同组大鼠体质量及DAI评分的变化。
1.5 H-E染色连续给药4 d后将大鼠处死,取距肛门4 cm结直肠至回盲部结直肠,进行大体形态观察,比较大体炎症损伤改变。在生理盐水中清洗干净后分别置于4%的多聚甲醛溶液中固定48 h,然后放入30%的蔗糖溶液中进行脱水,直至沉入溶液底部。进行冰冻切片前取出,用1×PBS进行简单清洗,然后包埋于组织冰冻介质(OCT包埋胶,Amresco公司,美国)中。在冰冻切片机(Leica CM-1900)中切成厚度为10 μm的组织薄片,贴于预先涂有多聚赖氨酸的载玻片上,37℃烤2 h后备用。用H-E染色试剂对组织切片进行染色。所有冰冻切片均在奥林巴斯BH-2型光学显微镜(GMI公司,美国)下进行观察,并用Motic Images 2000软件进行拍照,观察比较各组结直肠组织病理学变化。
1.6 MPO检测以每克组织在37℃的反应体系中分解1 μmol的H2O2计为1个酶活力单位,计算组织中MPO的含量。距肛门4 cm处取结直肠组织1 cm,液氮中速冻,置于-80℃保存,在1周内检测MPO活性。在48孔板中每孔加入100 μL标准品MPO或待测样品(结直肠组织匀浆液),充分混匀后置37℃孵育40 min。洗涤液充分洗涤,每孔加蒸馏水和第一抗体生物素标记的抗大鼠MPO抗体各50 μL(空白除外),充分混匀后置37℃孵育20 min。洗涤液充分洗涤,每孔加100 μL辣根过氧化物酶(HRP)标记的链霉亲和素后置37℃孵育10 min。洗涤,每孔加100 μL底物(TMB)后置37℃暗处反应15 min,然后每孔加入100 μL终止液硫酸混匀,用酶标仪测定450 nm处光密度(D)值。所有D值减去空白值后再行计算。以标准品1 000、500、250、125、62.5、31.2、15.6、0 pg/mL为横坐标,D值为纵坐标,画出标准曲线。根据样品D值计算出MPO值。
1.7 统计学处理实验数据分析使用 SPSS 13.0 软件,作图采用 Origin 7。所有数据均以x±s表示,两组大鼠体质量以及DAI评分的比较采用双因素多水平重复测量方差分析,两组大鼠结直肠长度以及两组大鼠MPO值的比较采用单因素方差分析,组内两两比较用方差分析后的Student-Newman-Keuls 检验。检验水准(α)为0.05。
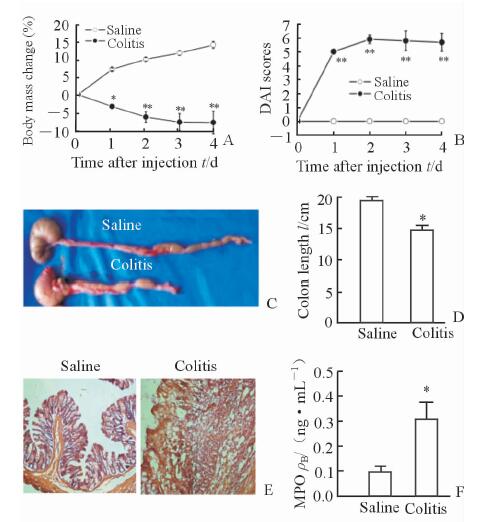
2 结 果 2.1 TNBS灌肠致大鼠IBD模型成功建立结果显示,与生理盐水对照组相比,致炎组大鼠体质量降低(P<0.05或P<0.01,图 1A);DAI评分升高(P<0.01,图 1B);结直肠长度缩短(P<0.05,图 1C、图 1D);H-E染色显示致炎组大鼠的结直肠则肠壁结构严重损伤,内膜充血水肿明显,甚至缺损,固有层炎性细胞浸润明显,而生理盐水对照组大鼠的结直肠完好无损,肠壁结构清晰,层次分明,无充血水肿,仅有少量炎性细胞浸润(图 1E);致炎组MPO值增加(P<0.05,图 1F)。以上结果说明TNBS灌肠致大鼠IBD模型成功建立。
|
图 1 TNBS诱导大鼠IBD模型成功建立 Fig 1 Rat IBD model induced by intracolonic administration of TNBS TNBS: 2,4,6-trinitrobenzenesulfonic acid; IBD: Inflammatory bowel disease; DAI:Disease activity index;MPO:Myeloperoxidase. Changes in body mass (A) and DAI scores (B) of rats 4 d after application of TNBS or saline though rectocolon (n=6, x±s;*P<0.05, **P<0.01 vs saline group). Changes in colon length (C,D) and H-E staining (E) of rats 4 d after application of TNBS or saline though rectocolon (colitis group, n=9; saline group, n=10. x±s. *P<0.05 vs saline group. Original magnification:×10). Changes in the concentration of MPO (F) in rectocolon 4 d after application of TNBS or saline through rectocolon (n=5, x±s; *P<0.05 vs saline group) |
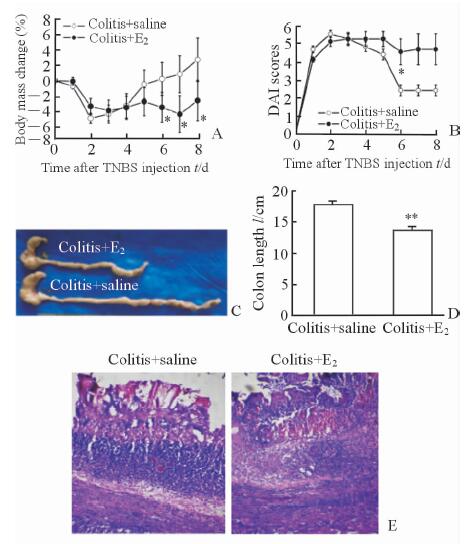
结果显示,与致炎对照组相比,雌激素干预组大鼠的体质量降低(P<0.05,图 2A),而DAI评分增高(P<0.05,图 2B),结直肠长度缩短(P<0.01,图图 2C、图 2D)。注射生理盐水的结肠炎大鼠肠壁结构紊乱,内膜充血水肿,固有层大量炎性细胞浸润,炎症反应明显;在雌激素干预后,大鼠肠道的上述症状更为严重(图 2E)。结果提示,雌激素可以加重IBD的临床症状。
|
图 2 雌激素干预后IBD大鼠症状的改变 Fig 2 Changes in general status of IBD rats after application of estrogen TNBS: 2,4,6-trinitrobenzenesulfonic acid; IBD: Inflammatory bowel disease; DAI: Disease activity index; E2: Estradiol. Changes in body mass (A) , DAI scores (B) and H-E staining (E) of rats after 4-day subcutaneous application of saline or estrogen on the fourth day after TNBS or saline administration (n=7, x±s; *P<0.05 vs colitis+saline group. Original magnification:×10).Changes in colon length(C, D) of rats 4 d after application of saline or estrogen on the fourth day after TNBS or saline administration (n=8, x±s; **P<0.01 vs colitis+saline group) |
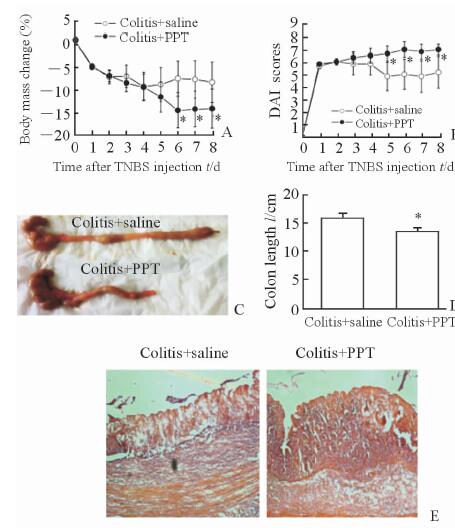
结果显示,与致炎对照组相比,从第6天开始PPT干预组大鼠的体质量降低有统计学意义(P<0.05,图 3A),而从第5天开始DAI评分增高有统计学意义(P<0.05,图 3B),结直肠长度则缩短(P<0.05,图图 3C、图 3D)。注射生理盐水的结肠炎大鼠肠壁结构紊乱,内膜充血水肿,固有层大量炎性细胞浸润,炎症反应明显;在PPT干预后大鼠肠道染色的上述症状更为严重(图 3E)。结果提示,ERα受体激活加重IBD的临床症状。
|
图 3 ERα激活后IBD大鼠症状的改变 Fig 3 Changes in general status of IBD rats after ERα activation PPT: 4,4’,4”-(4-propyl-[1H]-pyrazole-1,3,5-triyl) trisphenol; TNBS: 2,4,6-trinitrobenzenesulfonic acid; ERα: Estrogen receptor alpha; IBD: Inflammatory bowel disease; DAI: Disease activity index. Changes in body mass (A), DAI scores (B), colon length (C, D) and H-E staining (E) of rats after 4-day subcutaneous application of saline or PPT on the fourth day after TNBS or saline administration. n=6, x±s; *P<0.05 vs colitis+saline group. Original magnification:×10 |
结果显示,与单独注射雌激素组相比,从第6天开始雌激素+MPP组大鼠体质量增加有统计学意义(P<0.05或P<0.01,图 4A),而从第6天开始DAI评分降低有统计学意义(P<0.01,图 4B),结直肠长度则显著变长(P<0.01,图图 4C、图 4D)。结果提示拮抗ERα可以逆转雌激素对IBD的促炎效应。

|
图 4 雌激素和MPP干预后IBD大鼠症状的改变 Fig 4 Changes in general status of IBD rats after application of estrogen and MPP E2: Estradiol; MPP:1,3-Bis(4-hydroxyphenyl)-4-methyl-5-[4-(2-piperidinylethoxy)phenol]-1H-pyrazole dihydrochloride; TNBS: 2,4,6-trinitrobenzenesulfonic acid; IBD:Inflammatory bowel disease; DAI: Disease activity index. Changes in body mass (A), DAI scores(B), and colon length (C, D) of rats after 4-day subcutaneous application of estrogen or estrogen+MPP on the fourth day after TNBS administration. n=8, x±s; *P<0.05, **P<0.01 vs colitis+E2 group |
我们通过TNBS诱导实验性结直肠炎(即IBD模型),以动物体质量、DAI评分以及MPO含量等为检测指标,验证了模型建立成功。结果发现,IBD诱导后,雌激素(17β-雌二醇)连续给予4 d,可加重IBD大鼠肠道炎症反应。雌激素干预组大鼠的体质量降低,而DAI评分增高,结直肠长度变短。注射生理盐水的结肠炎大鼠肠壁结构紊乱,内膜充血水肿,固有层大量炎性细胞浸润,炎症反应明显;在雌激素干预后,大鼠肠道上述症状更加严重。以上结果提示,雌激素可以加重IBD的临床症状。
ERα激活后可以模拟雌激素的大部分作用,如促进乳腺和子宫发育,稳定血管舒缩以及治疗骨质疏松等[3,4]。Cook等[5]研究发现,ERα敲除组小鼠IBD的发病率减少,疾病严重程度也降低。选择性激动肠道炎症小鼠ERα,并没有改善小鼠的肠道炎症。研究表明,不论健康人群还是IBD患者,女性ERα基因的增强子水平均高于男性[2],这些差异可能即是雌激素不同作用效果的内在机制。我们通过采用ERα特异激动剂替代雌激素,在灌注TNBS乙醇溶液诱导结直肠炎第4天的大鼠中分别皮下注射生理盐水或PPT,观察不同组大鼠体质量及DAI评分的变化。结果显示,与致炎对照组相比,PPT干预组大鼠的体质量降低,DAI评分显著增高,结直肠长度显著变短,肠壁结构严重受损,内膜充血水肿,固有层炎性细胞浸润症状更明显。因此,以上结果提示,ERα激活可以显著加重IBD的临床症状,与雌激素的效果一致。
为了进一步验证雌激素对IBD的促炎效应是通过ERα来完成的,我们通过给予ERα特异性拮抗剂MPP,观察雌激素的效应是否受到拮抗。相关研究目前在国内外也尚未见报道。本研究结果显示,给予皮下注射ERα特异性拮抗剂MPP连续4 d后,雌激素+MPP大鼠体质量增加,DAI评分降低,结直肠长度变长,给予MPP可明显缓解雌激素引起的IBD鼠肠道的严重炎症。结果提示,抑制ERα可以逆转雌激素对IBD的促炎效应,雌激素对TNBS诱导IBD鼠的促炎效应可能是通过ERα来完成的。当然,由于雌激素受体存在类似的核受体ERα以及膜受体GPR30等,雌激素对于IBD发生、发展进行调节的具体机制还需要进一步研究。
综上所述,本实验结果表明, 雌激素可以加重IBD大鼠的症状,且其作用机制可能是雌激素通过作用于ERα促进大鼠IBD的发生发展。因而,对于ERα的干预可以成为将来IBD临床治疗的可选手段之一。
| [1] | Dong G, You M, Fan H, Ji J, Ding L, Li P, et al.17β-estradiol contributes to the accumulation of myeloid-derived suppressor cells in blood by promoting TNF-α secretion[J].Acta Biochim Biophys Sin (Shanghai), 2015, 47:620-629. |
| [2] | Dubeau M F, Iacucci M, Beck P L, Moran G W, Kaplan G G, Ghosh S, et al. Drug-induced inflammatory bowel disease and IBD-like conditions[J].Inflamm Bowel Dis, 2013, 19:445-456. |
| [3] | Khalili H, Higuchi L M, Ananthakrishnan A N, Manson J E, Feskanich D, Richter J M, et al. Hormone therapy increases risk of ulcerative colitis but not Crohn's disease[J]. Gastroenterology, 2012, 143:1199-1206. |
| [4] | Orellana C, Saevarsdottir S, Klareskog L, Karlson E W, Alfredsson L, Bengtsson C.Postmenopausal hormone therapy and the risk of rheumatoid arthritis:results from the Swedish EIRA population-based case-control study[J]. Eur J Epidemiol, 2015, 30:449-457. |
| [5] | Cook L C, Hillhouse A E, Myles M H, Lubahn D B, Bryda E C, Davis J W, et al. The role of estrogen signaling in a mouse model of inflammatory bowel disease:a Helicobacter hepaticus model[J].PLoS One, 2014, 9:e94209. |
| [6] | Bábícková J, Tóthová L', Lengyelová E, Bartoňová A, Hodosy J, Gardlík R, et al. Sex differences in experimentally induced colitis in mice:a role for estrogens[J]. Inflammation, 2015, 38:1996-2006. |
| [7] | Xu X C, Chen H, Zhang X, Zhai Z J, Liu X Q, Zheng X Y, et al. Effects of oestrogen deficiency on the alveolar bone of rats with experimental periodontitis, Mol Med Rep[J]. 2015, 12:3494-3502. |
| [8] | Shen C, Chen Z,Mahmoodurrahman M, Chen X.Single nucleotide polymorphisms of ERβ and coronary atherosclerotic disease in Chinese Han women[J].Int J Clin Exp Pathol, 2015, 8:2044-2050. |
| [9] | Kane S V, Reddy D. Hormonal replacement therapy after menopause is protective of disease activity in women with inflammatory bowel disease[J]. Am J Gastroenterol, 2008, 103:1193-1196. |
| [10] | Enmark E, Pelto-Huikko M, Grandien K, Lagercrantz S, Lagercrantz J, Fried G,et al. Human estrogen receptor beta-gene structure, chromosomal localization, and expression pattern[J]. J Clin Endocrinol Metab, 1997, 82:4258-4265. |
| [11] | Bodo C, Rissman E F. New roles for estrogen receptor β in behavior and neuroendocrinology[J]. Front Neuroendocrinol, 2006, 27:217-232. |
| [12] | Levin E R. Plasma membrane estrogen receptors[J].Trends Endocrinol Metab, 2009, 20:477-482. |
| [13] | Yaghmaie F, Saeed O, Garan S A, Freitag W, Timiras P S, Sternberg H. Caloric restriction reduces cell loss and maintains estrogen receptor-alpha immunoreactivity in the pre-optic hypothalamus of female B6D2F1 mice[J]. Neuro Endocrinol Lett, 2005, 26:197-203. |
| [14] | Hasson R M, Briggs A, Carothers A M, Davids J S, Wang J, Javid S H, et al. Estrogen receptor α or β loss in the colon of Min/+ mice promotes crypt expansion and impairs TGF β and HNF3β signaling[J]. Carcinogenesis, 2014, 35:96-102. |
| [15] | 李勇.结直肠癌的雌激素受体亚型α、β的表达及受体拮抗剂抑制作用实验研究[D].广州:中山大学,2006. |
| [16] | Jia M, Dahlman-Wright K, Gustafsson J. Estrogen receptor alpha and beta in health and disease[J].Best Pract Res Clin Endocrinol Metab, 2015, 29:557-568. |
| [17] | Gómez López M, Domínguez López A, Abarca Rojano E, Rojas Hernández S, Martínez Godínez Mde L, Miliar García A, et al.17β-Estradiol transcriptionally modulates Nlrp1 and Nlrp3 inflammasomes in gonadectomized rats with inflammation[J]. Immunopharmacol Immunotoxicol, 2015, 37:343-350. |
 2016, Vol. 37
2016, Vol. 37


