放射性肺纤维化是胸部肿瘤放射治疗与核辐射事故大剂量照射人员常见的并发症,是严重影响患者治疗效果的主要原因[1]。目前,以糖皮质激素、免疫抑制剂等为主的传统疗法对放射性纤维化的防治作用并不理想,且有较大的毒副作用[2]。因此,研究高效、低毒的放射性纤维化防治药物一直是国内外放射医学界关注的热点和亟待破解的难题。
众多研究认为,活性氧自由基导致脂质过氧化和多种炎症因子在放射性肺纤维化形成中扮演重要角色[3,4]。虾青素(astaxanthin,AST)属叶黄素家族,是一种普遍存在于自然界特别是如虾、牡蛎、螃蟹等甲壳类和鲑鱼等海洋生物中的一种特殊的红色天然类胡萝卜素,分子式为 C40H52O4 [5]。AST具有强抗氧化、抗炎症、免疫力调节、抗肿瘤等多种药理学作用[6,7,8],有关AST在放射性肺纤维化防治方面的研究尚未见报道。本研究拟采用我室建立的放射性肺纤维化小鼠模型,通过观察小鼠肺组织的病理变化和检测小鼠氧化应激与肺纤维化相关指标,进而探讨AST对小鼠放射性纤维化的防治作用及其机制。
1 材料和方法 1.1 主要材料与试剂AST由美国Sigma公司提供,产品编号:SML0982。酶联免疫吸附法(ELISA) 试剂盒由加拿大Anogen公司提供。丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD)、羟脯氨酸(hydroxyproline, Hyp)检测试剂盒均来自南京建成生物研究所,小鼠造模照射60Coγ源由第二军医大学辐照中心提供。
1.2 动物分组、造模雌性8周龄C57BL/6小鼠60只,体质量(20±2) g,由中国科学院动物研究所提供。动物使用许可证号:SYXK(沪)2012-0003。经普通动物房适养1周后,随机分为3组:正常组20只,给予相同麻醉处理但不照射;照射组20只,照前、照后每天灌服0.2 mL植物油各7 d+单次全胸照射16 Gy;照射+AST组20只,照前、照后每天灌服AST(25 mg/kg体质量)各7 d+单次全胸照射16 Gy,每次灌胃0.2 mL。所有实验用小鼠自由饮水摄食。以60Co γ射线对C57BL/6小鼠行全胸照射,进行放射性纤维化的造模。装盒前由10%水合氯醛350 mg/kg腹腔注射麻醉,麻醉后装在专门设计的PE鼠盒中固定,以双侧锁骨下到剑下突为照射区,其余部位使用专门设计的铅块阻挡射线, 一次性全胸照射剂量为16 Gy,剂量率为0.7 Gy/min。照射结束后同照射处理组共同送返动物房饲养。
1.3 标本采集及处理将各组小鼠分别在造模后1、4、8、16周时各处死5只。小鼠以10%水合氯醛进行腹腔注射麻醉,心脏取血约500 μL (室温静置1.5 h,4℃,2 744 ×g离心15 min),取上清血清,保存于-80℃冰箱备用作ELISA检测。取右肺叶放置于4%多聚甲醛中固定24 h,以用作肺病理切片。其余肺放置-80℃冰箱备用,以进行SOD活性、MDA、Hyp含量的检测。
1.4 肺组织病理观察及结果评定右肺组织在多聚甲醛固定后,常规脱水,石蜡包埋,切片(厚度4 μm),行Masson染色,在光学显微镜下观察肺组织病理学改变并拍照。根据Szapiel等[9]提供的方法确定肺纤维化程度,进行半定量分析。肺纤维化评分方法:0级无肺间质纤维化,计0分;1级小鼠肺间质可见蓝染区域小于20%,计1 分;2级肺间质蓝染区域占视野的 20~50%,计2分;3级视野下蓝染面积大于 50%,计3分。先在低倍视野下选取肺纤维化最严重的区域,然后在高倍视野下选取最明显的10个视野进行评分并计算总积分,每组15张切片(每只小鼠3张,为上、中、下切面),共计45 张。
1.5 SOD活性、MDA、Hyp含量的检测肺组织SOD活性测定采用总超氧化物歧化酶(T-SOD)测试盒(羟胺法)进行测定,MDA含量测定采用MDA测定试剂盒(TBA法),Hyp的检测使用Hyp测定试剂盒(碱水解法)进行检测。本实验使用Varioskan LUX Multimode多功能酶标仪测定各项指标光密度,肺组织蛋白浓度使用碧云天BCA试剂盒检测。
1.6 小鼠血清转化生长因子β1(transforming growth factor-beta 1, TGF-β1)的测定小鼠血清TGF-β1含量使用ELISA试剂盒进行检测,为保持实验一致性,每个时间段的血清先储存在-80℃中,实验完成同时进行TGF-β1检测,操作按试剂盒说明书进行,通过标准曲线计算血清样品中的TGF-β1含量。
1.7 统计学处理采用SPSS 18.0统计软件包进行统计学分析,实验数据用x±s表示,采用单因素方差分析进行各组间比较。检验水准(α)为0.05。
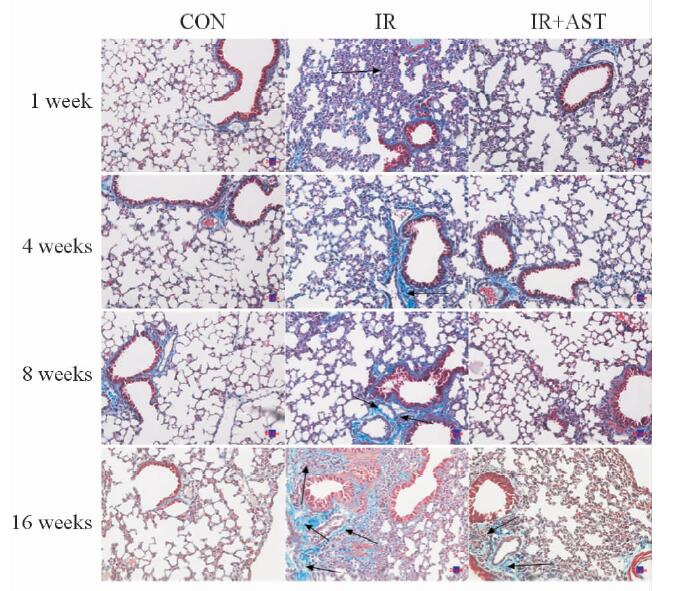
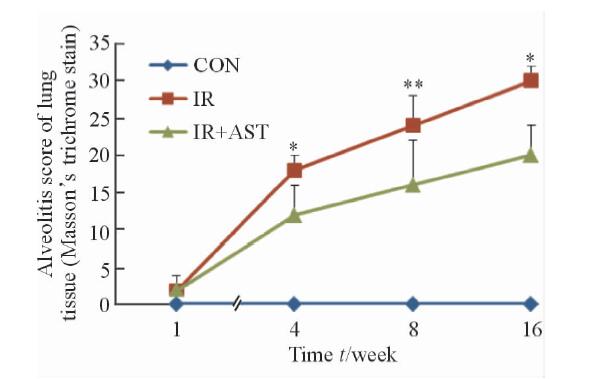
2 结 果 2.1 小鼠肺组织病理学观察在光学显微镜下,与正常组比较,照射组在照后1周小鼠肺间质有大量炎性细胞浸润;照后4周炎性细胞开始减少,但肺间质胶原纤维沉淀增多;照后8周肺间质胶原纤维明显增厚,肺结构紊乱,出现局部肺纤维化灶;照后16周肺间质形成弥漫性肺纤维化,肺结构破坏。然而,照射+AST组小鼠肺纤维化严重程度明显减轻,大部分肺泡结构完整,有少量血管壁、支气管壁增厚见纤维胶原组织少量沉积,肺间质出现少量炎性细胞浸润,肺泡间隔无明显增宽(图 1)。在肺纤维化程度评级中,照射组多为2~3级,而照射+AST组多为1~2级,肺纤维化评分总分结果在照后4、8、16周的差异有统计学意义(P<0.05或P<0.01,图 2)。
|
图 1 各组小鼠照后肺组织Masson染色病理学观察 Fig 1 Micrographs showing staining of mouse lung tissue sections with Masson’s trichrome staining CON: Control; IR: Irradiation; AST: Astaxanthin. Histopathologic Masson’s trichrome staining showed that IR group mice had severe pulmonary inflammation in the first week post-radiation, and severe interstitial pulmonary edema and macrophage accumulation were obverved 4 weeks after radiation and the latter stage (8, 16 weeks post-radiation). IR group mice had marked fibrotic changes in alveolar areas, and IR+AST group mice had greatly reduced fibrosis formation. The arrows in the diagram highlight the collagenous connective tissue of pulmonary fibrosis formation. Original magnification: ×200 |
|
图 2 各组小鼠照后各时间点肺组织Masson染色肺纤维化评分 Fig 2 Fibrosis scores of lung tissue with Masson’s trichrome staining at different time points CON:Control; IR:Irradiation; AST:Astaxanthin. *P<0.05, **P<0.01 vs IR+AST group. n=5, x±s |
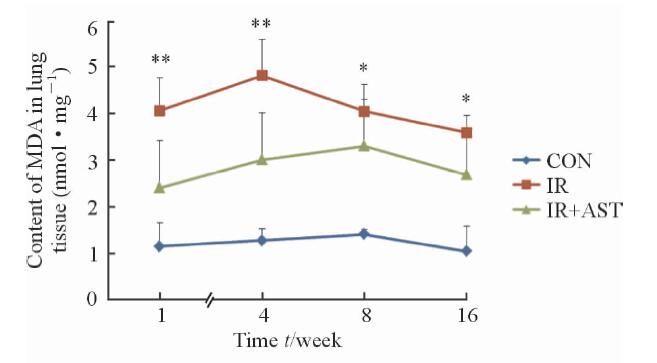
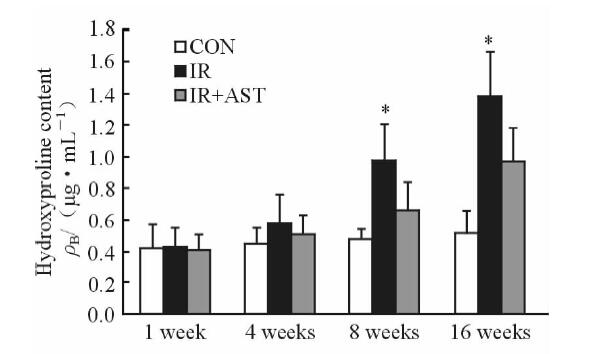
与正常组比较,在照后1、4、8、16周照射组小鼠肺组织SOD活性降低、MDA含量升高;与照射组比较,照射+AST组在上述各时间点小鼠肺组织中的SOD活性增加(P<0.05或P<0.01,图 3)、MDA含量显著降低(P<0.05或P<0.01,图 4)。正常组小鼠肺组织Hyp含量在各时间点无明显变化,小鼠受照后4周肺组织Hyp含量开始明显升高,且随照后时间的延长逐渐增加,而照射+AST组小鼠肺组织的Hyp水平显著低于照射组(P<0.05,图 5)。

|
图 3 各组小鼠照后各时间点肺组织SOD活性变化 Fig 3 SOD activity in lung tissue at 1, 4, 8 and 16 weeks after irradiation in different groups CON:Control; IR:Irradiation; AST:Astaxanthin; SOD: Superoxide dismutase. *P<0.05, **P<0.01 vs IR+AST group. n=5, x±s |
小鼠受照后各组血清中促纤维化因子TGF-β1含量较正常组增加,且随时间的延长而逐渐升高,在照后8周到达高峰。而照射+AST组小鼠血清TGF-β1含量在照后各时间点低于照射组(P<0.05或P<0.01,图 6)。提示AST可有效抑制由电离辐射诱导的TGF-β1高表达,以减轻小鼠肺纤维化的程度。
|
图 4 各组小鼠照后各时间点肺组织MDA含量变化 Fig 4 MDA contents in lung tissue at 1, 4, 8 and 16 weeks after irradiation in different groups CON: Control; IR: Irradiation; AST: Astaxanthin; MDA: Malondialdehyde. *P<0.05, **P<0.01 vs IR+AST group. n=5, x±s |
|
图 5 各组小鼠照后各时间点肺组织羟脯氨酸含量的变化 Fig 5 Hydroxyproline contents in lung tissue at 1,4,8 and 16 weeks after irradiation in different groups CON: Control; IR: Irradiation; AST: Astaxanthin. *P<0.05 vs IR+AST group. n=5, x±s |

|
图 6 各组小鼠照后各时间点血清TGF-β1的变化 Fig 6 Changes of serum TGF-β1 levels at 1,4,8 and 16 weeks after irradiation in different groups CON:Control; IR:Irradiation; AST:Astaxanthin; TGF-β1 Transforming growth factor-beta 1. *P<0.05, **P<0.01 vs IR+AST group.n=5, x±s |
放射性肺纤维化的病理过程前期是炎症细胞在肺泡与肺间质的浸润,最终导致肺间质及细胞外基质(ECM)过度沉积。一般认为病理学过程分为4个时期:炎症反应期、细胞增生期、纤维化期、胶原形成期。肺成纤维细胞是主要效应细胞,胶原合成与过度的增生是肺纤维期的重要特征,并且有多种细胞因子的共同参与[10,11]。本实验成功复制本室建立的放射性肺纤维化模型,观察到照射组早期的炎性细胞增加,后期可见胶原代谢失衡,肺间质明显增厚,而在照射+AST组中炎性表现减轻、纤维化程度降低。病理肺纤维化程度评分结果显示,照射组与照射+AST组差异具有统计学意义(P<0.05或P<0.01);并且发现小鼠肺组织Hyp含量在照后4周开始逐渐增强,16周时达到观察区内峰值。Hyp是胶原纤维中特有的成分,在正常肺组织含量较稳定,在肺损伤中参与了肺纤维化的发展,可反映肺组织内胶原纤维的变化情况[12]。因此检测Hyp含量可作为肺组织肺纤维化程度的量化指标,可反映肺纤维化严重程度。这表明早期给予AST可减轻小鼠肺纤维化的形成,促进放射性肺损伤的恢复,提示AST对放射性肺纤维化具有防治作用。
氧自由基在放射性肺纤维化机制中一直受到研究者的重视,当肺组织受到电离辐射后易产生大量氧自由基,使生物膜脂质双分子层中不饱和脂肪酸过氧化形成脂质过氧化产物,是导致肺组织脂质过氧化损伤和刺激成纤维细胞增殖的重要原因[13]。MDA是脂质过氧化损伤的产物,沉积于组织细胞,破坏细胞膜结构,是反映机体氧化损伤程度最重要的指标之一。而SOD是广泛存在于需氧代谢细胞中的一种自由基清除剂,其活力可反映机体抗氧化水平[14]。因此,检测SOD和MDA在体内的变化可以大致反映机体清除自由基能力及氧化损伤的状况。在正常机体中 SOD 能够催化超氧阴离子自由基的歧化反应生成 H2O2,过氧化氢酶和过氧化物酶的作用则是将 H2O2 转化为对机体无害的H2O和O2,保护机体组织免受损害[15]。有大量的文献证实AST具有强大的自由基清除能力,Lee等[16]比较了多种类胡萝卜素淬灭活性氧、淬灭单线态氧的能力,发现AST的作用最强,认为这可能与AST含多个不饱和双键、基团及可置换的共轭双键有关。本实验中模型小鼠受到电离辐射后肺组织MDA含量增加,SOD活性降低,与照射组相比,AST能够有效下调脂质过氧化物MDA的含量及上调抗氧化酶SOD的水平(P<0.05或P<0.01),提示AST能够减轻小鼠放射性肺纤维化严重程度,可能通过上调机体SOD活力、抑制MDA生成,改善小鼠肺抗氧化体系失衡相关。
参与放射性肺纤维化的促纤维化因子主要有TGF-β1、血小板源性生长因子(platelet-derived growth factor,PDGF)、胰岛素样生长因子-1(insulin-like growth factors -1,IGF-1)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),其中TGF-β1是被公认的最强促纤维化细胞因子[17]。TGF-β1能够抑制肺泡上皮细胞增殖、控制细胞外基质的沉积、诱导肺部成纤维细胞分化为肌成纤维细胞,还可刺激正常肺上皮细胞通过上皮间质转化转化为肌成纤维细胞,在肺纤维化进程中具有非常重要的作用,现已成为肺纤维化治疗靶标[18]。TGF-β1主要作用于胶原的转录与翻译过程,诱导肺组织高水平表达结缔组织生长因子,从而加速肺纤维化发生[4, 19]。Wang等[20]在博来霉素诱导的小鼠肺纤维化模型中使用AST,发现其可明显改善小鼠肺纤维化严重程度,减轻肺组织中胶原沉淀,下调TGF-β1、α-SMA、vimentin及上调E-cadherin、p53的表达,研究者认为这与AST能够下调TGF-β1表达,抑制成纤维细胞的分化有关。Zhang等[21]也发现,AST可诱导肌成纤维细胞凋亡而抑制肺纤维化的发生,对肺结构具有修复作用,研究认为AST可能通过调控动力相关蛋白1通路而发挥作用。在本实验中发现,电离辐射可上调小鼠血清TGF-β1表达,TGF-β1含量随时间的延长而逐渐升高,并在照后8周到达高峰,而经AST处理后可有效下调各时相小鼠血清TGF-β1水平(P<0.05或P<0.01)。表明AST可能通过下调TGF-β1表达而减轻放射性肺纤维化严重程度。本实验发现,TGF-β1的高表达相比Hyp的高表达时间有所提前,可见TGF-β1对预测纤维化发生更加敏感,这与Xue等[22]认为血清TGF-β1和Hyp可作为放射性肺纤维化预测因子的结论相同。
本实验进一步证实了小鼠肺部受大剂量照射后会导致放射性肺纤维化的发生,发现AST能够明显改善受照后小鼠肺组织病理学改变,抑制Hyp生成,提高抗氧化能力,下调促纤维化因子TGF-β1表达,表明AST对放射性肺纤维化具有防治作用,为防治放射性肺纤维化提供了新的途径。由于放射性肺纤维化发病机制复杂,AST是否还通过其他途径来发挥作用值得进一步研究。
| [1] | Wiebe E, Rodrigues G. Radiation induced lung injury. Strategies for reducing damages while optimizing therapeutic doses[J].Oncol Exchange, 2006, 5:29-32,34. |
| [2] | Delanian S, Lefaix J L. Current management for late normal tissue injury:radiation-induced fibrosis and necrosis[J]. Semin Radiat Oncol, 2007, 17:99-107. |
| [3] | Zhao W,Robbins M E.Inflamation and chronic oxidative stress in radiation-induced late normal tissue injury:therapeutic implications[J].Curr Med Chem, 2009, 16:130-143. |
| [4] | Ghafoori P, Marks L B, Vujaskovic Z, Kelsey C R. Radiation-induced lung injury-assessment, management, and prevention[J]. Oncology (Williston Park), 2008, 22:37-47. |
| [5] | Higuera-Ciapara I, Felix-Valenzuela L, Goycoolea F M. Astaxanthin:a review of its chemistry and applications[J]. Crit Rev Food Sci Nutr, 2006, 46:185-196. |
| [6] | Naguib Y M. Antioxidant activities of astaxanthin and related carotenoids[J]. J Agric Food Chem, 2000, 48:1150-1154. |
| [7] | Jyonouchi H, Sun S, Iijima K, Gross M D. Antitumor activity of astaxanthin and its mode of action[J]. Nutr Cancer, 2000, 36:59-65. |
| [8] | Iwamoto T, Hosoda K, Hirano R, Kurata H, Matsumoto A, Miki W, et al. Inhibition of low-density lipoprotein oxidation by astaxanthin[J]. J Atheroscler Thromb, 2000, 7:216-222. |
| [9] | Szapiel S V, Elson N A, Fulmer J D, Hunninghake G W, Grystal R G. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. Am Rev Respir Dis, 1979, 120:893-899. |
| [10] | 李杨,宋良文,王德文,彭瑞云,崔雪梅,高亚兵. Smad3、Smad4和Smad7在大鼠放射性肺纤维化中的表达及意义[J].辐射研究与辐射工艺学报,2004,22:153-156. |
| [11] | 刘纯杰, 王德文. 放射性肺纤维化大鼠动物模型的建立及其病变规律[J].中国兽医学报,2000,20:576-579. |
| [12] | Ziff M, Kibrick A, Dresner E, Gribetz H J. Excretion of hydroxyproline in patients with rheumatic and non-rheumatic diseases[J]. J Clin Invest, 1956, 35:579-587. |
| [13] | Ward P A.Oxidative stress:acute and progressive lung injury[J].Ann N Y Acad Sci, 2010, 1203:53-59. |
| [14] | Sternberg D I, Gowda R, Mehra D, Qu W, Weinberg A, Twaddell W, et al.Blockade of receptor for advanced glycation end product attenuates pulmonary reperfusion injury in mice[J].J Thorac Cardiovasc Surg, 2008,136:1576-1585. |
| [15] | 田兵,徐步进,华跃进.耐辐射球菌清除活性氧自由基及对DNA的保护作用[J].核农学报,2004,18:376-380. |
| [16] | Lee S H, Min D B. Effects, quenching mechanisms, and kinetics of carotenoids in chlorophyll-sensitized photooxidation of soybean oil[J]. J Agric Food Chem, 1990, 38:1630-1634. |
| [17] | Rubin P, Johnston C J, Williams J P, McDonald S, Finkelstein J N.A perpetual cascade of cytokines postirradiation leads to pulmonary fibrosis[J].Int J Radiat Oncol Biol Phys, 1995, 33:99-109. |
| [18] | Willis B C, Borok Z.TGF-beta-induced EMT:mechanisms and implications for fibrotic lung disease[J].Am J Physiol Lung Cell Mol Physiol, 2007, 293:L525-L534. |
| [19] | Svatek R S, Jeldres C, Karakiewicz P I, Suardi N, Walz J, Roehrborn C G, et al.Pre-treatment biomarker levels improve the accuracy of post-prostatectomy nomogram for prediction of biochemical recurrence[J].Prostate, 2009, 69:886-894. |
| [20] | Wang M, Zhang J, Song X, Liu W, Zhang L, Wang X, et al.Astaxanthin ameliorates lung fibrosis in vivo and in vitro by preventing transdifferentiation, inhibiting proliferation, and promoting apoptosis of activated cells[J]. Food Chem Toxicol, 2013, 56:450-458. |
| [21] | Zhang J, Xu P, Wang Y, Wang M, Li H, Lin S, et al.Astaxanthin prevents pulmonary fibrosis by promoting myofibroblast apoptosis dependent on Drp1-mediated mitochondrial fission[J].J Cell Mol Med, 2015, 19:2215-2231. |
| [22] | Xue J, Gan L, Li X, Li J, Qi G, Wu Y, et al.Effects of lysophosphatidic acid and its receptors LPA1/3 on radiation pneumonitis[J]. Oncol Rep, 2010, 24:1515-1520. |
 2016, Vol. 37
2016, Vol. 37


