冠状动脉瘘(coronary artery fistula,CAF)是一种连接于1支或多支冠状动脉与某一心房、心室或心脏周围血管之间的先天性冠状动脉畸形。该病罕见,发病率约为0.002%[1],其临床症状无特异性。以往多采用外科手术治疗CAF,近年来随着介入治疗技术的进步及新器械的应用,接受经皮介入治疗的CAF患者逐年增多。关于CAF的介入治疗,目前的文献报道多为个案。本研究回顾性分析了2009年8月至2015年8月在第二军医大学长海医院行经皮CAF封堵术的70例患者的临床资料,并对单中心经验进行总结。
1 资料和方法 1.1 一般资料共70例患者,男42例(60.00%),女28例(40.00%);年龄15~83岁,平均(56.30±15.54)岁。临床有胸闷、胸痛症状者38例(54.29%),胸骨左缘2~4肋间可闻及2~3/6级收缩期杂音者5例(7.14%)。所有患者均经皮冠状动脉造影明确诊断为CAF,并成功实施介入封堵术。
1.2 入选与排除标准入选标准:年龄>3岁,体质量>10 kg,CAF入心腔或心脏周围血管者。排除标准:(1)合并感染性心内膜炎,在6周内体温正常者;(2)心腔内有赘生物或存在其他感染性疾病者;(3)封堵器安置处或导管插入径路中有血栓形成者;(4)合并其他心脏畸形需外科手术治疗者;(5)合并出血性疾病和血小板减少或合并明显的肝、肾功能异常者;(6)美国纽约心脏病学会(NYHA)心功能分级Ⅳ级,不能耐受手术操作者。
1.3 封堵器GDC-10 360度STANDARD SR 可控弹簧圈为美国Bosten Scientific公司生产;动脉导管未闭封堵器、室间隔缺损封堵器均由上海形状记忆合金材料有限公司生产;带膜支架(NC MERCURY, 3.5 mm×16 mm)由美国Abbott公司生产;血管封堵器(plug)为美国Amplazer公司生产。当封堵器和瘘管的大小不匹配时,可通过输送导丝将封堵器回收,更换为合适的封堵器。
1.4 手术方法局部麻醉后参照文献[2]的方法常规经股动脉行左、右冠状动脉造影术,多角度观察CAF的解剖结构,如瘘口大小、起源、形态、走行、终止部位、分布及单发或多发、瘘管途径结构是否有供应正常心肌的冠脉分支、有无相关侧枝血管,以选择合适的输送途径和栓塞材料。同时进行右心导管检查,测肺循环血流量/体循环血流量(quantity of pulmonary circulation/quantity of system circulation, Qp/Qs)比值。根据瘘管实际情况制定封堵策略,一般送入6F导引导管至冠状动脉口,经此导管送入Runthrough NS导丝至冠状动脉-瘘管,通过微导管交换送入弹簧圈至CAF处作封堵。术后再次造影以明确封堵情况及左、右冠状动脉血流是否受到影响,密切观察心电监护15 min,至生命体征平稳时结束手术。
2 结 果 2.1 冠状动脉造影结果70例患者共有101个瘘,其中瘘管起源于左主干9例(8.91%),前降支43例(42.57%),回旋支15例(14.85%),右冠34例(33.66%);瘘终止于肺动脉79例(78.22%),右心房16例(15.84%),右心室2例(1.98%),其他4例(3.96%)。瘘管的平均直径为(3.95±2.61) mm,Qp/Qs比值为1.48±0.10。
2.2 手术疗效70例患者均封堵成功,其中使用弹簧圈封堵60例(85.71%),平均植入弹簧圈(2.55±1.76)枚,见图 1;动脉导管未闭封堵器封堵5例(7.14%),plug封堵2例(2.86%),肌部室间隔缺损封堵器封堵2例(2.86%),封堵器的平均直径(13.33±4.32) mm ;带膜支架封堵1例(1.43%)。术后5例患者心前区杂音均消失或减弱,临床症状明显改善,无手术并发症。
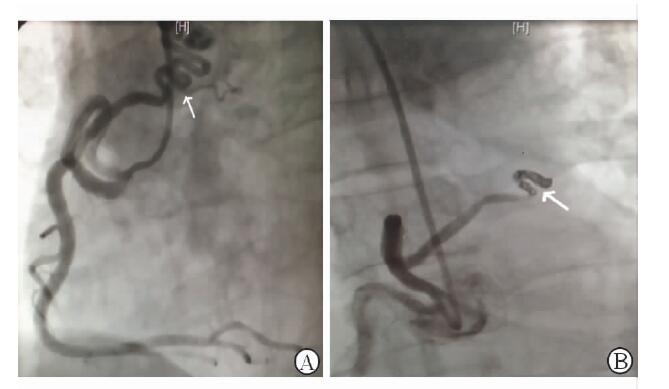
|
图 1 右冠-肺动脉瘘术前(A)和弹簧圈封堵术后(B) 白色箭头示右冠-肺动脉瘘 |
术后服用阿司匹林肠溶片3~5 mg/(kg·d) 6个月,术后1、3、6、12个月及此后每年复查心电图和心脏彩超。随访1~73个月,平均(33.94±20.93)个月,患者均未发生出血、溶血、栓塞、胸痛及其他不良反应。
3 讨 论CAF大多是由于胚胎时期冠状动脉循环及心肌发育异常所致,在胎儿原始心脏发育过程中,心肌窦状间隙不退化而持续存在便形成冠状动脉和心腔、肺动脉、冠状静脉窦等之间的异常交通,少部分是后天因素形成。CAF对血流动力学的影响主要取决于瘘的大小和瘘入的部位。瘘入右心系统时,增加右心负荷,并使肺血流量增多,导致Qp/Qs >1.8者较少,长期左向右分流可导致肺动脉高压,随着年龄增长可并发充血性心力衰竭;瘘入左心系统时,心脏收缩和舒张期血流经瘘管分流入左房或舒张期分流入左心室,均使左,心负荷增加。采用右心导管检测Qp/Qs更接近生理情况,对于判断病情有重要作用。
CAF最主要的病理生理学问题为冠状动脉“窃血现象”,临床症状多不典型,表现为胸闷胸痛[3]、乏力,甚至出现晕厥[4]等危及生命的症状。CAF可以起源于冠状动脉的任何主干及分支,以右冠、前降支多见[5]。瘘的终止部位最常见于右心系统,尤其是肺动脉。本组70例患者中多数起源于右冠及前降支(76.24%),瘘的出口多位于右心系统(96.04%)与文献报道相似[2, 6]。
目前,冠状动脉造影仍是诊断CAF的金标准[7],可动态观察瘘口处造影剂的喷射征象、瘘的形态、走形等特征,提供CAF的详细形态学及血流动力学信息,并可同步行介入治疗。介入治疗必须严格遵循适应证和禁忌证[8]。适应证:(1)巨大型先天性CAF,不合并其他需要外科矫正的心脏畸形;(2)易安全到达、能够清晰显影的瘘管;(3)非多发的CAF开口(单发CAF);(4)冠状动脉一支或多支形成与心腔相连的多发的微小血管网,可用带膜支架进行封堵。禁忌证:(1)CAF发生在先天性单一冠状动脉或左主干上;(2)多发性CAF瘘口;(3)待封堵的病变冠状动脉远端有正常冠状动脉分支供血,封堵易造成相应心肌组织梗死;(4)待封堵的病变冠状动脉极度迂曲或过粗难以达到满意封堵效果;(5)伴重度肺动脉高压或出现右向左分流。
常用的封堵器有弹簧圈、Amplatzer蘑菇伞封堵器、plug等[9],也有采用自体脂肪粒[10]成功堵塞的报道。周达新等[2]对16例CAF患者进行介入治疗,根据CAF的形态、走形和大小选择不同的封堵器,15例患者分别应用动脉导管未闭封堵器、plug或弹簧圈治疗,一次成功率达93.8%,随访无残余分流,无死亡。冯灿等[11]对采用电解弹簧圈封堵CAF的40例患者随访1~65个月未发生再出血及缺血并发症。Zhang等[9]采用动脉导管未闭封堵器、肌部室间隔缺损封堵器、plug及Amplazer封堵器对18例中大型CAF患者行介入封堵术,随访发现仅有1例术后出现短暂出血。本组70例CAF病例均经冠状动脉造影检查确诊,并成功进行封堵,疗效确切;大部分患者采用弹簧圈进行封堵,可能与以下因素有关:(1)瘘管局部有较狭窄处;(2)瘘管直径较小。对瘘直径较大、瘘管呈管状(无较狭窄处)的患者多采用动脉导管未闭封堵器、室间隔缺损封堵器或plug进行封堵。
据我们所知,本文是目前经皮介入封堵治疗CAF病例数目最多、随访时间最长的报道。我们根据CAF不同的形态、走形和直径选择不同的封堵器进行介入治疗,需要注意的有:(1)尽可能把封堵器放到瘘管的远端,以减少对冠脉分支血供的影响。(2)释放封堵器之前,一定要反复多角度进行冠状动脉造影,以确认封堵器的形态、大小、位置是否适合。(3)只有在冠脉造影证实封堵器形态良好、位置准确,同时经胸超声排除残余分流及心脏瓣膜损害的情况下,才能释放封堵器。(4)冠状动脉指引导管应从股动脉进入,其头端与封堵器相接。对于瘘较大的,选择输送鞘要比目标鞘大1F。(5)瘘管局部有狭窄者,宜选择比狭窄部位直径大30%~50%的封堵器;瘘管无明显狭窄(即管状)者选择plug或者动脉导管未闭封堵器,直径应比瘘管大20%~30%;瘘管出口处小于2 mm,选择弹簧圈进行封堵。(6)手术需要有经验的术者,动作轻柔,尽量避免操作过程中损伤心脏正常结构。本研究不足之处是输送鞘较大,可能对血管内皮有损伤。
CAF极少自然闭合,随着年龄的增长,患者出现症状的比例明显增大。对于所有出现症状的中大型CAF均应进行治疗[12],而对无症状或小的CAF的治疗策略目前尚存在争议,但一旦出现Qp/Qs > 1.5、心肌梗死、心内膜炎或动脉瘤,有引起附壁血栓、瘘管破裂或堵塞边支血管的风险时,仍建议及早进行治疗[6]。长期左向右分流可引起心力衰竭,冠状动脉窃血引起远端心肌缺血甚至心肌梗死,动脉瘤内血栓脱落引起冠脉或外周血管栓塞,外周静脉血中致病菌瘘入动脉系统引起感染性心内膜炎等并发症,为预防这些并发症的出现,应尽早封堵CAF,经皮介入封堵CAF安全、有效、创伤小,可优先考虑。
| [1] | Loukas M, Germain A S, Gabriel A, John A, Tubbs R S, Spicer D. Coronary artery fistula:a review[J]. Cardiovasc Pathol, 2015, 24:141-148. |
| [2] | 周达新,管丽华,潘文志,张晓春,李明飞,梁立龙,等.冠状动脉瘘的介入治疗探讨[J].中国临床医学,2013,20:638-640. |
| [3] | Quintana-Quezada R A, Vahdat K K, Postalian A, Nathan S, Kar B, Loyalka P. Coronary artery fistula causing angina pectoris after cardiac surgery-an interesting pathophysiologic link[J]. Int J Cardiol, 2015, 201:85-87. |
| [4] | Mori K, Nagata M, Oe K, Takabatake S, Sakata K, Uchiyama K, et al. Coronary arteriovenous fistulas complicated by complete atrioventricular block:a case report[J]. J Cardiol Cases, 2011, 4:e38-e42. |
| [5] | Jama A, Barsoum M, Bjarnason H, Holmes D R Jr, Rihal C S. Percutaneous closure of congenital coronary artery fistulae:results and angiographic follow-up[J]. JACC Cardiovasc Interv, 2011, 4:814-821. |
| [6] | Niizeki T, Daidouji H, Ootaki Y, Kaneko K, Ito M, Oguma M, et al. Transcatheter coil embolization of coronary artery fistulas[J]. J Cardiol Cases, 2010, 2:e55-e58. |
| [7] | 刘光锐,郭曦,李铁铮,李彭,薛玉国,黄小勇,等.成人先天性冠状动脉瘘的临床及冠状动脉造影表现[J].临床放射学杂志,2014,33:354-357. |
| [8] | 姚青,宋治远.先天性冠状动脉瘘的介入治疗现状[J].心血管病学进展,2010,31:659-661. |
| [9] | Zhang Z G, Xu X D, Bai Y, Zhang X L, Tan H W, Zhu Y F, et al. Transcatheter closure of medium and large congenital coronary artery fistula using wire-maintaining technique[J]. J Cardiol, 2015, 66:509-513. |
| [10] | 金国珍,陈绍良,刘志忠,单守杰,张俊杰.自体脂肪栓塞治疗冠状动脉瘘5例临床分析[J].山西医药杂志,2014,43:173-175. |
| [11] | 冯灿,郭俊,冀涛,朱嘉琦,赵仙先.电解弹簧圈介入治疗冠状动脉瘘的单中心经验——可行性、安全性分析[J].介入放射学杂志,2015,24:373-377. |
| [12] | Tzeng P R, Lee K C, Wei J, Chuang Y C, Chang C Y. Large coronary artery fistula[J]. Formos J Surg, 2015, 48:140-143. |
 2016, Vol. 37
2016, Vol. 37


