缺血性脑血管疾病是神经系统的常见疾病,具有高发病率、高致残率及高致死率的特点,严重危害人类健康。新血管的形成(angiogenesis)是脑梗死后早期的重要过程,能改善局部血流供应,帮助清除坏死组织,为神经元修复、再生创造良好的微环境,从而促进神经功能康复[1]。排斥性导向分子 a(repulsive guidance molecule a,RGMa)是一种轴突导向因子。近期研究发现,RGMa在中枢神经系统受损后过度表达[2],与其受体Neogenin结合后,介导轴突生长抑制、排斥性导向作用,并参与了神经增殖、分化、存活等过程[3]。研究发现血管和神经系统具有一定的相似性,因此它们之间存在着一些共同的的分子信号,许多神经导向因子如Netrin-1、Netrin-4、Ephrin-B2等在神经和血管生长过程中均能发挥调节作用[4]。但目前关于RGMa在血管系统中的作用尚待阐明。本研究采用重组腺病毒对缺血再灌注大鼠脑组织RGMa的转录进行RNA干扰(RNA interference, RNAi),从而抑制RGMa表达,观察血管再生情况,探讨RNA干扰RGMa对大鼠局灶性缺血再灌注后血管再生的影响及潜在的机制。
1 材料和方法 1.1 材料与试剂RGMa特异性RNAi重组腺病毒rAd-shRGMa(产品名:rAd5-P748;病毒滴度:2.5×1010 pfu/mL)及空载体重组腺病毒rAd-HK(产品名:rAd5-HKshRNA;病毒滴度:2.5×1010 pfu/mL)购自武汉晶赛生物工程技术有限公司。兔抗大鼠RGMa多克隆抗体、小鼠抗大鼠CD31单克隆抗体购自Abcam公司,兔抗大鼠Neogenin多克隆抗体购自Santa Cruz公司,兔抗大鼠血管内皮生长因子a (VEGFa)多克隆抗体、小鼠抗大鼠β-actin多克隆抗体购自Proteintech公司。Dylight 488标记山羊抗兔IgG购自Earthox公司,Cy3标记山羊抗小鼠IgG购自Proteintech公司。免疫组化检测相关试剂盒、免疫印迹检测相关试剂盒购自碧云天生物技术有限公司。
1.2 实验动物及分组清洁级成年雄性SD大鼠50只,体质量180~280 g,购于重庆医科大学实验动物中心。将大鼠随机分为4组,即假手术组(S组)、脑缺血再灌注损伤血组(I/R组)、脑缺血再灌注损伤+RNAi重组腺病毒干预组(I/R+rAd-shRGMa组)以及脑缺血再灌注损伤+空载体重组腺病毒注射组(I/R+rAd-HK组)。假手术组除了不插入线栓外,其余步骤同模型制作。I/R组制作大脑中动脉缺血再灌注损伤模型,参照本课题组前期的线栓法[5,6]制备,结合Longa评分[7];1~3分的大鼠纳入实验,0分与4分以及在取材时发现有蛛网膜下隙出血者剔除实验组,并从同批次实验大鼠中随机抽取补齐。I/R+rAd-shRGMa组和I/R+rAd-HK组大鼠接受腺病毒注射后立即制作脑缺血再灌注损伤模型。腺病毒的立体定位参照本课题组前期的实验方法[6],以前囟为坐标原点,右侧两点皮质(2.0,1.0,-1.2) mm、(1.5,-3.0,-1.2) mm以及海马(2.5,-3.5,-3.5) mm作为靶点。每个点分别注射腺病毒2 μL,注射速度0.2 μL/min,注射完毕后保留微量进样器在原位5 min后拔针。I/R组再分为2 d和7 d亚组,2 d组用免疫荧光定位RGMa及其受体Neogenin在缺血脑组织中的表达,其余大鼠在脑缺血再灌注后7 d分别进行免疫组化微血管计数及蛋白质印迹实验检测VEGFa的表达。所有大鼠在处死前进行神经功能评分。
1.3 蛋白质印迹实验大鼠断头取脑后,取出缺血侧大脑中动脉供血区皮质于-80℃保存。按照蛋白提取说明书提取出组织蛋白。蛋白样品在10%的SDS-PAGE 凝胶中分离后,转移至PVDF膜上,与兔抗大鼠VEGFa多克隆抗体(1∶750)或小鼠抗大鼠β-actin多克隆抗体(1∶3 000)4℃孵育过夜。二抗(1∶1 000)室温孵育2 h后,使用凝胶成像分析系统扫描拍照,应用Fusion软件进行结果分析,以VEGFa/β-actin的相对值表示蛋白表达水平。
1.4 免疫荧光检测取大鼠缺血侧脑组织制备冰冻切片(片厚10 μm),-80℃保存。取出晾干,放入丙酮中固定30 min,PBS冲洗后放入乙二胺四乙酸(EDTA)溶液(1 mmol/L,pH=8)中进行微波修复,10 min后PBS冲洗;加入0.3%Triton破膜,PBS冲洗后封闭血清37℃孵育1 h,甩去血清;兔抗大鼠RGMa多克隆抗体(1∶50)、兔抗大鼠Neogenin多克隆抗体(1∶20)分别与小鼠抗大鼠CD31单克隆抗体(1∶100)混合后,滴加到脑组织上,4℃孵育过夜。第2天将切片37℃复温1 h,PBS冲洗后,在避光条件下加入Dylight 488标记山羊抗兔IgG(绿光)和Cy3标记山羊抗小鼠IgG(红光)的混合二抗(稀释浓度均为1∶100),37℃孵育2 h后PBS冲洗,50%甘油封片。激光共聚焦显微镜下观察拍照。
1.5 免疫组化及微血管计数从每只大鼠冰冻切片中随机抽取5张,经过抗原修复、破膜、H2O2灭活内源性过氧化物酶、血清封闭后,与小鼠抗大鼠CD31单克隆抗体(1∶200)混合,4℃孵育过夜,按照说明书进行免疫组化染色、DAB显色并封片。在显微镜下观察阳性细胞并拍照,每张切片中采集5个不重叠的200倍视野进行微血管计数。参考Weidner改良微血管计数法[8],染色棕黄、与背景明显有别的内皮细胞作为一个计数单位(相互分离的内皮细胞、内皮细胞簇、内皮细胞条索均按1个微血管计数),不以是否形成血管管腔或管腔内有无红细胞作为计数单位,管腔>6个红细胞大小、带有肌层的血管不计算在内。
1.6 神经功能评估参照Garcia等[9]的评分标准,采用评分者单盲的方法对大鼠的自主运动、四肢运动协调性、前肢运动对称性、爬网能力、躯体本体感觉以及胡须刺激的反应等6项进行评分,最低分3分,最高分18分,得分越低表明神经功能缺损越严重。
1.7 统计学处理应用SPSS 17.0统计软件,计量数据以±s表示。多组间比较采用单因素方差分析(ANOVA),方差齐时两两比较行LSD检验,方差不齐时行Tamhane检验。检验水准(α)为0.05。
2 结 果 2.1 缺血再灌注损伤后RGMa及其受体Neogenin的表达共聚焦结果(图 1)显示,大鼠缺血周围脑皮质区可见RGMa(图 1A,绿光)与Neogenin(图 1B,绿光),均在CD31+细胞(红光)上表达。
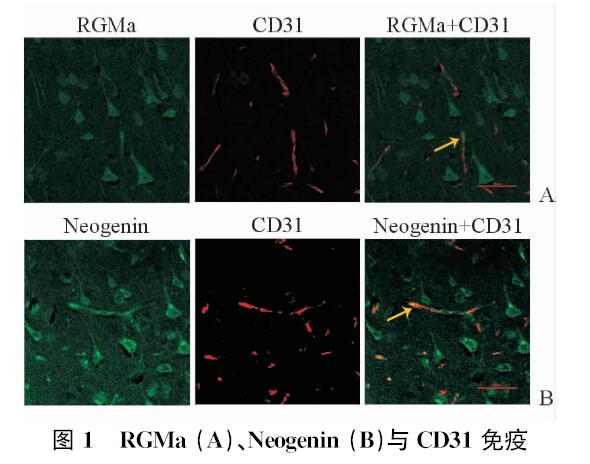
|
图 1 RGMa (A)、Neogenin (B)与CD31免疫荧光双标阳性细胞染色 Fig 1 Dual-labeled immunofluorescence of RGMa (A) or Neogenin (B) with CD31 RGMa:Repulsive guidance molecule a. Arrows showing RGMa+, Neogenin+ endothelial cells. Original magnification:×600 |
大鼠脑缺血再灌注损伤后7 d,缺血周边区可见CD31标记的棕色的单个内皮细胞散在分布或呈细条索排列(图 2)。I/R组微血管数量(54.6±6.35)较S组(9.40±1.14)增多(P<0.01);I/R+rAd-HK组微血管数量为56.60±4.16与I/R组比较差异无统计学意义;I/R+rAd-shRGMa组微血管数量最多(77.80±3.70),与其他3组比差异均有统计意义(P<0.01)。
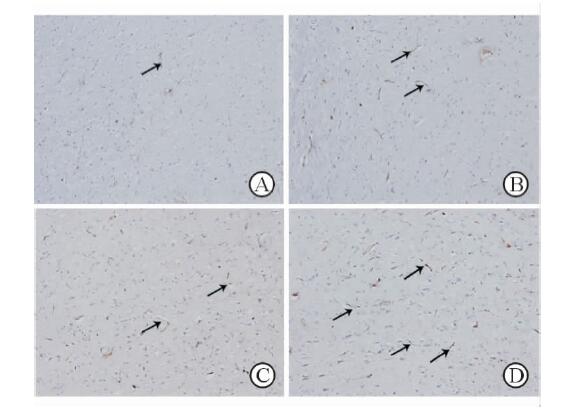
|
图 2 rAd-shRGMa对大鼠大脑皮质缺血周围区CD31表达的影响 Fig 2 Effects of rAd-shRGMa on CD31 expression in peri-infarction cortex area A:Sham operated group; B:Cerebral ischemia/reperfusion(I/R) group; C:I/R+rAd-HK group; D:I/R+rAd-shRGMa group. Arrows show CD31+ cells. Original magnification:×200 |
如图 3所示,脑缺血再灌注损伤后(I/R组)大鼠缺血侧脑皮质VEGFa蛋白表达较S组升高(P<0.01)。与I/R组比较,I/R+rAd-HK组VEGFa蛋白水平无明显变化(P>0.05),而I/R+rAd-shRGMa组VEGFa蛋白水平升高(P<0.01)。
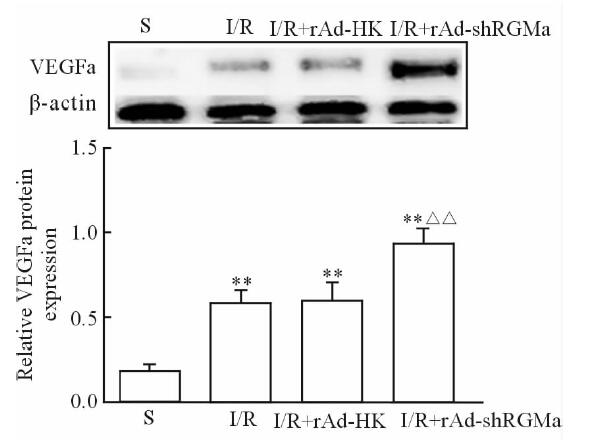
|
图 3 rAd-shRGMa对缺血侧脑皮质VEGFa蛋白表达的影响 Fig 3 Effects of rAd-shRGMa on the expression of VEGFa in the ischemia cortex tissues of each group S: Sham operated; I/R:Ischemia/reperfusion; VEGFa: Vascular endothelial growth factor a.**P<0.01 vs S group; △△P<0.01 vs I/R group. n=5, x±s |
与S组比较,I/R组大鼠出现严重的神经功能缺损(P<0.01)。给予腺病毒rAd-shRGMa干预后,大鼠的神经功能缺损减轻(P<0.01),而I/R+rAd-HK组大鼠神经功能缺损与I/R组比较未见明显变化。见表 1。
|
|
表 1 各组大鼠神经功能评分 Tab 1 Neurological scores of rats in different groups |
近期研究发现RGMa不仅参与了细胞的增殖、分化、黏附和迁移以及轴突导向等早期神经系统发育过程,在神经系统损伤后,还介导了轴突生长的抑制、炎症反应的调节等,在脑缺血、多发性硬化、老年性痴呆等中枢神经系统疾病的病理机制中发挥着多种作用[3]。近年来,许多研究表明血管神经系统拥有一些共同的机制及特性,并且有研究证实一些神经导向因子在对神经生长起导向作用的同时也对血管发生起着调节作用,例如神经轴突导向四大家族之一Netrin家族的成员Netrin-1在血管生成中发挥着重要作用[10]。在调节血管新生的过程中,Neogenin可作为Netrin-1的受体,介导Netrin-1对血管平滑肌的作用[11],然而其对内皮细胞的促血管生成效应可能并非由Netrin介导。值得注意的是,Neogenin也是神经系统中RGMa的主要受体,且RGMa与Neogenin结合的亲和力远高于Netrin-1[12]。已有研究发现在肿瘤进展过程中RGMb可能参与调节HGF和BMP-7介导的血管新生过程[13],但关于RGMa是否参与调节缺血再灌注脑损伤后血管再生的过程,目前鲜有报道。
本研究发现,大鼠脑缺血再灌注损伤后7 d,缺血皮质周围区微血管数目较假手术组(S组)明显增加(P<0.01),这与Hayashi等[14]报道的血管新生从卒中后1 d开始并在3~7 d迅速增多相一致。研究报道RGMa在局灶脑缺血再灌注12 h时开始升高,2 d时达高峰,随后有所下降,在2周时仍稍高于正常水平[2]。RGMa的受体Neogenin则在缺血再灌注损伤后1 d开始持续升高,并在14 d达到高峰[15]。而在本研究中,RGMa表达的高峰期即缺血再灌注损伤后2 d,RGMa及其受体Neogenin在血管内皮细胞上均有表达,提示其可能参与损伤后血管新生的过程。本课题组前期研究已经证明,用重组腺病毒rAd-shRGMa进行特异性RNAi可显著降低RGMa表达、促进轴突生长、改善大鼠神经功能[16]。当给予腺病毒抑制RGMa表达后,缺血皮质周围区微血管数量较对照组增多(P<0.01),且神经功能改善(P<0.01)。因此,RGMa可能在缺血再灌注损伤后发挥负性调节作用,通过RNAi抑制RGMa表达则促进了血管的再生,而新生的血管改善了缺血、缺氧引起的神经细胞损伤,从而促进神经功能的康复。
缺血性脑卒中后血管再生涉及多种生长因子和细胞因子,如血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)及血管紧张素(Ang)等,其中VEGF具有诱导血管新生、促血管内皮细胞增殖和增加血管通透性等生物活性[17],VEGFa是其主要的亚型。本研究发现,经RNA重组腺毒干预后VEGFa蛋白表达水平较对照组升高(P<0.01)。
综上所述,RGMa可能通过抑制缺血再灌注损伤后VEGFa的表达从而阻碍缺血再灌注损伤后的血管再生,而RNA干扰抑制RGMa表达后,有利于VEGFa发挥血管再生调节作用,最终促进了缺血再灌注后血管新生。因而在缺血再灌注损伤后血管再生过程中RGMa可能通过受体Neogenin调控VEGF通路发挥负性调节作用,但其机制仍有待进一步的研究。
| [1] | Taguchi A, Soma T, Tanaka H, Kanda T, Nishimura H, Yoshikawa H, et al. Administration of CD34+ cells after stroke enhances neurogenesis via angiogenesis in a mouse model[J].J Clin Invest, 2004, 114:330-338. |
| [2] | Jiang F,Yin H,Qin X.Fastigial nucleus electrostimulation reduces the expression of repulsive guidance molecule, improves axonal growth following focal cerebral ischemia[J].Neurochem Res, 2012, 37:1906-1914. |
| [3] | 王恬竹,秦新月.排斥导向分子在中枢神经系统中的研究进展[J].西部医学,2014,26:680-682,685. |
| [4] | 许伯凯,陈建伟,郑雅媛,李佳盈,翁颖盛.血管发生及其与神经发生之间联系的研究进展[J].东南大学学报(医学版), 2012,31:763-767. |
| [5] | 程创,秦新月,郭佳,燕伟平,徐广会,白永生. 过表达Fibulin-5对大鼠脑缺血再灌注损伤后血脑屏障的保护作用[J].第三军医大学学报,2014,36:1386-1389. |
| [6] | Feng J, Wang T, Li Q, Wu X, Qin X.RNA interference against repulsive guidance molecule A improves axon sprout and neural function recovery of rats after MCAO/reperfusion[J].Exp Neurol,2012,238:235-242. |
| [7] | Longa E Z, Weinstein P R, Carlson S, Cummins R.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989, 20:84-91. |
| [8] | Weidner N, Folkman J, Pozza F, Bevilacqua P, Allred E N, Moore D H,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma[J]. J Natl Cancer Inst, 1992, 84:1875-1887. |
| [9] | Garcia J H, Wagner S, Liu K F, Hu X J.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats. Statistical validation[J].Stroke, 1995, 26:627-635. |
| [10] | 胡佳,朱超,黄矛.神经导向因子Netrin-1在血管生成中可能的双向作用[J].第二军医大学学报, 2009,30:950-952. HU J,ZHU C,HUANG M.The possible dual role of neuronal guidance factor netrin-1 during angiogenesis and vascularization[J]. Acad J Sec Mil Med Univ, 2009, 30:950-952. |
| [11] | Park K W, Crouse D, Lee M, Karnik S K, Sorensen L K, Murphy K J,et al.The axonal attractant Netrin-1 is an angiogenic factor[J]. Proc Natl Acad Sci USA, 2004, 101:16210-16215. |
| [12] | Wilson N H,Key B. Neogenin:one receptor, many functions[J]. Int J Biochem Cell Biol, 2007, 39:874-878. |
| [13] | Sanders A J, Ye L, Li J, Mason M D,Jiang W G. Tumour angiogenesis and repulsive guidance molecule b:a role in HGF- and BMP-7-mediated angiogenesis[J]. Int J Oncol, 2014, 45:1304-1312. |
| [14] | Hayashi T, Noshita N, Sugawara T,Chan P H. Temporal profile of angiogenesis and expression of related genes in the brain after ischemia[J]. J Cereb Blood Flow Metab, 2003, 2:166-180. |
| [15] | Tsuchiya A, Hayashi T, Deguchi K, Sehara Y, Yamashita T, Zhang H, et al. Expression of netrin-1 and its receptors DCC and neogenin in rat brain after ischemia[J]. Brain Res, 2007, 1159:1-7. |
| [16] | Wang T, Wu X, Yin C, Klebe D, Zhang J H, Qin X. CRMP-2 is involved in axon growth inhibition induced by RGMa in vitro and in vivo[J]. Mol Neurobiol, 2013, 47:903-913. |
| [17] | Ferrara N. Role of vascular endothelial growth factor in regulation of physiological angiogenesis[J].Am J Physiol Cell Physiol, 2001, 280:1358-1366. |
 2016, Vol. 37
2016, Vol. 37


