盐酸坦索罗辛(tamsulosin hydrochloride,TSH)作为一种高选择性的 α1A肾上腺能受体阻断剂被广泛地用于治疗良性前列腺增生症(benign prostatic hyperplasia, BPH)的下尿路症状(lower urinary tract symptons,LUTS)[1]。BPH 是一种慢性病,需要长期用药治疗,TSH口服吸收快、起效快,但可能会引起低血压、眩晕等不良反应,故临床建议应用TSH的缓释制剂,以提高患者服药的顺应性[2,3]。TSH 由日本山之内制药公司研制,1993 年在日本首次上市[4,5],1996 年其缓释胶囊哈乐(Harnal®)在国内上市。鉴于国内前列腺疾病发生率不断上升和该药良好的市场前景,国内厂家也相继研发和上市了以缓释胶囊和缓释片为主的缓释制剂。
缓释微丸胶囊属于多单元释放体系,在胃肠道中分布均匀、面积大,生物利用度高,但TSH缓释微丸的多数研究和制备方法对设备要求高或工序比较复杂,如需要挤出滚圆、离心造粒、双层控释包衣或混丸等。为了使工艺简便可控,本研究采用流化床同时完成空白糖丸载药和缓释包衣两步工艺,并且将EUDRAGIT® NE 30 D、EUDRAGIT® L 30 D-55 和羟丙基甲基纤维素(HPMC) Methocel® E3组合作为控制 TSH 释放的单一缓释层制备TSH缓释微丸,考察其体外释放度和贮存稳定性。
1 材料和仪器DPL-0.2流化床(重庆精工制药机械);ERWEKA DT800自动取样溶出仪(德国 ERWEKA公司);岛津 10A系列高效液相色谱仪(日本岛津公司)。
TSH 原料药(含量 99.98%,常州四药制药有限公司提供);空白糖丸(粒径0.9~1.0 mm,杭州高成生物营养技术有限公司);丙烯酸树脂水分散体 EUDRAGIT® NE 30 D(德国赢创工业集团);丙烯酸树脂水分散体 EUDRAGIT® L 30 D-55(德国赢创工业集团);HPMC Methocel® E3(卡乐康包衣技术有限公司);滑石粉(辽宁海城精华矿产有限公司)。乙腈为色谱纯,其余试剂均为分析纯。
2 方法和结果 2.1 TSH 缓释微丸的制备 2.1.1 空白小丸上药称取TSH原料药0.2 g,超声溶解在60 g 50%(质量分数)乙醇溶液里,另加入10% HPMC水溶液2 g,搅拌均匀即得上药溶液。设定流化床进风温度为 32℃,取空白糖丸 200 g,在流化状态下预热 5 min,在 0.8 bar(1 bar=100 kPa)雾化压力下,以底喷的方式、 1 g/min的平均喷液速率进行上药,期间保持物料温度在 28℃。上药结束后,继续沸腾干燥 10 min。
2.1.2 缓释层包衣取 100 g上样小丸在流化床里进行缓释层的包衣。包衣液配方由 EUDRAGIT® NE 30 D 水分散体36.4 g、10%干聚物的 EUDRAGIT® L 30 D-55 水分散体 8.4 g、10% Methocel® E3水溶液 2.4 g、滑石粉 12 g和纯化水 82 g 组成,包衣液含固量为 17%。设定流化床进风温度为 36℃,取 100 g上样小丸,在流化状态下预热 5 min,在 1.0 bar 雾化压力下,以底喷的方式以 1.2 g/min的平均喷液速率进行包衣,期间保持物料温度在 30℃。包衣结束后,继续沸腾干燥 5 min。
2.1.3 包衣后处理包衣结束后,在微丸中混入 0.5%的滑石粉,混匀,然后将微丸装 PE 袋密封,置 45℃烘箱内愈合 24 h。
2.2 体外释放度的测定采用HPLC法[6]测定释放介质中TSH的含量,在0.04~0.40 μg/mL范围内,回归方程为:Y= 303 692 X +821.34(r=0.999 9,n=6)。方法的精密度(RSD=0.37%,n=6)和回收率(平均回收率98.73%,RSD=1.76%,n=9)试验结果均符合要求,稳定性试验表明供试品溶液在12 h内稳定。
根据《中华人民共和国药典》(2010年版)二部附录Ⅹ C第一法,采用溶出度测定法第二法的装置[7],以盐酸溶液(氯化钠2.0 g,盐酸 7 mL,加水至 1 000 mL,调节 pH值为 1.2) 500 mL,加聚山梨醇酯 80 溶液(3→200) 1 mL为溶剂,转速为100 转/分,依法操作,2 h时迅速将杯中溶液换成 37℃的磷酸盐缓冲液(pH 7.2) 500 mL,继续实验。分别于不同时间取溶出介质10 mL,测定含量。参照国家标准[6],在 2、 3和 5 h时的累计释放量应分别为 12%~39%、44%~70%和>70%。
2.3 处方工艺研究 2.3.1 上药的调整TSH 属于强酸弱碱盐,难溶于水(0.006 55 mg/mL),微溶于乙醇(0.01~0.33 g/mL),并且属于低剂量载药(每粒 0.2 mg,载药量为 0.1%),上药时需考虑到药物收率和上药均匀性。将TSH混悬于水中或溶于乙醇进行上药损失都较大。将 TSH超声溶解在 50%(质量分数)的乙醇溶液中,并且 TSH与粘合剂 HPMC 的比例为1∶1,上药液含固量为 0.64%,整个上药耗时 60 min,可以达到上药的均匀性以及较好的收率。
2.3.2 缓释层包衣配方组成对体外释放度的影响以 8%和10% EUDRAGIT® NE 30 D包衣TSH微丸,考察对体外释放度的影响,结果见图 1A。仅使用 EUDRAGIT® NE 30 D 可以提供药物缓释表现,并且其用量越多缓释越明显,但调整有局限性,2 h后释放过于缓慢,不符合国家标准[6]的要求。

|
图 1 EUDRAGIT® NE 30 D包衣(A)及EUDRAGIT® NE 30 D、EUDRAGIT® L 30 D-55和 Methocel® E3 组合包衣(B)对盐酸坦索罗辛微丸的控释表现 Fig 1 Influence of EUDRAGIT® NE 30 D coating (A) and combined coating with EUDRAGIT® NE 30 D, EUDRAGIT® L 30 D-55 and Methocel® E3 (B) on release profile of tamsulosin hydrochloride pellets a:HPMC percentage in dry polymers/L 30 D-55 percentage in dry polymers/weight gain of total dry polymers.HPMC:Hydroxypropyl methyl cellulose. n=3, x±s |
考虑仅使用 EUDRAGIT®NE 30 D 包衣调整释放的局限性,配以 pH 依赖型肠溶树脂(EUDRAGIT® L 30 D-55)和水溶性的低粘度HPMC (Methocel® E3)组合包衣,进一步考察对体外释放度的影响,结果见图 1B。同等聚合物增重(10%)下,添加 HPMC和 L 30 D-55 可以改善仅用 NE 30 D时2 h后释放缓慢的局限性,并且 HPMC 加快释放的作用 2 h时已开始体现,而 L 30 D-55 主要提高药物在 pH 7.2磷酸盐缓冲液中的释放。
调整 EUDRAGIT® NE 30 D、EUDRAGIT® L 30 D-55和 Methocel® E3组合配方中比例和总聚合物包衣增重,考察这些因素对 TSH微丸体外释放度的影响,结果见图 2。TSH 微丸体外释放明显受到缓释层包衣配方中3种聚合物比例和总聚合物包衣用量的影响,随 HPMC比例和 L 30 D-55比例提高,TSH微丸释放会加快;随总聚合物包衣用量增多,TSH 微丸释放会变慢。

|
图 2 缓释层组合配比和聚合物增重对盐酸坦索罗辛微丸释放的影响 Fig 2 Influence of composing percentage of sustained-release coating and weight gain of total dry polymers on release profile of tamsulosin hydrochloride pellets a:HPMC percentage in dry polymers/L 30 D-55 percentage in dry polymers/weight gain of total dry polymers.HPMC:Hydroxypropyl methyl cellulose. n=3, x±s |
前期的初步预试验表明,组方中 HPMC在聚合物中的百分比、L 30 D-55 干聚物在聚合物中的百分比和聚合物增重是影响小丸释放度的3个非线性影响因素,采用 Box-Behnken 三因素三水平实验设计,见表 1。进行了 15 次实验, 以小丸在 2、3和 5 h的累积释放度作为响应值Y1、Y2和Y3考察, 结果见表 2。 通过 Design Expert 8.0软件,选择合适的模型,构建响应面, 以国家标准[6]中缓释胶囊微丸的累积释放要求:2 h释放在 12%~39%、3 h释放在 44%~70%和 5 h 释放>70%为优化的范围,取中间点作为目标值,在软件中进行数据和图像优化,根据 desirability 值预测最接近释放要求的配方组合。结果表明:包衣小丸的释放主要由包衣聚合物的增重主导,但可以通过在衣膜中添加其他添加物来控制衣膜的渗透性,添加物的性质对改变衣膜的渗透性起着重要作用,如添加肠溶聚合物 L 30 D-55 可获得 pH 依赖性的渗透改变,优化结果选用 desirability最大值为 0.972的 A(HPMC)2.0%、B(L 30 D-55)7.0%和 C(聚合物增重)12.0%作为最佳的配方组合,软件中给出的其预测累积释放:2 h 为26.1%、3 h 为 57.0%和 5 h为 84.9%,接近市售制剂(Harnal®)缓释胶囊微丸的实测平均释放。
|
|
表 1 Box-Behnken 三因素三水平设计变量表 Tab 1 Three factor, three-level Box-Behnken design of the three nonlinear factors |
|
|
表 2 设计试验运行和响应值 Tab 2 Experimental runs and responses of Box-Behnken design |
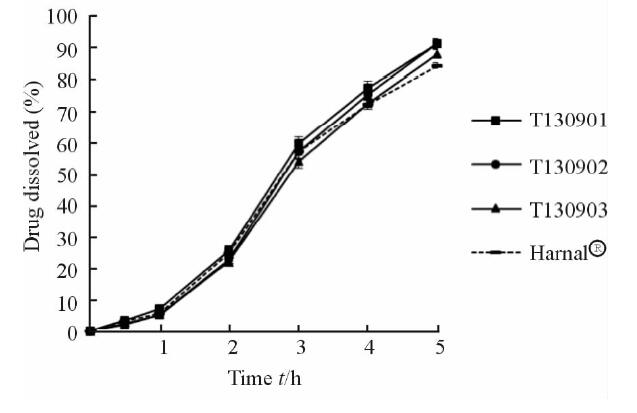
根据 Box-Behnken 试验设计模型得到的优化配方,选择缓释层包衣配方: 包衣聚合物增重为12%,其中以干聚物计,L 30 D-55 添加量占总干聚物的 7%,HPMC 添加量为干聚物的 2%。按2.1项下的方法连续制备 3批 TSH 缓释微丸,按2.2项下方法测定其体外释放度,结果见表 3和图 3。结果表明,工艺过程顺利,重现性好,3 批自制 TSH 缓释微丸体外释放度批间差异小,符合国家标准[6]规定,并且实测值与预测值接近。另采用相似因子f2法,与市售制剂(Harnal®)小丸作体外释放相似性比较。计算f2因子,其值在50~100之间,其值越接近100,两种制剂的体外释放行为相似性越高[8]。结果表明,3批自制样品与市售制剂(Harnal®)缓释胶囊微丸体外释放行为具有良好的相似性(f2分别为71、73 和 80)。
|
|
表 3 3批优化处方样品的实测释放度结果 Tab 3 Responses of 3 batches of the optimized formulation samples |
|
图 3 盐酸坦索罗辛缓释小丸的体外释放表现 Fig 3 In vitro release of tamsulosin hydrochloride sustained-release pellets n=6, x±s |
应用零级、一级、Higuchi 和 Ritger-Peppas 动力学方程对释放度(Q)和时间(t)在 SPSS软件中进行拟合,得到的释放动力学方程分别为Q=0.209t-0.119(R2=0.982)、ln(1-Q)=0.797t-3.553(R2=0.891)、Q=0.611t1/2-0.505 (R2=0.956)、Q=0.115t1.307(R2=0.975)。结果表明,自制缓释小丸较符合零级释放模型。
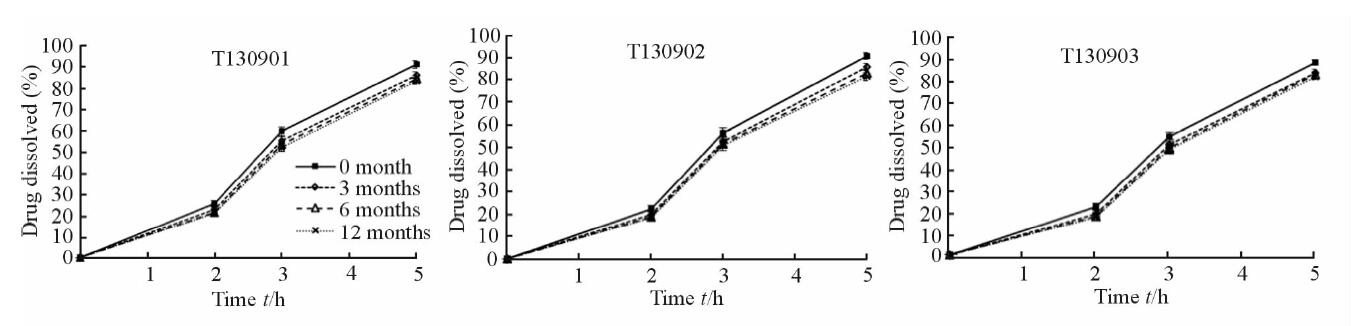
2.3.6 自制TSH缓释微丸的稳定性研究取3批合格的自制 TSH 缓释微丸,装入 PE 袋,密封贮存于 25℃、相对湿度 60%条件下,进行 12 个月的长期稳定性考察,结果见图 4。3 批自制 TSH 缓释微丸在上述贮存条件下,3 个月时释放度略有下降,但之后3~6个月释放度基本不再变化,始终符合国家标准[6]中释放度要求,因此在上述贮存条件下具备良好的长期稳定性。
|
图 4 3批自制盐酸坦索罗辛缓释微丸稳定性考察中释放表现 Fig 4 Release profile in stability test of tamsulosin hydrochloride sustained-release pellets of three batches of pellets n=6, x±s |
制备TSH缓释制剂通常都采用缓释和肠溶两重功能控制来达到理想的药物释放,如制备载药缓释层后再包衣肠溶层,如TSH含药素丸包缓释和肠溶双重衣,如采用EUDRAGIT® L 30 D-55制备肠溶骨架微丸等[9]。这些设计通常采用挤出滚圆、离心造粒包衣、流化床包衣等工艺方法来实现,工序较繁琐,设备要求高,重现性不佳。本研究借鉴文献[1]采用乙基纤维素水分散体结合羟丙甲纤维素邻苯二甲酸酯(HPMCP)和HPMC进行缓释包衣控释TSH,则采用EUDRAGIT® NE 30 D、EUDRAGIT® L 30 D-55和HPMC组合的单层包衣来制备TSH缓释微丸。EUDRAGIT® NE 30 D 为中性的非离子型甲基丙烯酸酯类,pH非依赖性控释材料,因其所有的羧基均被酯化,无反应功能团,药物释放主要由包衣厚度控制[10]。因此缓释层以EUDRAGIT® NE 30 D为缓释主控聚合物,肠溶丙烯酸树脂EUDRAGIT® L 30 D-55和水溶性聚合物HPMC为释放调节剂,协同控释。采用流化床完成空白糖丸载药和缓释包衣两步工艺,相比挤出滚圆、离心造粒等工艺,设备要求简单,操作可控,易于实现工业化生产。
本研究采用 Box-Behnken试验设计筛选配方,是一种比较经济和安全的试验设计[11]。通过软件选择合适的模型,构建响应面,了解不同因素对不同点释放度影响的大小并预测出最佳配方,然后通过实验进一步验证,大大节约了配方筛选的时间和成本。
本研究制剂为膜控释放,膜愈合后药物释放才能稳定和具备良好的贮存稳定性。根据EUDRAGIT® NE 30 D膜推荐的愈合条件(40℃,24 h)[10],以茶碱为模型药物考察本研究膜控组合的愈合条件。设定40℃、45℃、50℃和60℃下分别愈合8、16和24 h,以体外释放度作为考察指标,测定茶碱缓释微丸长期贮存过程中的释放稳定性,结果最佳的愈合条件为45℃、24 h。将此愈合条件用于自制 TSH 缓释微丸的包衣后处理,长期稳定性考察结果也验证了此愈合条件的适用性。微丸愈合时需添加0.5%的滑石粉,以免在愈合过程中粘连。
本研究自制 TSH 缓释微丸的体外释放,经过f2因子相似性比较,证实与市售原研制剂一致,但体内数据有待进一步研究。
| [1] | Kim J S, Kim M S, Park H J, Lee S, Park J S, Hwang S J.Statistical optimization of tamsulosin hydrochloride controlled release pellets coated with the blend of HPMCP and HPMC[J].Chem Pharm Bull (Tokyo), 2007, 55:936-939. |
| [2] | 朱彩燕,沈映冰,吕永丰,曾令杰.离心造粒法制备盐酸坦索罗辛缓释微丸胶囊的工艺影响因素及体外释放度考察[J].中国药房,2011,22:1196-1199. |
| [3] | 李昌其,杨继斌,石森林,刁和芳.盐酸坦索罗辛缓释微丸胶囊的制备及处方工艺考察[J].上海医药,2012,33:45-48. |
| [4] | 杨颖,伍良涌,谭文非.盐酸坦索罗辛缓释片含量和释放度测定方法研究[J].今日药学,2013,23:26-29. |
| [5] | 邢小敏,梁超峰,吴淳,潘碧妍,侯雪英, 谢智勇.LC-MS/MS法测定坦索罗辛在比格犬血浆中的浓度及其缓释制剂的药动学研究[J].中国临床药理学与治疗学,2011,16:884-889. |
| [6] | 国家食品药品监督管理局.国家药品标准.WS1-(X-333)-2003Z.盐酸坦索罗辛缓释胶囊[S/OL].[2016-3-20].http://zy.yaozh.com/biaozhun/xyzzx45/yansuantansuoluoxinhuanshijiaonang.pdf |
| [7] | 国家药典委员会. 中华人民共和国药典[S].二部.北京:中国医药科技出版社,2010:附录ⅩC. |
| [8] | 韩海岭,柴佩华,丁宇,王建新.EUDRAGIT® NM 30 D在双氯芬酸钠缓释骨架片中的应用[J].华西药学杂志,2008,23:399-401. |
| [9] | 北京科信必成医药科技发展有限公司.一种坦索罗辛缓释微丸制剂及其制备方法:中国,CN103315962[P].2013-09-25. |
| [10] | Petereit H.平其能,张灿,译.尤特奇® 应用技术指南[M].北京:化学工业出版社,2009:63-72. |
| [11] | 赖琼,刘芸.Box-Behnken效应面法优化烟酸缓释微丸处方[J].中南药学,2014,12:219-222. |
 2016, Vol. 37
2016, Vol. 37


