糖尿病已经成为继肿瘤、心血管疾病之后的第三大严重威胁人类健康的慢性疾病,糖尿病合并血管病变出现心肌梗死、脑卒中和下肢动脉硬化等是糖尿病患者致死、致残的主要原因之一。动脉粥样硬化(atherosclerosis,AS)作为糖尿病大血管病变的基本病变,是多种因素共同诱导的慢性炎性疾病,血管内皮功能异常及促进AS发生和发展的确切机制一直是研究热点;损伤的内皮细胞可分泌多种炎症因子,促炎症反应发生,引发或加重AS的发生和恶化[1]。Janus蛋白酪氨酸激酶2/信号转导子和转录激活子3(Janus kinase 2/signal transducer and activator of transcription 3, JAK2/STAT3)信号通路是一条多种细胞因子共同的信号转导途径,参与机体多种组织器官的细胞增殖、纤维化、免疫功能改变等过程[2,3,4],其通过启动一系列炎性介质基因转录及蛋白表达的变化,形成炎症反应瀑布效应,被认为是机体炎症反应启动的“总开关”。本研究应用JAK2 特异性抑制剂AG490(40 μmol/L)阻断人脐静脉内皮细胞株(human umbilical vein endothelial cell, HUVEC)中JAK2/STAT3信号通路,观察细胞JAK2、STAT3、磷酸化STAT3 (p-STAT3)的表达变化,旨在探讨JAK2/STAT3信号通路在糖尿病大血管病变中的作用,为进一步探讨糖尿病AS的形成机制提供线索。
1 材料和方法 1.1 研究对象选择2014年11月至2015年6月我院门诊的健康志愿者(NC组)30例,所有人员身体健康状况良好,并排除糖尿病、高血压、冠心病及肾病等内分泌代谢性疾病病史,均无糖尿病家族史。同期收集我院内分泌科住院的2型糖尿病患者共60例,其中无糖尿病大血管并发症者(DM组)30例,有糖尿病大血管并发症者(DV组)30例;均符合1999年WHO糖尿病诊断与分型标准,所有患者排除:(1) 1型及继发性糖尿病;(2)糖尿病微血管病变,如糖尿病视网膜病变、糖尿病慢性肾脏疾病;(3)急性感染性疾病;(4)心、肝、肾功能不良;(5)近3个月发生糖尿病急性并发症及感染;(6)妊娠、哺乳;(7)其他结缔组织病和自身免疫性疾病;(8)肿瘤、哮喘;(9)使用糖皮质激素、非类固醇类等对研究有影响的药物。大血管病变诊断至少符合以下任1条标准:经动脉多普勒检查发现颈动脉及或双下肢动脉血管壁动脉硬化斑块、血栓形成或动脉广泛不规则狭窄者;曾有心绞痛或心肌梗死病史;经动态心电图、超声心动图或经冠脉造影诊断为冠心病者;有脑血管意外病史,脑部CT或MRI扫描有缺血病灶者;下肢缺血性病变临床表现(间歇性跛行、缺血性疼痛)者。各组研究对象组间年龄、性别构成、体质量指数等比较差异无统计学意义。本研究获得患者本人知情同意及遵义医学院附属医院伦理委员会批准。
1.2 血清的制备及灭活采集研究对象晨起空腹静脉血6 mL。并室温静置30 min后,血液不抗凝,1 610×g 低温离心15 min;取上层血清用0.22 μm微孔滤膜过滤除菌,置-80℃冰箱保存备用。
1.3 细胞与试剂HUVEC购自中南大学高等研究中心细胞室,RPMI 1640培养基购自Hyclone公司;胎牛血清购自Gibco公司;AG490购自Selleckchem公司;兔抗人JAK2、STAT3、p-STAT3多克隆抗体购自Cell Signaling公司;ECL试剂盒购自碧云天生物技术研究所;TRIzol、实时定量PCR试剂盒购自宝生物(大连)有限公司;JAK2、STAT3、血管内皮生长因子(VEGF)及其受体1(FLT1)引物购自上海捷瑞生物工程有限公司;JAK2、STAT3、p-STAT3二抗购自Proteintech公司。
1.4 细胞培养及细胞分组处理HUVEC用含体积分数10%胎牛血清+100 U/mL双抗(青霉素+链霉素)的RPMI 1640培养基,37℃、5% CO2孵箱中培养;以0.25%胰酶消化并传代,取对数生长期细胞进行实验。将细胞悬液以5×105/mL的密度接种于6孔板内,取各组研究对象血清(体积分数为10%)孵育细胞24 h,分组如下:NC组、DM组、DV组、DM+AG490组、DV+AG490组。DM+AG490组与DV+AG490组同时加入40 μmol/L AG490进行孵育。孵育结束后收集各组细胞的RNA和蛋白用于后续检测。
1.5 实时定量PCR检测JAK2、STAT3、VEGF和FLT1 mRNA的表达收集各组细胞,TRIzol法提取细胞总RNA后采用实时定量PCR扩增目的基因。PCR引物由上海捷瑞生物工程有限公司合成。β-actin(198 bp)引物序列: 上游5′-GTT GCG TT ACAC CCT TTC TTG AC-3′,下游5′-CTC GGC CAC ATT GTG AAC TTT G-3′;JAK2(141 bp)引物序列:上游5′-ATG TCT TAC CTC TTTG CTC AGT GGC-3′, 下游5′-GGT TTG ATC GTT TTC TTT GGC TAT-3′;STAT3(181 bp)引物序列:上游5′- GCT TCTC CTT CTG GGT CTG GC-3′, 下游5′-CCT CCT TCT TTG CTG CTT TCA CT-3′;VEGF(118 bp)引物序列:上游5′-CCT CAT CCT CTT CCT GCT-3′,下游5′-ACC ACT CAC ACA CAC ACA AC- 3′;FLT1(113 bp)引物序列:上游5′- ATC CTT TCC TTC CAT TTT G -3′,下游5′- ACT TAT TCG TGT CCA TCT TTG- 3′。反应条件:预变性95℃,15 s;变性95℃、15 s,退火60℃、60 s,进行39个循环;延伸72℃,45 s。反应结束后做熔解曲线,验证产物特异性。结果分析采用2-ΔΔCt法,所有样本以β-actin作为内参校正,将对照组各基因相对表达量设为1,实验组的结果均以与对照组的比值表示。
1.6 蛋白质印迹法检测JAK2、STAT3、p-STAT3的蛋白表达提取细胞总蛋白,BCA蛋白测定盒测定蛋白浓度,变性后取各蛋白样品行SDS-PAGE分离,上样量为30 μg;电转至PVDF膜,加入一抗4℃振荡过夜,加入辣根过氧化物酶标记的二抗后37℃振荡1 h,ECL发光试剂盒感光、显影、定影。凝胶图像处理系统分析条带灰度值,以JAK2/β-actin比值和p-STAT3/STAT3比值分别表示JAK2、p-STAT3的蛋白相对表达水平。
1.7 统计学处理采用SPSS 18.0统计软件分析实验结果,数据以x±s表示,组间比较采用单因素方差(ANOVA)分析,两两比较采用SNK-q检验。检验水准(α)为0.05。
2 结 果 2.1 血清来源患者一般资料DM组、DV组患者的病程、空腹血糖、糖化血红蛋白均高于NC组(P<0.05);DV组患者的病程、收缩压、总胆固醇、低密度脂蛋白胆固醇均高于DM组和NC组(P<0.05);而三酰甘油水平低于DM组(P<0.05)。DM组、DV组患者年龄、舒张压、高密度脂蛋白胆固醇、丙氨酸转氨酶、天冬氨酸转氨酶、谷氨酰转肽酶、尿素氮、血肌酐和血尿酸与NC组相比,差异无统计学意义(P>0.05,表 1)。
|
|
表 1 各组患者临床特征的比较 Tab 1 Comparison of clinical characteristics in different groups |
与NC组比较,DM组和DV组HUVEC细胞内JAK2、STAT3的mRNA水平上调(P<0.05),且DV组高于DM组(P<0.05)。DM+AG490组和DV+AG490组JAK2、STAT3的mRNA表达水平分别低于DM组、DV组(P<0.05)。与NC组和DM组相比,DV组VEGF和FLT1 mRNA的表达水平上调(P<0.05);而与DV组相比,DV+AG490组VEGF和FLT1 mRNA的表达水平下调(图 1,P<0.05)。
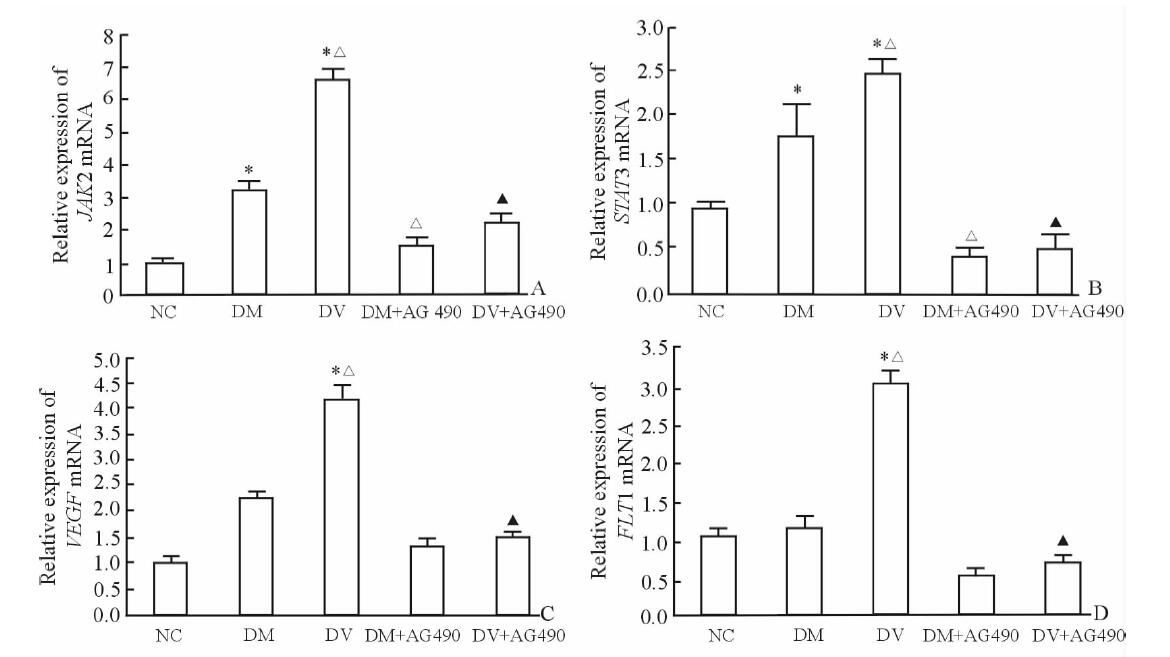
|
图 1 各组HUVEC细胞中JAK2、STAT3、VEGF和FLT1 mRNA表达水平 Fig 1 Expression of JAK2, STAT3, VEGF and FLT1 mRNA in human umbilical vein endothelial cells (HUVEC) of each group JAK2: Janus kinase 2; STAT3: Signal transducer and activator of transcription 3; VEGF: Vascular endothelial growth factor; FLT1: Vascular endothelial growth factor receptor 1; NC: Normal control; DM: Type 2 diabetes mellitus without macrovascular complications; DV: Type 2 diabetes mellitus with macrovascular complications; AG490: Janus kinase 2 inhibitor. *P<0.05 vs NC group; △P<0.05 vs DM group; ▲P<0.05 vs DV group. n=30,x±s |
与NC组比较,DM组和DV组HUVEC细胞内JAK2、p-STAT3的蛋白表达水平上调(P<0.05),且DV组高于DM组(P<0.05)。同时,DM+AG490组和DV+AG490组JAK2、p-STAT3的蛋白表达水平分别低于DM组、DV组,且DM+AG490组p-STAT3蛋白水平低于DV+AG490组(P<0.05,图 2)。
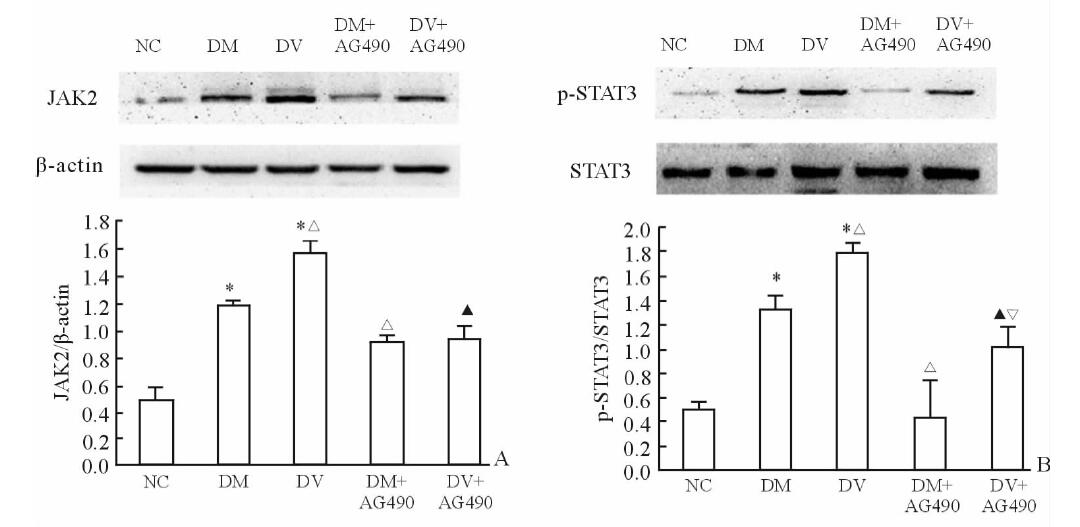
|
图 2 各组HUVEC细胞中JAK2、STAT3和磷酸化STAT3蛋白的表达水平 Fig 2 Protein level of JAK2, STAT3 and phosphorylation STAT3 in human umbilical vein endothelial cells (HUVEC) of each group *P<0.05 vs NC group; △P<0.05 vs DM group; ▲P<0.05 vs DV group;▽ P<0.05 vs DM+AG490 group.n=30,x±s |
糖尿病大血管病变是糖尿病患者严重的并发症之一,影响着患者的生存和生活质量。AS是糖尿病大血管病变的基本病变,2001年美国心脏病学会提出糖尿病动脉硬化(diabetic atherosclerosis,DAS)的5个病因,即代谢因素、高糖氧化、内皮功能紊乱、炎症和血栓前状态[5]。大量临床及实验室研究结果表明,糖尿病患者大血管病变危险性增高的主要原因与血管内皮细胞功能受损有关[6,7],且内皮细胞损伤所致的炎症是AS发生的重要始发因素[8 ,9],但触发和维持炎症反应的因素至今尚未完全阐明。
JAK/STAT途径是肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白介素6(interleukin-6, IL-6)等介导炎症反应共有的细胞内信号通路[3],能介导多种细胞因子和生长因子的细胞内信号转导并转录相应的靶基因,从而发挥其生物学效应。JAK2/STAT3通路激活后,STAT3发生磷酸化并形成同源或异源二聚体,转位至细胞核,与DNA上的特定调节序列结合,诱导相应基因的表达[10]。JAK2 特异性抑制剂AG490能够特异性抑制JAK2的酪氨酸磷酸化[11],有效地阻断其下游STAT3的活化,从而阻断该信号通路的传递。
近年来研究发现,JAK/STAT信号通路参与糖尿病微血管病变过程。高糖环境可使肾小球系膜细胞活性氧簇产生增加,导致纤连蛋白和胶原、转化生长因子-β表达增多,进而激活JAK/STAT信号通路,引起肾小球系膜细胞增殖、细胞外基质积聚,参与糖尿病肾病的调控,与肾病中的系膜细胞、肾小球血管内皮细胞、足突细胞、肾小管上皮细胞等的病理变化密切相关[12,13]。AS的发展与血管内皮细胞、单核细胞、平滑肌细胞等的异常和损伤密切相关。本课题组前期研究发现,2型糖尿病患者体内存在单核细胞功能紊乱,从而导致了2型糖尿病及其并发症的发生和发展,其作用机制可能与STAT5信号通路的激活有关,激活的p-STAT5信号通路参与并放大了AS炎症免疫反应,这也可能是糖尿病患者易患冠心病等AS疾病的重要原因之一[14]。此外,在AS发生、发展等各个过程中,JAK2/STAT3信号通路是血管平滑肌细胞增殖过程从膜到核的信号通路之一[15,16,17]。但在糖尿病大血管病变过程中,JAK2/STAT3通路在血管内皮细胞中是否被激活以及是否参与了AS的过程目前少有报道。
本研究发现,DM组和DV组HUVEC细胞中JAK2 mRNA、STAT3 mRNA和JAK2蛋白、p-STAT3蛋白表达较NC组增加,且DV组高于DM组,表明DM和DV组JAK2/STAT3信号通路被激活。此外,研究发现VEGF表达与JAK/STAT途径的激活有关,STAT3是VEGF基因直接的转录激活子[18,19]。VEGF是一种特异作用于血管内皮细胞的细胞因子,具有增加微血管通透性,促进血管内皮细胞增殖等作用。本实验中与AS相关的VEGF和FLT1基因表达比对照组明显增高,且与JAK2/STAT3水平变化相一致。为进一步证明JAK2/STAT3信号通路活化参与AS血管内皮病变,本实验使用JAK/STAT信号通路阻断剂AG490阻断JAK2磷酸化及下游STAT3的活化。AG490干预后,JAK2、STAT3的mRNA和蛋白水平明显下调,且VEGF和FLT1的mRNA表达水平也明显下调。此外,本研究发现DM组与DV组的空腹血糖、糖化血红蛋白均高于NC组,由此可推断JAK2/STAT3信号通路参与糖尿病大血管病变的发病机制可能与其参加糖尿病微血管病变相同,皆由高糖诱导细胞因子表达,进而激活JAK2/STAT3信号通路表达炎性因子,引起细胞损伤,从而参与血管病变发生。Manea等[20]研究也表明高糖能够激活血管内皮JAK/STAT通路介导内皮素-1的合成,导致内皮细胞功能障碍。
| [1] | Bessueille L, Magne D. Inflammation:a culprit for vascular calcification in atherosclerosis and diabetes[J]. Cell Mol Life Sci, 2015, 72:2475-2489. |
| [2] | Seavey M M, Dobrzanski P. The many faces of Janus kinase[J]. Biochemi Pharmacol, 2012, 83:1136-1145. |
| [3] | O'Shea J J, Plenge R. JAK and STAT signaling molecules in immunoregulation and immune-mediated disease[J]. Immunity, 2012, 36:542-550. |
| [4] | Matsui F, Meldrum K K.The role of the Janus kinase family/signal transducer and activator of transcription signaling pathway in fibrotic renal disease[J]. J Surg Res, 2012, 178:339-345. |
| [5] | Grundy S M,Howard B, Smith S Jr, Eckel R, Redberg R, Bonow R O. Prevention conference Ⅵ:diabetes and cardiovascular disease:executive summary:conference proceding for healthcare professionals from a special writing group of the American Heart Association[J].Circulation, 2002, 105:2231-2239. |
| [6] | Liao Y F, Feng Y, Chen L L, Zeng T S, Yu F, Hu L J. Coronary heart disease risk equivalence in diabetes and arterial diseases characterized by endothelial function and endothelial progenitor cell[J]. J Diabetes Complicat, 2014, 28:214-218. |
| [7] | Kawano N, Emoto M, Mori K, Yamazaki Y, Urata H, Tsuchikura S, et a1.Association of endothelial and vascular smooth muscle dysfunction with cardiovascular risk factors, vascular complications, and subclinical carotid atherosclerosis in type 2 diabetic patients[J]. J Atheroscler Thromb, 2012, 19:276-284. |
| [8] | Gilbert R E. Endothelial loss and repair in the vascular complications of diabetes:pathogenetic mechanisms and therapeutic implications[J]. Circ J, 2013, 77:849-856. |
| [9] | Horio E, Kadomatsu T, Miyata K, Arai Y, Hosokawa K, Doi Y, et al. Role of endothelial cell-derived angptl2 in vascular inflammation leading to endothelial dysfunction and atherosclerosis progression[J]. Arterioscler Thromb Vasc Biol, 2014, 34:790-800. |
| [10] | Raible D J, Frey L C, Brooks-Kayal A R. Effects of JAK2-STAT3 signaling after cerebral insults[J]. Jak-Stat, 2014, 3:e29510. |
| [11] | Park J S, Lee J, Lim M A, Kim E K, Kim S M, Ryu J G, et al. JAK2-STAT3 blockade by AG490 suppresses autoimmune arthritis in mice via reciprocal regulation of regulatory T cells and Th17 cells[J]. J Immunol, 2014, 192:4417-4424. |
| [12] | Brosius F C 3rd, He J C. JAK inhibition and progressive kidney disease[J]. Curr Opin Nephrol Hypertens, 2015, 24:88-95. |
| [13] | Hu J, Fan X, Meng X, Wang Y, Liang Q, Luo G. Evidence for the involvement of JAK/STAT/SOCS pathway in the mechanism of Tangshen formula-treated diabetic nephropathy[J]. Planta Med, 2014, 80(8/9):614-621. |
| [14] | 杨孟雪,甘华,沈清,汤为学.2型糖尿病患者CD14+CD16+单核细胞的水平及其对LPS和IL-15刺激的反应[J].中国病理生理杂志,2012,28:136-141. |
| [15] | Chen D, Liu J, Rui B, Gao M, Zhao N, Sun S, et al. GSTpi protects against angiotensin Ⅱ-induced proliferation and migration of vascular smooth muscle cells by preventing signal transducer and activator of transcription 3 activation[J]. Biochim Biophys Acta, 2014, 1843:454-463. |
| [16] | Li F, Xia K, Sheikh M S, Cheng J, Li C, Yang T. Retinol binding protein 4 promotes hyperinsulinism-induced proliferation of rat aortic smooth muscle cells[J]. Mol Med Rep, 2014, 9:1634-1640. |
| [17] | Lim S, Park S. Role of vascular smooth muscle cell in the inflammation of atherosclerosis[J]. BMB Rep, 2014, 47:1-7. |
| [18] | Gurbuz V, Konac E, Varol N, Yilmaz A, Gurocak S, Menevse S, et al. Effects of AG490 and S3I-201 on regulation of the JAK/STAT3 signaling pathway in relation to angiogenesis in TRAIL-resistant prostate cancer cells in vitro[J]. Oncol Lett, 2014, 7:755-763. |
| [19] | Carbajo-Pescador S, Ordoñez R, Benet M, Jover R, García-Palomo A, Mauriz J L, et al. Inhibition of VEGF expression through blockade of HIF1α and STAT3 signalling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells[J]. Br J Cancer, 2013, 109:83-91. |
| [20] | Manea S A, Manea A, Heltianu C. Inhibition of JAK/STAT signaling pathway prevents high-glucose-induced increase in endothelin-1 synthesis in human endothelial cells[J]. Cell Tissue Res, 2010, 340:71-79. |
 2016, Vol. 37
2016, Vol. 37


