长段食管切除术后最常使用胃来代替食管重建消化道,但当胃不可以使用时,结肠通常是作为食管替代物的最好选择。结肠代食管术(esophageal replacement with colon, ERC)解决了因胃不能再使用而需要行上消化道重建的问题。由于ERC吻合口为3个或以上,且操作复杂、创伤大、并发症发生率高[1],因此未被医学界广泛接受。本文回顾性分析了近3年间在第二军医大学长海医院胸心外科行ERC的20例患者资料,以探讨ERC的手术操作技巧和经验。
1 材料和方法 1.1 一般资料2011年3月至2014年3月在第二军医大学长海医院行ERC的患者20例,其中男性18例,女性2例;年龄46~70岁,中位年龄62岁;食管上段癌1例,食管胃双源癌6例,胃大部切除后食管癌8例,食管癌术后残胃癌3例,食管癌术后吻合口复发2例;手术时间为4.5~7 h,中位时间5.65 h;住院时间为15~58 d,中位住院时间18 d;所有患者术前均未行胸腹部放疗,4例患者术前行辅助化疗2个疗程。
1.2 围手术期准备 1.2.1 术前评估术前详细评估心肺功能,同时行常规胸部和上腹部增强CT及颈部、腹部超声检查,以了解肿瘤外侵情况并排除并发其他脏器病变可能,评估肿瘤可否完全切除。术前1 d行常规结肠镜检查,以排除结肠肿瘤或其他结肠病变[2];对于有严重动脉血管硬化病史及腹部手术史不明确的患者,术前行肠系膜上、下动脉血管造影,以了解结肠血管情况。
1.2.2 肠道准备因常规行结肠镜检查,术前2 d行肠道准备,口服硫酸镁及清洁灌肠2次,标准为拉出清水样便;术前1 d肠镜检查后可进食清流质,术晨清洁灌肠1次。术中观察此肠道准备方法清洁可靠。
1.3 手术方法 1.3.1 手术入路手术采用右进胸方式,3例行右胸、腹正中两切口食管-结肠胸内机械吻合方法,17例行右胸、腹正中及左颈部吻合。13例在胸腔镜辅助下完成胸腔内操作。
1.3.2 胸内操作主要采用胸腔镜辅助食管床肿瘤组织的整块切除及纵隔淋巴结的清扫。胸腔镜辅助下食管切除操作仅限于后纵隔区域,对肺脏几乎无牵拉损伤,术后因肺挫伤导致肺功能不全机会相对减少;胸腔镜手术特殊的前倾俯卧位体位[3]有利于食管床的显露,充分游离食管后,牵拉食管,可清晰显露左侧支气管、主动脉弓及双侧喉返神经,术中清扫双侧喉返神经旁淋巴结时(图 1),不主动暴露游离左、右侧喉返神经,避免损伤,清扫淋巴结主要依靠腔镜分离钳及剪刀进行顿锐结合方式的冷分离,避免使用电凝及超声刀,除非已经清晰显露喉返神经,并有足够距离确保无热传导造成的神经损伤;对于既往已经行食管癌手术的患者,胸腔镜的辅助更有利于胸腔粘连的松解。
1.3.3 腹腔操作关键在于间置结肠段的游离和血管弓的选择。首先切断肝结肠韧带,游离大网膜及胃结肠韧带至结肠脾曲,根据移植肠管的长度决定是否进一步游离降结肠。然后选择移植结肠段供血血管,首选结肠左动脉升支,次选结肠中动脉[4],在结扎离断中动脉之前,使用血管夹在中动脉分叉前血管主干上夹闭约15 min,并肠钳夹闭结肠肝曲,阻断右结肠动脉供血,观察结肠段边缘血管是否可触及或观察到搏动,肠管颜色是否改变。测量结肠长度以结肠系膜血管弓的长度为准,最好比预计长2~3 cm。
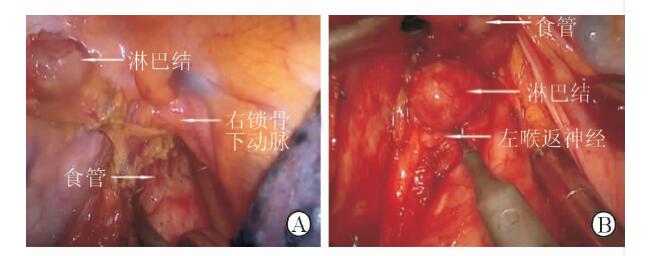
|
图 1 右喉返神经旁淋巴结(A)和左喉返神经旁淋巴结(B) |
颈部切口采用经左侧胸锁乳突肌前缘向下延伸经胸骨正中至第一肋间水平,沿胸骨及第一肋骨和锁骨向左侧分离,显露胸锁关节及第一胸肋关节,电锯正中劈开胸骨柄,经第一肋间向左侧横断,保护乳内血管,分离胸骨后组织,线锯离断锁骨头及第一肋骨头,切除左半胸骨柄及左侧胸锁关节及第一胸肋关节,充分暴露前上纵隔区(图 2)。

|
图 2 颈部切口 A:切除的左半胸骨柄(箭头);B:显露的前上纵隔(箭头) |
本组17例行颈部吻合均采用胸骨后径路上提结肠。此径路难点在于胸骨柄后方的致密组织及胸廓入口区造成的狭窄,切除左半胸骨柄的切口正好解决了此问题。经剑突下与颈部会师后,使用盐纱充分拓宽胸骨后间隙,保持通道宽度达到6 cm以上。
1.3.6 消化道重建(1)结肠食管吻合:本组15例颈部吻合患者采用食管-结肠端侧机械吻合,闭合器闭合结肠残端(图 3A),此吻合方法建立于间置结肠段有足够的长度;2例颈部吻合患者采用食管-结肠端端全层内翻手工吻合(图 3B);3例胸内吻合患者采用食管-结肠端侧机械吻合。吻合过程中确保结肠无扭曲,结肠近端可见小动脉出血。(2)结肠-胃或空肠吻合:12例行结肠-胃吻合; 6例因患者行全胃切除或远端胃切除(毕Ⅰ)后腹腔胃体较小,结肠胃吻合困难及吻合后可能导致下段结肠成角造成梗阻,行结肠-空肠Roux-en-Y吻合;2例胃大部切除后患者保留了原有胃空肠吻合而直接行结肠-远端空肠的端侧吻合。(3)结肠-结肠吻合:使用29号圆形吻合器行端侧吻合,闭合器闭合结肠残端。腹腔所有吻合口均可采用吻合器机械吻合,吻合口采用4-0可吸收缝线间断全层缝合加固。
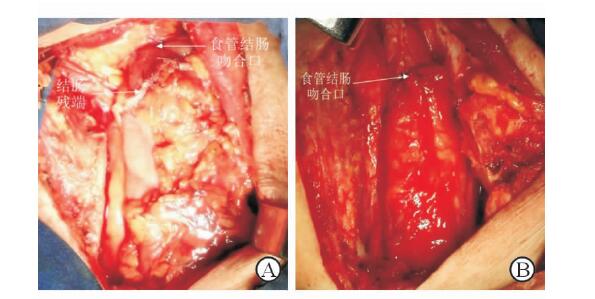
|
图 3 食管-结肠端侧机械吻合(A)与端端手工吻合(B) |
本组20例患者,3例胸内吻合,无吻合口瘘发生。17例颈部吻合,其中13例采用胸腔镜辅助经右胸食管或胸腔胃切除,颈部采用切除左半胸骨柄、左侧胸锁关节及左侧第一胸肋关节的切口,结肠上提径路均采用胸骨后通道。2例间置结肠由结肠中动脉供血,均为胸内吻合患者,1例结肠逆蠕动;18例结肠左动脉升支供血,间置结肠顺蠕动。所有患者围术期无死亡,总并发症发生率为35%(7/20),其中颈部吻合口瘘2例次,腹腔肠瘘2例次,肠梗阻2例次,声音嘶哑5例次,肺部感染5例次,共发生于7例患者;其中1例吻合口瘘伴吻合口区结肠前壁局部缺血坏死,累及长度约1.5 cm,给予充分引流后,经结肠坏死破口置入32号硅胶管横跨吻合口上下方起支撑作用(图 4A),保证食管与结肠连接通道通畅,硅胶管缝线固定于颈部皮肤防滑脱(图 4B),最终结肠、食管与颈前皮下组织瘢痕愈合,经口取出硅胶管后,患者可正常进食;远期患者出现吻合口狭窄,内镜下扩张后好转。全组无间置结肠全段缺血坏死病例。随访1~4年,死亡1例,肿瘤远处转移2例。
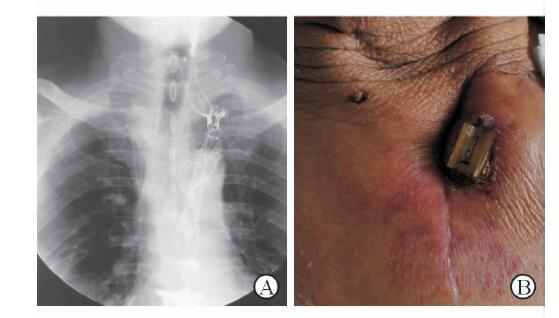
|
图 4 结肠腔内硅胶管(A)和硅胶管皮肤外固定线(B) |
结肠代食管较其他脏器代食管可获得更好的食物满意度及生活质量[5],但因其大创伤及高并发症率,加上管状胃的应用推广,ERC未被外科医生广泛接受,但对于不能行胃代食管的患者,ERC又是最佳的选择。近年较多的学者在如何减少ERC的并发症上不断地总结经验和改进手术技术,手术成功的例数逐渐增加。
微创食管切除具有出血量少、ICU住院天数短、住院时间短、总体并发症少等优点[6,7],目前已经逐渐成为主流的手术方式,而ERC手术波及颈部、胸腔、腹腔,创伤大,操作复杂,微创化为该术式发展的必然趋势[8,9]。目前可以采用单纯胸腔镜或胸腹腔镜联合的方式。本组13例患者单纯选择胸腔镜辅助食管或胸腔残胃的游离切除,腹部操作采用正中开腹。由于行ERC的患者大多都有腹腔的手术史,且腹腔操作复杂,吻合口较多,加之胸外科医生对腹腔镜操作的熟练程度不够,腹腔镜辅助的ERC一直未被开展。
吻合口瘘和结肠缺血坏死是ERC后最为凶险和致命的并发症,降低该并发症发生率的关键在于间置结肠段的血管保护和吻合技术的提高,吻合后确保吻合口无牵拉张力。结肠具有相对固定的供血血管和独特的边缘血管弓[10],临床首选左结肠动脉作为移植结肠段的供血管,这样不仅有利于取得较长的血管弓,而且间置结肠采用脾曲横结肠及部分降结肠作顺蠕动向移植,更符合生理要求,进一步改善吞咽功能。本组18例采用结肠左动脉供血,术中首选此血管,直接阻断结肠中动脉及肝曲的边缘血管,观察拟食管结肠吻合处血管搏动情况,节省了手术时间,并避免了反复钳夹血管造成的血管损伤。只要保证结肠血管弓的完整性及充足的血供,吻合过程中避免损伤结肠末端血管支,食管结肠吻合采用端-端或是端-侧吻合,吻合方式的选择根据间置结肠段的长短及食管肿瘤位置决定。本组18例采用端-侧机械吻合,出现吻合口瘘2例,均为颈部吻合;端端吻合2例,未出现吻合口瘘,由于病例数较少,不能说明端-侧机械吻合比端-端手工吻合的吻合口瘘发生率高。胸内吻合因结肠足够松弛,吻合口无张力,所以瘘的发生率较低。颈部端侧吻合后存在的结肠残端也会增加吻合口区域瘘的可能。
胸骨后径路是行食管结肠颈部吻合最常用的通道,但狭窄的胸廓上口及肥大的胸骨柄往往可造成食管结肠吻合口区域的压迫,造成远端结肠局部缺血导致吻合口瘘或结肠坏死。本组17例患者行颈部吻合,均采用切除左半胸骨柄、左侧胸锁关节及左侧第一胸肋关节的切口。此术式最初由Grunenwald等[11]报道用于切除胸腔顶肿瘤,此后广泛应用于颈胸交界部肿瘤的切除[12],目前部分国外学者在行食管切除间置空肠颈部吻合重建消化道手术中也采用此类型切口[13],我们在借鉴的基础上保留了肋锁韧带及锁骨下肌肉,维持了肩带的稳定,所有患者术后均未出现左上肢运动和功能障碍。切除了胸廓上口左前方的骨性结构,不但避免了组织压迫,而且有利于吻合的操作及胸骨后通道的建立。在出现颈部吻合口瘘或吻合区局部结肠坏死的情况下,去除吻合口前方的骨性结构,有利于充分引流,防止出现严重的纵隔感染;皮下组织更容易与结肠上段前壁贴合,有利于瘘口的愈合。
虽然ERC操作复杂、创伤大、并发症高,但对于需要行长段食管重建而不能使用胃代食管的患者,ERC仍是较好的选择;胸腔镜辅助胸腔操作可减少手术创伤;切除左半胸骨柄、左侧胸锁关节及左侧第一胸肋关节的颈部切口有利于胸骨后通道的建立,可减少颈部吻合口瘘的发生,并有利于瘘的愈合。
| [1] | Davis P A, Law S, Wong J. Colonic interposition after esophagectomy for cancer[J]. Arch Surg, 2003, 138:303-308. |
| [2] | Motoyama S, Kitamura M, Saito R, Maruyama K, Sato Y, Hayashi K, et al. Surgical outcome of colon interposition by the posterior mediastinal route for thoracic esophageal cancer[J]. Ann Thorac Surg, 2007, 83:1273-1278. |
| [3] | Shen Y, Feng M, Tan L, Wang H, Li J, Xi Y, et al. Thoracoscopic esophagectomy in prone versus decubitus position:ergonomic evaluation from a randomized and controlled study[J]. Ann Thorac Surg, 2014, 98:1072-1078. |
| [4] | 程邦昌,肖永光.结肠代食管术临床实践[J].中华胸心血管外科杂志,2011,27:131-135. |
| [5] | Greene C L, DeMeester S R, Augustin F, Worrell S G, Oh D S, Hagen J A, et al. Long-term quality of life and alimentary satisfaction after esophagectomy with colon interposition[J]. Ann Thorac Surg, 2014, 98:1713-1720. |
| [6] | Nagpal K, Ahmed K, Vats A, Yakoub D, James D, Ashrafian H, et al. Is minimally invasive surgery beneficial in the management of esophageal cancer A meta-analysis[J]. Surg Endosc, 2010, 24:1621-1629. |
| [7] | Dantoc M M, Cox M R, Esliek G D. Does minimally invasive esophagectomy(MIE) provide for comparable oncologic outcomes to open techniques A systematic review[J]. J Gastrointest Surg, 2012, 16:486-494. |
| [8] | 汪灏,谭黎杰,李京沛,沈亚星,张毅,冯明祥,等.胸腔镜食管癌根治术的安全性评价[J].中华胃肠外科杂志,2012,15:926-929. |
| [9] | Pennathur A, Luketich J D. Minimally invasive esophagectomy:short-term outcomes appear comparable to open esophagectomy[J]. Ann Surg, 2012, 255:206-207. |
| [10] | 程邦昌,昌盛,黄杰,毛志福,王志维,鲁世千,等.结肠代食管术中结肠血管结构的研究[J].中华医学杂志,2006,86:1453-1456. |
| [11] | Grunenwald D,Spaggiari L.Transmanubrial osteomuscular sparing approach for apical chest tumors[J]. Ann Thorac Surg, 1997, 63:563-566. |
| [12] | 杨立信,赵铁军,陆超敬,徐志云.劈开胸骨柄绕胸锁关节切口切除颈胸交界部肿瘤[J].中华胸心血管外科杂志,2012,28:106-107. |
| [13] | Blackmon S H, Correa A M, Skoracki R, Chevray P M, Kim M P, Mehran R J, et al. Supercharged pedicled jejunal interposition for esophageal replacement:a 10-year experience[J]. Ann Thorac Surg, 2012, 94:1104-1113. |
 2016, Vol. 37
2016, Vol. 37


