2. 华北理工大学附属医院中心实验室, 唐山 063000
2. The Central Lab, Affiliated Hospital of North China University of Science and Technology, Tangshan 063000, Hebei, China
石蜡切片是形态学实验的重要组成部分,在制作过程中,由取材、固定至染色、封固,每一步都环环相扣。不同组织器官石蜡切片制作的实验条件不尽相同,脑组织因脂质含量较丰富、细胞排列较紧密等特点,若实验影响因素处理不佳,易出现切片时标本碎裂、展片时组织溶解或免疫染色过程中脱片严重等情况,导致镜下形态结构观察的偏差或失败。而优质的切片是优质染色的前提,是实验结果可靠的保障。经过反复地学习与积累,本研究对重要实验细节进行规范,总结出以下高质量大鼠脑组织连续石蜡切片的制作方法。
1 材料和方法 1.1 实验动物、主要试剂与仪器健康雄性SPF级SD大鼠20只,3个月龄,体质量330~370 g,购自解放军军事医学科学院实验动物中心[许可证号SCXK-(军)2009-003]。饲养室室温20~24℃,相对湿度45%~55%,通风良好,12 h昼夜节律,定期更换垫料并清洗消毒笼具。多聚甲醛(Merck KGaA公司,德国),无水乙醇、二甲苯(天津致远化学试剂有限公司),切片石蜡、EG1150H石蜡包埋机、RM2245轮转式切片机(Leica公司,德国),苏木精-伊红(H-E)染色液(珠海贝索生物技术有限公司),BX61金相研究级正立显微镜(Olympus公司,日本)。
1.2 方法制作方法共分为5步。第一步,取材与固定。采用经心脏插管灌注固定法进行脑组织取材[1]。大鼠称质量,腹腔注射2%戊巴比妥钠(50 mg/kg)麻醉后,仰卧固定于手术台。用水浸湿胸腹部皮毛,剪开表皮,暴露肌层,由胸骨剑突下剪一小口,沿两侧肋弓剪开肌层,打开腹腔,显露肝脏。用血管钳夹持剑突,在膈肌与胸骨柄相连处剪一小口,由此向两侧顺延剪开膈肌至腹壁侧缘,再贴近胸廓侧缘剪断肋骨,将夹持剑突的血管钳上翻,暴露胸腔。纵向剪开心包膜,充分暴露心脏及升主动脉,用眼科剪在左心室底部剪一小口,将与灌流装置相连的灌注针经小口插入至升主动脉,迅速用弯头止血钳固定针体与动脉,后立即在右心耳剪一小孔放血,同时快速滴注肝素生理盐水(肝素质量浓度为40 mg/L),密切观察肝、肺等器官变化,约注入200 mL。待右心耳流出液体呈清亮透明状,换用4%多聚甲醛-磷酸缓冲液快速滴注(灌注速度5~10 mL/min)[2],之后可见大鼠肢体伸展抽搐,渐弱时调节滴速至5 mL/min维持灌注,注入固定剂300~400 mL,整个灌注过程约1 h。断头分离出脑组织,放入盛有4℃ 4%多聚甲醛的标本瓶中,1~2 h后组织适度硬化,行标本修整,以2~3 mm的厚度沿脑冠状面进行切块[3],再继续置于4℃冰箱中固定12~24 h。
第二步,脱水与透明。将组织块需要的切面向下,置于一次性塑料脱水包埋盒中,流水冲洗12~24 h。室温(25℃)下乙醇梯度脱水、二甲苯透明,具体为50%乙醇2 h→60%乙醇2 h→75%乙醇2 h→85%乙醇2 h→95%乙醇Ⅰ1 h→95%乙醇Ⅱ1 h→无水乙醇Ⅰ30 min→无水乙醇Ⅱ30 min→二甲苯Ⅰ10 min→二甲苯Ⅱ10 min。观察透明结果,吸净包埋盒周面液体,转入浸蜡。
第三步,浸蜡与包埋。浸蜡用石蜡Ⅰ Paraplast(熔点56~58℃)、浸蜡温度60℃、时间1 h,石蜡Ⅱ Paraplast High Melt(熔点58~60℃)、浸蜡温度60℃、时间2 h;包埋用石蜡Ⅱ,包埋缸温度65℃。包埋时先向金属包埋模具内注入一定蜡液,再保持切面向下放入组织,注意避免气泡产生。
第四步,切片。室温下切片,12~16 μm修片,修出部分组织后改用4 μm切片,显露出较完整组织切面时切片机厚度计数归零;摊片水温42℃,待组织上蜡褶展平。贴片时玻片倾斜入水,垂直捞起,速度宜慢,有助于沥下水分并减少气泡贴附。待蜡片水分烘干、石蜡部分烤化后,置于60℃烤箱烤片2 h。将切片依序置于切片盒内保存。
第五步,染色与封固。切片后行H-E染色,根据实验需要行免疫组织化学染色,中性树胶封固。
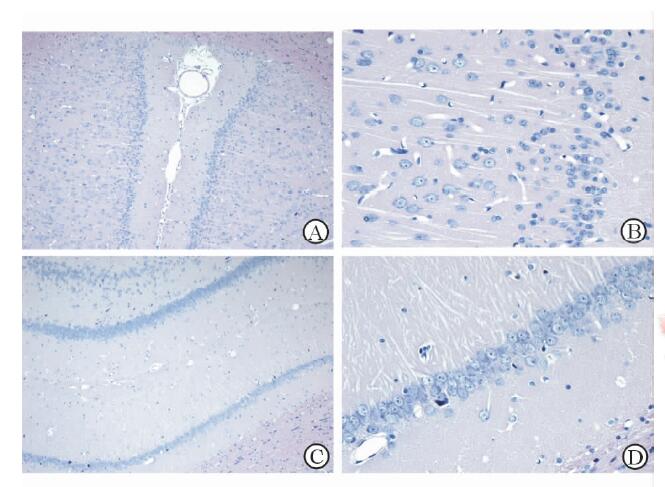
2 结 果灌注固定后打开颅腔,可见脑组织呈乳白色,无充血,离取时发觉组织有韧性,浸泡固定后具有一定硬度。肉眼观察二甲苯透明结果可见组织全部为其填充,通体呈透明状,不带白色混浊样结构。切片结果示由修片转为切片初始,标本表层切得的蜡带入水摊片可见少许边缘组织溶解现象,显露较完整组织切面后,再继续切至第10~20个蜡片(厚度计数40~80 μm)过程中溶解现象逐渐减弱,由厚度计数约80 μm后,组织展片良好,形态均匀完整,可获得较多数量的高质量连续切片。H-E染色(图 1)显示切片质量良好,镜下组织形态结构完整,核质清楚,红蓝分明。免疫组织化学染色过程中亦较少发生脱片现象。
|
图 1 大鼠脑组织石蜡切片结果(H-E染色) A: 大鼠大脑皮质; B: 大鼠压部后颗粒细胞b皮质; C: 大鼠海马; D: 大鼠海马CA1区. Original magnification:×100 (A, C),×400 (B, D) |
大鼠脑组织石蜡切片制作是一系列相互联系的过程,实验时需整体把握关键要点,同时注重推敲细节。现就切片制作过程中的重要实验影响因素进行探讨。
固定是组织制备的关键环节,固定的质量直接关系到最后的形态学效果。脑组织质地柔软,解剖取材较困难且对缺氧敏感,采用全身灌注固定可将生活状态的细胞迅速固定在原位,减少血液循环停止后脑组织因缺氧而引发的细胞自溶。灌注量和灌注压是影响全身灌注过程最重要的两个因素[2],灌注固定时若实验室自制灌流装置,连接装置我们推荐选用一次性使用输血器,因一次性使用输血器管径较大、管路更通畅,更方便调控灌流速度,进而取得良好的固定效果。肝素生理盐水与固定液的注入量据动物体质量而调整。灌注过程中,须密切观察大鼠肝、肺等器官变化,因置入灌注针有可能误穿入肺动脉,此时会出现肺叶的水肿膨胀,由大鼠口鼻可见泡沫状液体流出。肝脏颜色由血红褪至苍黄,同时肺叶未见明显肿胀等观察指标可提示体循环灌注良好。免疫组织化学所要求的标本,在保证组织形态结构完整性的同时,力求小而薄,厚度2~3 mm为好[2],以利于固定液迅速均匀地渗入到标本内部。为最大限度地保存抗原活性,避免标本内部固定不完全,本实验以2~3 mm的厚度为标准进行标本修整。
组织脱水透明的时间至关重要,决定着脑组织制片的成败。经过不断地摸索与重复,本研究拟定了上述实验条件。脱水透明的时间长短与组织的种类、标本的大小和厚度、试剂的新旧和温度等条件密切相关。乙醇穿透作用快,为减轻其对标本的收缩作用,脱水过程中本研究选择从低浓度乙醇开始。脑组织较致密,因而脱水时间宜长以保证脱水充分,但用于免疫组织化学染色的组织不宜在乙醇中长时间浸泡而导致抗原损失[4],权衡两者要求,本研究对厚度为2~3 mm的脑组织标本总结出上述室温下脱水时间。须指出的是,为更精确地量化时间,以上所用的脱水剂、透明剂均为新液或新鲜配制,其中对组织在高浓度乙醇(95%乙醇、无水乙醇)与二甲苯中停留时间的掌握尤为关键,时间过短则脱水透明不充分,过长则易造成组织变脆[5]等,影响后续切片。肉眼观察透明结果这一步很重要,透明充分,组织呈琥珀状通透。
在转入浸蜡前数分钟内宜吸净包埋盒表面及由盒孔流出的透明剂,以便于浸蜡时蜡液对组织内二甲苯的置换,也利于增加石蜡Ⅰ的使用频数。本实验用石蜡Ⅱ浸蜡2 h,以使石蜡充分填充组织且置换残余的二甲苯;浸蜡Ⅱ与包埋蜡液相同,有利于增加浸蜡组织与包埋用蜡的相容性,再者,较高熔点的硬蜡便于切片。对浸蜡时间与温度的把握也很重要,时间过短则透明剂置换不充分,过长则易造成组织发硬变脆;同时高温能破坏标本的抗原活性,因此用于免疫染色的浸蜡温度不宜超过60℃。此外,注意新蜡使用前应反复熔化、凝固至少3次,每次添蜡时新蜡的加入量不应超过旧蜡的1/3[2],否则可能出现包埋蜡块有裂纹、蜡片皱褶难以展平等情况。
切片过程中,刀片宜新,贴片时注意避免气泡的附着,烘片时尽量先让组织表面的水分充分流下,减少因水分、烤化的石蜡同时流经组织而造成的组织漂移与形变。
脑组织因脂质含量较多等特点,与玻片黏附性差,本实验选用多聚赖氨酸防脱载玻片贴附切片并进行H-E染色。若使用硅化防脱载玻片,H-E染色时宜适度延长伊红分色时间,因为玻片上的硅化物可增加伊红的着色[6]。
经此方法可制备较多数量的高质量大鼠脑组织连续石蜡切片,较好地解决了优质脑组织切片不易获得的问题,为后续实验做好了充分准备,是一种有效实用的制作方法。
| [1] | 陈广斌,谢玲,林坚涛.不同固定方法对新生大鼠脑组织切片的影响[J].中国民康医学,2008,20:1730-1731. |
| [2] | 赵荧,唐军民.形态学实验技术[M].北京:北京大学医学出版社,2008:24,28,52. |
| [3] | Paxinos G, Watson C.大鼠脑立体定位图谱[M].诸葛启钏主译. 北京:人民卫生出版社, 2005. |
| [4] | 李和,周莉.组织化学与免疫组织化学[M].北京:人民卫生出版社, 2008:12. |
| [5] | 倪灿荣,马大烈,戴益民.免疫组织化学实验技术及应用[M].北京:化学工业出版社,2006:9. |
| [6] | 梁英杰,凌启波,张威.临床病理学技术[M].北京:人民卫生出版社,2011:61-62. |
 2016, Vol. 37
2016, Vol. 37


