2. 上海市静安区中心医院骨科, 上海 200040;
3. 第二军医大学海军医学系航空医学教研室, 上海 200433
2. Department of Orthopedics, Central Hospital of Shanghai Jingan District, Shanghai 200040, China;
3. Department of Aviation Medicine, Faculty of Naval Medicine, Second Military Medical University, Shanghai 200433, China
脊髓损伤(spinal cord injury,SCI)是脊柱损伤最严重的并发症,往往导致损伤节段以下肢体严重的功能障碍。SCI的发病机制涉及多种因素导致的组织损伤,但是免疫炎症反应在SCI的发病过程中起到非常重要的作用[1]。目前SCI可选的防治手段有手术干预、激素冲击治疗、药物治疗以及细胞移植治疗等多种途径,但是我国SCI的发生率仍然呈现逐年上升趋势[2]。因此,如何最大程度地减轻脊髓伤残程度、恢复脊髓功能,仍是医学研究的热点问题。
氢气在生物体内具有抗炎、抗氧化等作用[3, 4]。有文献报道,在生物体内给予一定剂量的氢气分子能够显著改善许多器官的缺血再灌注损伤[5, 6, 7],并且饱和氢气生理盐水能够显著改善动物SCI后的修复[8, 9, 10],但呼吸高浓度(66.7%)氢气对外伤导致的SCI后脊髓功能恢复的作用尚未见报道。本研究以脊髓钳夹损伤小鼠为动物模型,采用BMS(Basso mouse scale)评分、BBB(Basso,Beattie and Bresnahan)评分、小鼠足迹分析、蛋白质印迹法及病理形态学观察等手段,利用电解水制备氢气[11],观察呼吸高浓度氢气对小鼠脊髓钳夹伤后1周内脊髓功能恢复情况的影响,探讨呼吸高浓度氢气是否能作为一种潜在的改善SCI后修复的辅助治疗手段。
1 材料和方法 1.1 试剂与仪器显微外科动脉夹(夹闭力约3~5 g),眼科剪,眼科镊,手术缝线,红、蓝色墨水,刻度尺(最小单位1 mm),4%多聚甲醛溶液均生产于深圳市诺健医疗器械有限公司,购自第二军医大学教保处。
1.2 动物选择及分组雄性C57小鼠36只,体质量20~25 g,由上海西普尔-必凯实验动物有限公司提供[动物许可证号SYXK(沪)2011-0039]。小鼠随机分为假手术组、脊髓损伤组和氢气治疗组3组,每组12只。脊髓损伤组和氢气治疗组参照Fehlings等[12]的方法建立小鼠SCI模型。小鼠用10%水合氯醛(5 mL/kg)腹腔注射麻醉,以T10棘突为中心备皮。简单消毒后取背部正中切口(长约2 cm),依次切开皮肤、皮下组织,显露棘突。锐性切开椎旁肌并向两侧分离,显露T8~L1椎体棘突及椎板,小心咬除T9~T11棘突及全椎板。以T10为中心,显露直径约9 mm的圆形区,用显微外科动脉夹(尖端空隙0.4 mm)钳夹15 s致小鼠SCI。致伤瞬间,小鼠痉挛性摆尾、双下肢及躯体回缩扑动后双下肢瘫痪,造模成功。假手术组暴露硬脊膜后不做其他处理;氢气治疗组在小鼠SCI模型制备完成后,采用制氢机(惠美医疗科技公司)给予小鼠每天呼吸氢气(氢气与氧气的混合气体,两者摩尔比为2∶1)4次,每次1 h,间隔呼吸1 h空气,持续呼吸3 d的方案[11]。
1.3 BMS评分SCI后每天采用BMS评分标准评价各组小鼠脊髓神经功能的恢复情况。评分范围为0~9分:0~2分主要用于评价踝关节的运动情况,3~4分用于描述后肢对后半身的支撑和向前步进情况,5~8分主要评估进行中后爪的位置、前后肢体的协调性和躯干的稳定性,9分为正常小鼠的肢体运动、躯干稳定、行动轻便。
1.4 BBB评分分别于损伤前及损伤后1、3、7 d采用BBB法对各组小鼠进行运动功能评分[13]。评分采用双人双盲独立观察,最后结果为2位观察员的平均分数。评分前排空膀胱,观察期为4 min。BBB评分细则主要是依据动物的臀、膝、踝关节行走、躯干运动及其协调情况。
1.5 足迹分析参考Hill等[14]和Ma等[15]的方法,首先建立直线跑道保证小鼠能直线前进,然后将小鼠前后爪分别染成红色和蓝色并放置在已铺好白纸的平板上(40 cm×5 cm)。一次完整的步进循环是指一对前爪印至下一个前爪印之间的距离,每次测量要求最少连续5次的步进循环,测量每次步进循环中的两后爪的距离和间距来评估后肢的支撑情况。
1.6 蛋白质印迹实验参照Chen等[16]的方法,在小鼠SCI后的第7天用10%水合氯醛(5 mL/kg)腹腔注射麻醉,然后用咬骨钳剥离椎板,冰上操作取出小鼠脊髓组织。BCA法(南京建成蛋白定量试剂盒)对脊髓组织进行样本蛋白定量。制备SDS-PAGE分离胶,选择浓度合适的分离胶和积层胶,依次上样,先用60 V跑胶,20 min后改用90 V至电泳结束。采用湿式转印法行电流恒流转印,取出PVDF膜,丽春红染液中染膜10 min,封闭液中封闭2 h后加入抗Caspase-3(Abcam公司)孵育过夜,洗涤后再加入二抗孵育1 h。使用ECL发光试剂盒显色,应用荧光显像仪器记录分析图像。
1.7 脊髓组织病理学的观察在小鼠SCI后的第7天用10%水合氯醛(5 mL/kg)腹腔注射麻醉,经左心室灌流后取以损伤区为中心的1 cm长脊髓,4%多聚甲醛固定至少48 h,脱水、包埋、切片,分别进行H-E和尼氏染色,观察小鼠脊髓组织形态。
1.8 统计学处理采用SPSS 13.0软件进行统计学分析,数据以 x±s 表示,多组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结果 2.1 各组小鼠的一般状况SCI后小鼠相比假手术组均出现双侧后肢瘫痪,而氢气治疗组与脊髓损伤组相比双侧后肢瘫痪症状明显好转。SCI后7 d,脊髓损伤组有2只小鼠死亡,假手术组和氢气治疗组无小鼠死亡。
2.2 各组小鼠BMS评分结果在整个评价过程中,假手术组小鼠稳定为9分,而脊髓损伤组和氢气治疗组小鼠在损伤后均立即出现迟缓性瘫痪,BMS评分迅速降至0分。在SCI后的第6、7天,脊髓损伤组小鼠的BMS评分低于假手术组(P<0.01),而氢气治疗组高于脊髓损伤组(P<0.05),提示呼吸高浓度氢气可改善小鼠SCI后的功能恢复,见图 1。
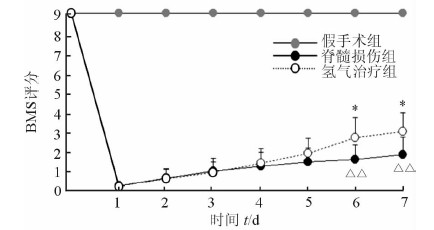
|
图 1 呼吸高浓度氢气对脊髓损伤后小鼠BMS评分的影响 * P<0.05与脊髓损伤组比较; △△P<0.01与假手术组比较. n=12, x±s |
SCI后第1、3、7天,脊髓损伤组小鼠的BBB评分均低于假手术组(P<0.01);而在第3、7天,氢气治疗组小鼠的BBB评分相对于脊髓损伤组得到改善(P<0.05),见表 1。
|
|
表 1 呼吸高浓度氢气对脊髓损伤后小鼠BBB评分的影响 |
SCI后第7天,假手术组小鼠始终表现为前后肢的协调运动,无后肢拖拽和足掌旋转,且后爪位于前爪的后外侧;脊髓损伤组小鼠的后爪足迹常和前爪重叠或位于其前方,小鼠后肢足迹拖拽痕迹明显;而氢气治疗组的小鼠后肢拖拽、前后肢足迹重叠现象较脊髓损伤组明显改善(图 2A)。对于后肢的支撑情况,脊髓损伤组小鼠的后爪间距和后爪距离低于假手术组(P<0.05),而氢气治疗组高于脊髓损伤组(P<0.05),见图 2B。
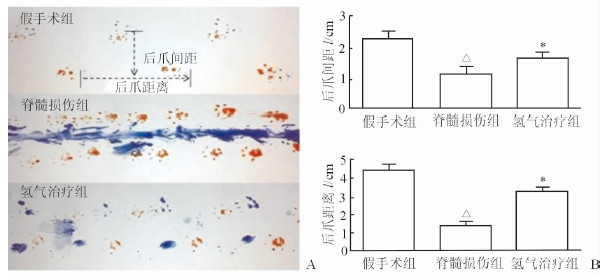
|
图 2 呼吸高浓度氢气对脊髓损伤后小鼠足迹(A)与后肢支撑情况(B)的影响 *P<0.05与脊髓损伤组比较; △P<0.05与假手术组比较. n=12, x±s |
蛋白质印迹法结果显示,相较于假手术组,脊髓损伤组小鼠脊髓组织Caspase-3蛋白呈现高水平表达,而氢气治疗组与脊髓损伤组比较表达降低(图 3)。
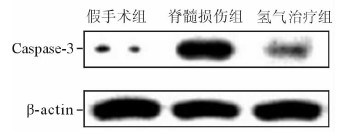
|
图 3 呼吸高浓度氢气对脊髓损伤后小鼠脊髓组织Caspase-3蛋白表达的影响 |
H-E染色结果显示假手术组小鼠脊髓形态正常;脊髓损伤组脊髓组织形态破坏,钳夹处灰质、白质有重度压缩痕迹,周围伴有大量毛细血管充血和细胞水肿;而氢气治疗组的钳夹痕迹、周围组织的充血水肿相对于脊髓损伤组明显好转。尼氏染色结果显示,相较于假手术组,脊髓损伤组小鼠脊髓的前角运动神经元突起减少、神经细胞排列紊乱并丢失死亡、细胞形态结构不完整并伴有明显肿胀,而氢气治疗组较脊髓损伤组明显改善,见图 4。

|
图 4 呼吸高浓度氢气对脊髓损伤后小鼠组织形态变化的影响 A1, A2: 假手术组; B1, B2: 脊髓损伤组; C1, C2: 氢气治疗组. Original magnification: ×50 (A1, B1, C1), ×200 (A2, B2, C2) |
本研究采用小鼠脊髓钳夹损伤模型来探讨呼吸高浓度氢气对SCI后1周内功能恢复的影响,结果发现,呼吸66.7%的高浓度氢气能够改善小鼠SCI后1周内的BMS评分、BBB评分、足迹分析结果和脊髓组织形态,表明高浓度氢气能够促进小鼠SCI后1周内运动功能、神经再生功能和形态学的恢复。由于小鼠SCI后1周是免疫炎症反应的关键期,直接影响预后[17],可以推测呼吸66.7%的高浓度氢气或许能改善小鼠SCI的预后情况。此外,呼吸高浓度氢气还能够降低脊髓组织中凋亡相关蛋白Caspase-3的表达,说明抑制凋亡途径也可能参与高浓度氢气对小鼠SCI的保护途径。
氢是自然界最简单的一种元素。在过去很长时间,人们认为人体呼吸氢气后,氢气不易与体内其他物质发生反应,因此把它归类为“生理学惰性气体”。氢气在潜水医学中作为氮气的替代品,用作大饱和深度潜水的呼吸气体。1975年Dole等[3]首次用连续14 d呼吸8个大气压97.5%的高浓度氢气的方式,发现氢气可以有效治疗动物皮肤恶性黑素瘤,并推测可能是通过抗氧化机制发挥作用;2001年Gharib等[18]发现通过呼吸8个大气压的高压氢气可治疗肝寄生虫感染引起的炎症反应,并提出氢气与羟自由基直接反应是治疗炎症损伤的基础。2007年,日本学者发现,动物在常压下呼吸2%的氢气就可有效清除自由基,显著改善脑缺血再灌注损伤,其中拮抗羟自由基和亚硝酸阴离子是其重要的保护途径[4]。此后,人们开始重视氢气并发现氢气可以防治多种由炎症和自由基介导的疾病,如肾[5]、脑[6]的缺血再灌注损伤等。
由于氢气的这种特殊效应,氢气潜在的改善SCI修复的作用也愈受重视。Chen等[8]报道给予饱和氢气生理盐水能够改善大鼠SCI后的功能;Zhou等[9]则发现饱和氢气生理盐水对兔脊髓缺血再灌注损伤具有保护作用;Wang等[10]研究发现,髓鞘注射饱和氢气生理盐水能够显著减少急性SCI程度,并加快损伤后的功能修复。上述研究表明,氢气分子对SCI及SCI后的修复具有保护作用。本研究首次发现呼吸高浓度氢气能够改善小鼠SCI后的功能修复,并减少神经元细胞的凋亡。
氢气的作用机制至今仍未阐明,目前最为主流的学术观点是选择性抗氧化机制[4]。当细胞处于缺氧或炎症等异常环境时,细胞的线粒体功能受损,导致氧气无法被线粒体正常呼吸代谢和利用。 “多余” 的部分氧气会在细胞内形成大量的超氧阴离子(O2-)、过氧化氢(H2O2)及羟自由基(OH-)等活性氧,其中OH-介导的脂质过氧化等反应在细胞进一步损伤中扮演着十分重要的作用。氢气作为一种小分子物质,可以有效穿过细胞膜,拮抗OH-等有害自由基,保护细胞免受氧化损伤。氢气的这种选择性抗氧化机制虽然具有一定的说服力,但不能解释氢气在其他非自由基介导疾病中的保护作用,推测氢气还具有其他可能的作用机制。本研究结果发现,呼吸高浓度氢气能够改善SCI后的细胞凋亡,提示抗凋亡机制也可能是氢气保护效应的重要途径之一,有待深入探讨。
虽然氢气在生物体内对许多疾病具有保护作用这一观点已成为医学领域的共识[19],但氢气的具体临床应用方式仍需探讨。普通制备得到的氢气浓度超过4%时容易爆炸,因此目前动物实验中呼吸氢气的浓度普遍低于4%[4, 5],或采用氢气溶解于水的方式给药[6, 7, 8, 9, 10]。虽然呼吸低浓度氢气在动物体内已经得到了不错的生物学效应,但其或许并不能满足患者的需求,尤其是肺通气和换气功能受限的患者。此外氢气饱和溶液注射的给药方式也存在氢分子浓度不稳定、临床给药不方便等问题。本研究采用电解水制备氢气的方法,通过电解分离水产生66.7%的氢气供小鼠呼吸,克服了之前无法呼吸高浓度氢气的弊端;电解水产生的多余氢气又可以和氧气再次结合从而产生水蒸气,制备方法安全有效。因此,通过电解水获取天然的高浓度氢气的给药方式是一种可供临床实践应用的方法[11],具有极强的临床应用前景。
本研究利用电解水获得天然氢气的原理,发现小鼠呼吸66.7%的高浓度氢气后能够改善SCI后的运动功能、减少脊髓组织的形态学改变、保护神经组织,其保护机制可能与氢气在生物体内的抗炎症、抗氧化和抗凋亡能力有关,提示呼吸高浓度氢气或许可以成为临床上治疗SCI的辅助手段之一。
| [1] | Hall E D, Braughler J M. Free radicals in CNS injury[J]. Res Publ Assoc Res Nerv Ment Dis, 1993, 71: 81-105. |
| [2] | 叶红明.急性脊髓损伤的病理机制及中药治疗进展[J].浙江中西医结合杂志, 2009, 19:127-130. |
| [3] | Dole M, Wilson F R, Fife W P. Hyperbaric hydrogen therapy: a possible treatment for cancer[J]. Science, 1975, 190: 152-154. |
| [4] | Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688-694. |
| [5] | Wang R, Wu J, Chen Z, Xia F, Sun Q, Liu L. Postconditioning with inhaled hydrogen promotes survival of retinal ganglion cells in a rat model of retinal ischemia/reperfusion injury[J]. Brain Res, 2015, 1632: 82-90. |
| [6] | Cai J, Kang Z, Liu K, Liu W, Li R, Zhang J H, et al. Neuroprotective effects of hydrogen saline in neonatal hypoxia-ischemia rat model[J]. Brain Res, 2009, 1256: 129-137. |
| [7] | Liu F T, Xu S M, Xiang Z H, Li X N, Li J, Yuan H B, et al. Molecular hydrogen suppresses reactive astrogliosis related to oxidative injury during spinal cord injury in rats[J]. CNS Neurosci Ther, 2014, 20: 778-786. |
| [8] | Chen C, Chen Q, Mao Y, Xu S, Xia C, Shi X, et al. Hydrogen-rich saline protects against spinal cord injury in rats[J]. Neurochem Res, 2010, 35: 1111-1118. |
| [9] | Zhou L, Wang X, Xue W, Xie K, Huang Y, Chen H, et al. Beneficial effects of hydrogen-rich saline against spinal cord ischemia-reperfusion injury in rabbits[J]. Brain Res, 2013, 1517: 150-160. |
| [10] | Wang J L, Zhang Q S, Zhu K D, Sun J F, Zhang Z P, Sun J W, et al. Hydrogen-rich saline injection into the subarachnoid cavity within 2 weeks promotes recovery after acute spinal cord injury[J]. Neural Regen Res, 2015, 10: 958-964. |
| [11] | Peng Z, Chen W, Wang L, Ye Z, Gao S, Sun X, et al. Inhalation of hydrogen gas ameliorates glyoxylate-induced calcium oxalate deposition and renal oxidative stress in mice[J]. Int J Clin Exp Pathol, 2015, 8: 2680-2689. |
| [12] | Fehlings M G, Nashmi R. Assessment of axonal dysfunction in all in vitro model of acute compressive injury to adult rat spinal cord axons[J]. Brain Res, 1995, 677: 291-299. |
| [13] | Bethea J R, Castro M, Keane R W, Lee T T, Dietrich W D, Yezierski R P. Traumatic spinal cord injury induces nuclear factor-κB activation[J]. J Neurosci, 1998, 18: 3251-3260. |
| [14] | Hill R L, Zhang Y P, Burke D A, Devries W H, Zhang Y, Magnuson D S, et a1. Anatomical and functional outcomes following a precise, graded, dorsal laceration spinal cord injury in C57BL/6 mice[J]. J Neurotrauma, 2009, 26: 1-15. |
| [15] | Ma M, Basso D M, Walters P, Stokes B T, Jakeman L B. Behavioral and histological outcomes following graded spinal cord contusion injury in the C57BL/6 mouse[J]. Exp Neurol, 2001, 169: 239-254. |
| [16] | Chen J, Yan G J, Hu R R, Gu Q W, Chen M L, Gu W, et al. Improved pharmacokinetics and reduced toxicity of brucine after encapsulation into stealth liposomes: role of phosphatidylcholine[J]. Int J Nanomedicine, 2012, 7: 3567-3577. |
| [17] | Carpenter R S, Kigerl K A, Marbourg J M, Gaudet A D, Huey D, Niewiesk S, et al. Traumatic spinal cord injury in mice with human immune systems[J]. Exp Neurol, 2015, 271: 432-444. |
| [18] | Gharib B, Hanna S, Abdallahi O M, Lepidi H, Gardette B, De Reggi M. Anti-inflammatory properties of molecular hydrogen: investigation on parasite-induced liver inflammation[J]. C R Acad Sci, 2001, 324: 719-724. |
| [19] | Ohta S. Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine[J]. Pharmacol Ther, 2014, 144: 1-11. |
 2016, Vol. 37
2016, Vol. 37


