2. 解放军东海舰队上海舰艇岸勤部医院, 上海 200940;
3. 第二军医大学海军医学系海洋生物技术教研室, 上海 200433
2. Hospital of Shanghai Warship Logistics Department, East China Sea Fleet, Shanghai 200940, China;
3. Department of Marine Biotechnology, Faculty of Naval Medicine, Second Military Medical University, Shanghai 200433, China
PRKAG2心脏综合征是常染色体显性遗传的家族性心脏病,主要由于编码腺苷-磷酸激活的蛋白激酶(AMP-activated protein kinase,AMPK)γ2调节亚单位的PRKAG2基因发生突变,家系成员可出现以心肌肥厚、传导系统异常及心室预激为主要表现的多种复杂心脏病变。本课题组在临床工作中发现了一个中国人特有的PRKAG2心脏综合征家系[1],其患病的PRKAG2家系成员的临床表型基本符合国外报道的家系的共性,同样具有心肌肥厚、预激综合征、高度房室传导阻滞、窦房结功能不良、猝死以及房扑、房颤等房型心率失常。经基因筛查,其突变位点G100S与国外报道的位点不一致,为研究其致病机制,本课题组前期已通过构建斑马鱼模型验证了该突变可以引起心肌肥大和糖原沉积[2]。在此基础上,课题组拟进一步通过构建与人同源性更近的心脏过表达人源PRKAG2(G100S)转基因小鼠,为研究人源PRKAG2(G100S)突变基因在心脏组织的过度表达对小鼠心脏发育和功能维持的作用打下基础,从而阐明该新突变在诱发中国人PRKAG2心脏综合征中的作用机制。
1 材料和方法 1.1 人源PRKAG2(G100S)表达载体的构建及转基因从广州复能基因有限公司购得PRKAG2基因的一个转录变体cDNA质粒(GenBank登记号BC068598),其N端缺失了44个氨基酸。根据已知的PRKAG2基因序列(GenBank登记号NM016203),设计搭桥引物及序列扩增引物,通过PCR搭桥方法,合成完整全长序列的PRKAG2基因,并将其克隆到TA载体,得到的阳性克隆经测序鉴定。以PRKAG2基因为模板,利用PCR技术进行定点突变,设计4对引物,将突变位点设计在引物上,通过PCR扩增引物,扩增片段上含有所需要的突变位点,最后将扩增片段PRKAG2(G100S)克隆到pMD-18T载体,构建PRKAG2(G100S)表达载体,使用限制性内切酶进行酶切鉴定,并通过序列分析进行确证。把PRKAG2(G100S)克隆入心脏特异表达的α肌球蛋白重链(α-MHC)启动子的下游构建PRKAG2(G100S)转基因载体,提取、鉴定质粒,并将其线性化,获得α-MHC启动的PRKAG2(G100S)转基因片段进行转基因注射。
1.2 受精卵原核注射[3]注射浓度调整至5 ng/μL,用显微受精卵原核注射法将线性化完毕的转基因载体注射到C57BL/6J[SCXK(苏)2015-0001]小鼠的受精卵中,将注射完毕的受精卵移植入代孕母鼠体内,在代孕周期结束后成功分娩获得F0代首建鼠。
1.3 PCR鉴定PRKAG2(G100S)转基因小鼠的基因型转基因小鼠在出生7 d后剪尾端鉴定基因型,并用剪趾法标记。利用碱裂解法从小鼠尾端组织中提取基因组DNA,用PCR法对转基因小鼠进行基因型鉴定。PCR上游引物为: 5′-CTG GTG GGA GAG CCA TAG GCT ACG-3′(Myh6-gt1F),下游引物为:5′-CTG GTA GGA GAA CGG GAA CAC GGT T-3′(PRKAG2-gt1R)。为防止出现假阳性情况,设计了第2对引物用于辅助验证,上游引物:5′-AGA CCA TCG TGG ACA GAA TAG TAA G-3′(PRKAG2-gt2F),下游引物:5′-AGG TGG GTA GAT CAA CCT GAG ATT AG-3′(rabbit poly A-gt2R)。反应条件:95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 30 s,共35个循环。随后以琼脂糖凝胶电泳对PCR产物进行鉴定,PRKAG2 G100S阳性小鼠第1对引物产生片段大小为484 bp,而第2对引物产生目标片段大小为603 bp。
1.4 PRKAG2(G100S)转基因小鼠与C57BL/6J小鼠杂交传代将剪尾鉴定阳性的F0原代小鼠与野生型的C57BL/6J小鼠杂交,分娩得到F1代小鼠,继续将剪尾鉴定阳性的F1代小鼠与野生型的C57BL/6J小鼠杂交,分娩得到F2代小鼠并进行剪尾鉴定。
1.5 小鼠心脏组织总RNA的提取随机抽取3只剪尾鉴定阳性的F2代转基因小鼠,用颈椎脱臼法处死,取其心脏组织,按照总RNA提取试剂盒(北京达科为生物技术有限公司)提供的实验步骤,提取心脏组织的总RNA,紫外分光光度计测定RNA的纯度和浓度。
1.6 RNA的反转录取上述实验中提取的RNA,按照RNA反转录试剂盒(TaKaRa公司)提供的实验步骤,使用PCR仪将其反转录为cDNA,反应体系:模板RNA 3 μg,5×MMLV RT Buffer 4 μL,1 μmol/L miR-RT primers 1.2 μL,40 U/μL Rnasin 0.25 μL,200 U/μL MMLV Reverse Transcriptase 0.2 μL,RNase-free water补至20 μL。反应条件:25℃ 30 min,42℃ 30 min,85℃ 5 min。
1.7 实时荧光定量PCR (qPCR)检测F2代转基因小鼠心脏组织中PRKAG2(G100S)的表达以上述研究所得到的cDNA为模板,按照Bio-Rad公司qPCR试剂盒提供的步骤加入相关试剂及引物,以U6为内参,在ABI-7300型qPCR仪上进行PCR扩增。反应条件:95℃ 3 min;95℃ 12 s,62℃ 40 s,共40个循环。实验结果采用2-ΔΔCt法进行表达量相对定量分析。qPCR引物序列为上游:5′-CTG GTG GGA GAG CCA TAG GCT ACG-3′,下游:5′-CTG GTA GGA GAA CGG GAA CAC GGT T-3′。
1.8 PCR测序检测转基因小鼠的心脏组织中PRKAG2(G100S)以上述研究所得到的cDNA为模板,在PCR仪上进行PCR扩增。反应条件:95℃ 5 min;95℃ 30 s,58℃ 30 s,68℃ 45 s,共30个循环;68℃ 10 min。将扩增得到的PCR产物纯化后测序。 引物序列为上游:5′-AAA TGC CAG CCA GAA GAG G-3′,下游:5′-TAG TGT GTC GGT GAT GCC AG-3′。
1.9 蛋白质印迹法检测转基因小鼠的心脏组织中PRKAG2(G100S)的表达量随机抽取3只剪尾鉴定阳性的F2代转基因小鼠,用颈椎脱臼法处死。取0.2 g心脏组织,加入含2 mmol/L的RIPA裂解液1 mL,转移至玻璃匀浆器,冰上匀浆至组织块消失,13 500×g离心10 min,取上清,向其中加入1/4体积的5×上样缓冲液煮沸10 min备用。将经过上述步骤得到的蛋白样品经5% SDS-PAGE分离后转移至硝酸纤维素膜(Millipore公司),10%脱脂奶粉封闭后,依次与兔抗人PRKAG2抗体(1∶2 000,Abcam公司)和辣根过氧化物酶(HRP)标记的二抗孵育,DAB显色发光。
1.10 统计学处理实验结果采用SPSS软件(Version 11.0)进行统计学分析,两组均数的比较采用非配对t检验;3组和3组以上均数的比较采用单因素方差分析,并以Dunnett t检验进行组间均数的两两比较。检验水准(α)为0.05。
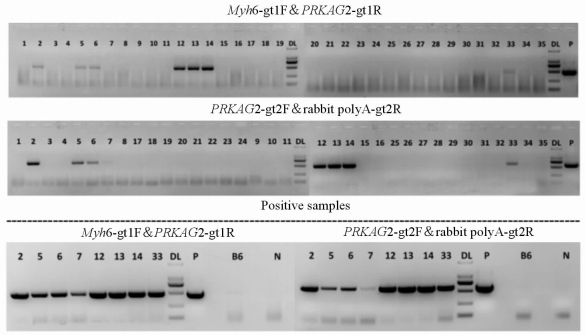
2 结 果 2.1 人源PRKAG2(G100S)表达载体的构建及转基因小鼠的基因型鉴定将人源PRKAG2(G100S)插入心脏特异表达的α-MHC的下游,构建PRKAG2(G100S)转基因载体。用显微注射法将线性化完毕的转基因载体注射到C57BL/6J小鼠的受精卵中,将注射完毕的受精卵移植回代孕母鼠体内,在代孕周期结束后成功获得35只F0代首建鼠。出生7 d后对F0代小鼠剪尾端鉴定基因型,最终得到8只阳性首建鼠(图 1)。在后续的与背景鼠C57BL/6J小鼠的交配建系过程中逐渐保留了其中2个可稳定遗传的品系链作为后续的表型分析素材。
|
图 1 琼脂糖凝胶电泳检测F0代转基因小鼠的基因型 Fig 1 Detection of the genotype of F0 generation transgenic mice by gel electrophoresis Myh6-gt1F & PRKAG2-gt1R is the first primer, PRKAG2-gt2F & rabbit poly A-gt2R is the second primer. The lines 1-35 indicate the randomly selceted F0 generation transgenic mice. The lines 2,5,6,7,12,13,14 and 33 indicate the PRKAG2 (G100S) positive transgenic mice. P: Positive control; N: Negative control; B6: C57BL/6 wildtlypemice; DL: DNA size ruler |
本研究随机抽取的所有(3只)F2代转基因小鼠,其心脏组织中PRKAG2(G100S)mRNA的表达量(F2-1: 85.5±13.1; F2-2: 82.5±16.4; F2-3: 57.6±5.5)高于同窝野生型小鼠(WT-1: 1.0±0.2; WT-2: 1.3±0.3; WT-3: 15.0±0.7),两者差异具有统计学意义(P=0.000)。本研究结果显示WT-3小鼠心脏组织中PRKAG2(G100S)较其余2只WT小鼠表达量偏高,这属正常的个体变异,在本研究中并未对我们的研究结论造成负面影响。
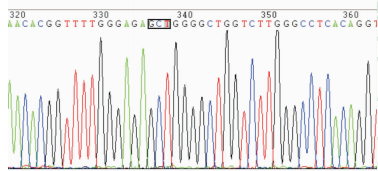
2.3 PCR测序检测转基因小鼠的心脏组织中PRKAG2(G100S)以F2代转基因小鼠的心脏cDNA为模板,扩增得到597 bp片段。将该产物纯化测序后与人PRKAG2序列比对,如图 2所示,PRKAG2位点已由GGC突变为AGC(反向测序)。
|
图 2 PCR测序检测F2代转基因小鼠心脏组织中PRKAG2(G100S) Fig 2 Detection of PRKAG2 (G100S) in cardiac tissue of F2 generation transgenic mice by PCR sequencing |
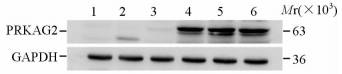
为了便于定量分析,本研究将蛋白质印迹法所得的图像(图 3)用Quality One做灰度扫描后,以PRKAG2(G100S)与GAPDH灰度的比值来代表其相对表达量。研究结果显示3只随机选取的F2代转基因小鼠心脏组织中PRKAG2(G100S)蛋白的相对表达量分别为0.96(F2-1)、0.90(F2-2)、1.17(F2-3),高于同窝野生型小鼠(WT-1:0.07; WT-2:0.05; WT-3:0.09),两者的差异具有统计学意义(P=0.000)。
|
图 3 蛋白质印迹法检测F2代转基因小鼠心脏组织中PRKAG2(G100S)蛋白的表达量 Fig 3 Expression of PRKAG2 (G100S) in the heart tissue of F2 generation transgenic mice was detected by Western blotting analysis 1: Wildtype(WT-1); 2: WT-2; 3: WT-3; 4: F2-1; 5: F2-2; 6: F2-3 |
迄今为止,国内外报道了至少21个家族性传导系统异常伴心室预激及心肌肥厚家系,目前共发现有12种PRKAG2基因突变:Ins Leu351为移码突变,另有11种错义突变分别是R302Q、H383R、T400N、Y487H、N488I、Q506K、E506Q、R531G、R531Q、S548P和G100S[1, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14]。而G100S突变正是由本课题组发现并报道的,令我们感兴趣的是,其突变点G100S位置在AMPK γ2亚基的非胱硫醚β-合成酶(cystathionine β-synthase,CBS )区域的外显子3上,并不位于既往报道突变位点所属的CBS区域。本课题组提出该课题的研究方向:中国人特有的位于非CBS区域的此突变点所导致典型PRKAG2心脏综合征表型,其引起的临床症状的致病机制是否和CBS区域突变点一致?如若一致,非CBS区域突变点和CBS区域突变点导致AMPK改变、糖原沉积的能力是否有强弱量级差异;如若不一致,非CBS区域突变点引起PRKAG2心脏综合征的机制又是如何?遵循以上研究思路,本课题组前期已做了如下探索研究工作:(1)在CCL13细胞中过表达G100S可以导致AMPK活性降低、糖原沉积[15],初步证明G100S突变和目前国际上报道的突变点一样是通过改变AMPK活性从而引起细胞内的糖原沉积。(2)用G100S突变体的人钠通道共转染HEK 293T细胞[16],通过膜片钳技术检测钠离子通道,证实G100S突变体可引起钠离子通道激活和失活减慢。从离体细胞水平探讨了G100S突变引起细胞膜上离子通道蛋白的改变,可能是导致心律失常的机制之一。(3)应用显微注射技术成功构建了斑马鱼心肌肥厚模型,证实了G100S突变可导致斑马鱼PRKAG2基因功能发生改变,心肌细胞内AMPK活性降低并出现糖原累积,并导致斑马鱼心肌肥厚[2],并在定量水平上证实在导致AMPK活性降低方面,非CBS区域的G100S突变小于位于CBS区域的R302Q。
自1974年美国研究员Jeanisch应用显微注射法获得首例转基因小鼠SV40DNA开始,转基因动物技术是最近几年取得飞速发展的生物高新技术,无论是在该研究技术的本身,还是在该技术的转化应用领域都取得了举世瞩目的成就。其同源性接近同为哺乳动物的人类,国际上对其模型研究的各种技术都已经趋于成熟。目前在国际上PRKAG2心脏综合征研究领域,PRKAG2突变转基因鼠模型被公认是研究PRKAG2心脏综合征的最佳模型,国际上大量的研究采用此动物模型:如2003年,Arad等[17]和Patel等[18]通过建立过表达PRKAG2(N488I)突变的转基因鼠模型,成功模拟了与具有该突变的人相似的心肌病和电生理表型,并进行了相应的机制研究;同样通过建立过表达PRKAG2(R302Q)[19]、PRKAG2(Arg531Gly)[20]、PRKAG2(T400N)[21]突变的转基因鼠模型,也成功发现了糖原沉积导致的心肌肥厚以及预激综合征、传导系统异常等电生理异常表型。在国内针对该方面的研究不多,复旦大学中山医院的张亚平等[22]针对R302Q突变,利用钙离子染色分析大鼠H9C2钙离子库的信号差异,未发现突变引起细胞内钙稳态的改变。相较于本课题组前期实验的斑马鱼模型及离体细胞的研究,转基因小鼠在心律失常心电图检查及机制的研究方面具有优势。
在临床应用方面,鉴于目前国际上尚未有针对的PRKAG2心脏综合征的诊断及治疗指南,Porto等[23]近期在线发表的文章将截止到2014年9月前所有的观察性研究、病例报道及综述综合分析,详细列出了PRKAG2心脏综合征的各详细的临床表型数据,并提出了相应详细的治疗方案供现有的心脏病临床治疗指南参考,而其主要参考的是目前突变家系中最为常见2种突变Arg302Gln和Asn488Ile的报道。中国人特有的G100S突变的PRKAG2心脏综合征仍然缺少家系的报道及机制的深入研究,以后国际上制定的临床心脏病治疗指南是否适用于此类中国人尚未可知,而本转基因小鼠模型的建立对G100S的功能性及机制的研究影响深远、意义重大,有可能为以后对中国人特有的PRKAG2心脏综合征的治疗提供新的思路。
| [1] | 张 静, 郑 兴, 秦永文, 周炳炎, 吴 弘, 王洪如.家族性传导系统异常伴心室预激及心肌肥厚一家系调查分析[J].中华心血管病杂志, 2007, 35:258-259. |
| [2] | Zhang B L, Ye Z, Xu R L, You X H, Qin Y W, Wu H, et al. Overexpression of G100S mutation in PRKAG2 causes Wolff-Parkinson-White syndrome in zebrafish[J]. Clin Genet, 2014, 86: 287-291. |
| [3] | Hogan B, Costantini F, Lacy E. Manipulating the mouse embryo: a laboratory manual[M]. Cold Spring Harber Laboratory, 1986: 223-230. |
| [4] | Gollob M H, Green M S, Tang A S, Gollob T, Karibe A, Ali Hassan A S, et al. Identification of a gene responsible for familial Wolff-Parkinson-White syndrome[J]. N Engl J Med, 2001, 344: 1823-1831. |
| [5] | Laforêt P, Richard P, Said M A, Romero N B, Lacene E, Leroy J P, et al. A new mutation in PRKAG2 gene causing hypertrophic cardiomyopathy with conduction system disease and muscular glycogenosis[J]. Neuromuscul Disord, 2006, 16: 178-182. |
| [6] | Murphy R T, Mogensen J, McGarry K, Bahl A, Evans A, Osman E, et al. Adenosine monophosphate-activated protein kinase disease mimicks hypertrophic cardiomyopathy and Wolff-Parkinson-White syndrome: natural history[J]. J Am Coll Cardiol, 2005, 45: 922-930. |
| [7] | Arad M, Benson D W, Perez-Atayde A R, McKenna W J, Sparks E A, Kanter R J, et al. Constitutively active AMP kinase mutations cause glycogen storage disease mimicking hypertrophic cardiomyopathy[J]. J Clin Invest, 2002, 109: 357-362. |
| [8] | Sternick E B, Oliva A, Magalhäes L P, Gerken L M, Hong K, Santana O, et al. Familial pseudo-Wolff-Parkinson-White syndrome[J]. J Cardiovasc Electrophysiol, 2006, 17: 724-732. |
| [9] | Burwinkel B, Scott J W, Bührer C, van Landeghem F K, Cox G F, Wilson C J, et al. Fatal congenital heart glycogenosis caused by a recurrent activating R531Q mutation in the gamma 2-subunit of AMP-activated protein kinase (PRKAG2), not by phosphorylase kinase deficiency[J]. Am J Hum Genet, 2005, 76: 1034-1049. |
| [10] | Arad M, Maron B J, Gorham J M, Johnson W H Jr, Saul J P, Perez-Atayde A R, et al. Glycogen storage diseases presenting as hypertrophic cardiomyopathy[J]. N Engl J Med, 2005, 352: 362-372. |
| [11] | Blair E, Redwood C, Ashrafian H, Oliveira M, Broxholme J, Kerr B, et al. Mutations in the gamma(2) subunit of AMP-activated protein kinase cause familial hypertrophic cardiomyopathy: evidence for the central role of energy compromise in disease pathogenesis[J]. Hum Mol Genet, 2001, 10: 1215-1220. |
| [12] | Gollob M H, Seger J J, Gollob T N, Tapscott T, Gonzales O, Bachinski L, et al. Novel PRKAG2 mutation responsible for the genetic syndrome of ventricular preexcitation and conduction system disease with childhood onset and absence of cardiac hypertrophy[J]. Circulation, 2001, 104: 3030-3033. |
| [13] | Bayrak F, Komurcu-Bayrak E, Mutlu B, Kahveci G, Basaran Y, Erginel-Unaltuna N. Ventricular pre-excitation and cardiac hypertrophy mimicking hypertrophic cardiomyopathy in a Turkish family with a novel PRKAG2 mutation[J]. Eur J Heart Fail, 2006, 8: 712-715. |
| [14] | Kelly B P, Russell M W, Hennessy J R, Ensing G J. Severe hypertrophic cardiomyopathy in an infant with a novel PRKAG2 gene mutation: potential differences between infantile and adult onset presentation[J]. Pediatr Cardiol, 2009, 30: 1176-1179. |
| [15] | Zhang B L, Xu R L, Zhang J, Zhao X X, Wu H, Ma L P, et al. Identification and functional analysis of a novel PRKAG2 mutation responsible for Chinese PRKAG2 cardiac syndrome reveal an important role of non-CBS domains in regulating the AMPK pathway[J]. J Cardiol, 2013, 62: 241-248. |
| [16] | 王 君, 郑 兴.载有人心肌细胞钠离子通道及PRKAG2基因的HEK-293T细胞模型的建立[J].第二军医大学学报, 2014, 35:1243-1246. WANG J, ZHENG X. Establishing HEK-293T cell model carrying human sodium channel and PRKAG2 gene[J]. Acad J Sec Mil Med Univ, 2014, 35: 1243-1246. |
| [17] | Arad M, Moskowitz I P, Patel V V, Ahmad F, Perez-Atayde A R, Sawyer D B, et al. Transgenic mice overexpressing mutant PRKAG2 define the cause of Wolff-Parkinson-White syndrome in glycogen storage cardiomyopathy[J]. Circulation, 2003, 107: 2850-2856. |
| [18] | Patel V V, Arad M, Moskowitz I P, Maguire C T, Branco D, Seidman J G, et al. Electrophysiologic characterization and postnatal development of ventricular pre-excitation in a mouse model of cardiac hypertrophy and Wolff-Parkinson-White syndrome[J]. J Am Coll Cardiol, 2003, 42: 942-951. |
| [19] | Sidhu J S, Rajawat Y S, Rami T G, Gollob M H, Wang Z, Yuan R, et al. Transgenic mouse model of ventricular preexcitation and atrioventricular reentrant tachycardia induced by an AMP-activated protein kinase loss-of-function mutation responsible for Wolff-Parkinson-White syndrome[J]. Circulation, 2005, 111: 21-29. |
| [20] | Davies J K, Wells D J, Liu K, Whitrow H R, Daniel T D, Grignani R, et al. Characterization of the role of gamma2 R531G mutation in AMP-activated protein kinase in cardiac hypertrophy and Wolff-Parkinson-White syndrome[J]. Am J Physiol Heart Circ Physiol, 2006, 290: H1942-H1951. |
| [21] | Banerjee S K, Ramani R, Saba S, Rager J, Tian R, Mathier M A, et al. A PRKAG2 mutation causes biphasic changes in myocardial AMPK activity and does not protect against ischemia[J]. Biochem Biophys Res Commun, 2007, 360: 381-387. |
| [22] | 张亚平, 颜 彦, 宋振举, 童朝阳.PRKAG2心脏综合征中R302Q突变对心肌细胞糖原和钙离子稳态的影响[J].中国临床医学, 2015(4):479-481. |
| [23] | Porto A G, Brun F, Severini G M, Losurdo P, Fabris E, Taylor M, et al. Clinical spectrum of PRKAG2 syndrome[J]. Circ Arrhythm Electrophysiol, 2016, 9.pii: e003121. |
 2016, Vol. 37
2016, Vol. 37


