2. 浙江大学医学院免疫学研究所, 杭州 310058;
3. 第二军医大学医学免疫学国家重点实验室, 上海 200433
2. Institute of Immunology, School of Medicine, Zhejiang University, Hangzhou 310058, Zhejiang, China;
3. National Key Laboratory of Medical Immunology, Second Military Medical University, Shanghai 200433, China
支气管哮喘(简称哮喘)是全球范围内发病率较高的慢性气道疾病之一。全球目前有近3亿哮喘患者,临床上常用β2受体激动剂改善临时症状,吸入糖皮质激素以长期控制[1]。而激素的长期使用易扰乱机体免疫功能,也容易导致药物拮抗[2]。过敏性哮喘的发病机制复杂,树突状细胞(dendritic cells,DCs)是哮喘发病的始动者,能驱使CD4幼稚T细胞活化并向Th2细胞方向分化,维持疾病相关免疫反应和免疫耐受[3]。因此,干扰DCs的免疫活性是探索哮喘治疗的可选靶点。
自噬是一种进化保守的细胞降解过程,在清除细胞内源性或外源性病原体等天然免疫反应及调节DCs、T细胞、B细胞等适应性免疫细胞的生存、增殖、免疫活性中均扮演了重要的角色,涉及肿瘤、衰老、炎症等病理生理过程,在慢性阻塞性肺疾病、肺损伤、肺纤维化、肺部感染、哮喘等肺脏相关疾病中的作用也愈来愈受研究者们的重视[4, 5, 6, 7, 8, 9]。有研究提示,特异性敲除DCs自噬基因Atg5能影响DCs抗原提呈及诱导CD4+T细胞的活化,致使小鼠更易感染单纯疱疹病毒[10]。DCs的自噬也与DCs活化相应的T细胞反应以抵抗呼吸道合胞病毒感染相关[11]。同样,经自噬诱导剂雷帕霉素预处理的DCs可增强由结核分枝杆菌感染引起的T细胞反应[12],雷帕霉素还能通过诱导自噬致使自身免疫性葡萄膜炎加重[13]。哮喘属于一类多种细胞参与的以免疫系统功能紊乱、炎症因子分泌异常为表现,并以气道慢性炎症、气道高反应性、气道重塑为特点的呼吸系统变态反应性疾病[14, 15]。DCs的自噬与哮喘的关系目前并不清楚。本研究通过下调DCs的自噬水平,观察DCs的相关功能的改变以及过敏性哮喘的病情进展,初步探讨DCs自噬对哮喘病情的影响。
1 材料和方法 1.1 实验动物及主要试剂、仪器BALB/c及C57/B6小鼠均购于上海西普尔-必凯实验动物有限公司[许可证号:SYXK(沪)2013-0058],鼠龄6~8周,体质量 20~22 g,适应1周后建立小鼠过敏性哮喘模型;OT2小鼠(编号: 004194)购于美国Jackson Lab。BALB/c、C57/B6及OT2小鼠均在第二军医大学免疫学国家重点实验室SPF级动物房饲养[许可证号:SYXK(沪)2013-0016]。所有动物实验均经第二军医大学实验动物伦理委员会批准。小鼠重组人粒细胞-巨噬细胞集落刺激因子(GM-CSF)、小鼠重组白介素(IL)-4因子(美国PeproTech公司),RPMI 1640培养基(法国Biowest公司),胎牛血清(fetal bovine serum,FBS;美国Gibco公司),流式抗体CD16/32抗体、7AAD-PerCP Cy5.5抗体,Siglec-F-PerCP Cy5.5抗体、CD11c PerCP-Cy5.5/APC/PE抗体、主要组织相容性复合体Ⅱ类分子(MHCⅡ)-FITC抗体、CD40-APC抗体、CD80-eFluor-450抗体、CD86-APC抗体、CD4-PerCP抗体、CFSE-FITC抗体(美国eBioscience公司),LC3 抗体 (英国Abcam公司),鼠血清IgE检测试剂标记HRP山羊抗小鼠IgE二抗(美国eBioscience公司),细胞分离纯化所用CD11c磁珠、CD4(L3T4)磁珠、分选磁柱(德国Miltenyi Biotec公司)。流式细胞仪(LSRⅡ,BD公司),离心机(Microfuge 16 centrifuge,美国Beckman公司;Centrifuge 5430R,德国Eppendorf公司),雾化仪PARI Boy N (德国PARI公司),电泳胶紫外分析仪(台式紫外分析装置,FR-110,上海复日科技有限公司)。
1.2 动物分组及哮喘模型的建立BALB/c小鼠按随机数字表法分为空白对照组(对照组)、急性哮喘对照组(哮喘组)、哮喘自噬抑制剂氯喹(chloroquine,CQ)治疗组(CQ组)3组。哮喘组与CQ组小鼠均于第0、7、14天腹腔注射卵清蛋白(ovalbumin,OVA)致敏液(0.5 mg/mL OVA与10%十二水合硫酸铝钾配制而成),每只小鼠注射OVA量为100 μg/200 μL。第21天起每只小鼠给予10 mL 2% OVA高频雾化吸入进行激发,每天1次,每次30 min,连续4 d。CQ组于每次雾化前0.5 h腹腔注射60 μg/g CQ(200 μL冷生理盐水稀释),哮喘组则予以200 μL冷生理盐水腹腔注射。空白对照组以冷生理盐水代替OVA致敏和激发,时间同上。在末次雾化后24 h内处置完所有小鼠,准备后续实验。
1.3 骨髓来源DCs的分离与培养参照并改良Inaba等[16]的实验方法,取雄性C57/B6小鼠,直接脊髓离断法处死小鼠,分离小鼠股骨、胫骨,置于RPMI 1640培养液中反复吹吸骨髓腔直至骨头变为白色,弃之,继续吹打培养液,直至将骨髓条打匀。加入无菌的Tris-NH4Cl溶液裂解红细胞2 min,加入DCs专用培养液[RPMI 1640培养液+10 ng/mL重组GM-CSF+1 ng/mL IL-4+10% FBS+1% 100×双抗]铺于6孔板中培养。第3天起每天换半液,根据实验需要于第5~7天收取细胞待用。标记DCs表面CD11c以检测DCs浓度,即加入CD11c PerCP-Cyanine5.5/APC/PE抗体后使用流式细胞仪进行分析鉴定。无需磁珠分选,培养所得的CD11c+DCs纯度可达80%以上。
1.4 T淋巴细胞增殖实验取4周龄雄性OT2小鼠1只,取脾脏制成脾细胞悬液,CD4磁珠分选纯化脾细胞悬液获得CD4+的T淋巴细胞,部分T淋巴细胞行CFSE染色后使用计数板计数备用。
各组BALB/c小鼠肺DCs的获取:处死小鼠,获取各组小鼠肺组织,充分剪碎并加入胶原酶Ⅳ(美国Gibco公司)于37℃孵育45 min,取出后于超净台碾磨、过滤、破红细胞制作成肺单细胞悬液,再经过Percoll液(美国General Electric公司)4℃梯度离心30 min,获得以淋巴细胞为主的肺单细胞悬液,最后使用CD11c磁珠进行磁珠分选纯化获得不同组小鼠肺DCs,纯度达80%以上。
上述获得的T淋巴细胞与各组DCs按照1∶10的比例(每孔1×104的DCs及1×105的T细胞)铺于96孔板内,根据分组加入OVA-17肽(OVA 323-339氨基酸序列:ISQAVHAAHAEINEAGR)进行刺激,共培养72 h。收取各组细胞,行抗鼠CD4-PE/CD3-APC抗体(美国eBioscience公司)染色,流式细胞术分析T细胞的增殖和CD69的表达。
1.5 蛋白质印迹法检测DCs自噬水平使用蛋白质印迹法检测上述步骤所得的各组小鼠肺DCs自噬相关标志性分子微管相关蛋白1轻链3-β(microtubule-associated protein 1 light chain 3-β,MAP1LC3-Ⅱ,简称LC3)的表达水平。经RIPA裂解液裂解DCs获得蛋白,以100 μg加样,行12% SDS-PAGE后,将蛋白转移至硝酸纤维素膜,5%脱脂奶粉室温封闭2 h,加入LC3 抗体;4°C过夜后,TBST缓冲液洗涤3次,加入兔抗鼠IgG-HRP继续孵育,洗涤后化学发光法显影。用ImageJ软件进行LC3蛋白的定量分析,计算自噬流指标LC3Ⅱ/Ⅰ比值及LC3Ⅱ/actin比值以表示自噬水平的变化[17, 18]。
1.6 小鼠模型外周血的收集及肺组织病理检测实验中通过一侧眼球取血后处死小鼠,剪开小鼠皮毛和肋骨,充分暴露肺脏,分离获取肺组织;将肺组织浸入4%多聚甲醛溶液中固定,乙醇脱水,常规石蜡包埋、切片,行H-E染色。
1.7 ELISA法检测血清OVA特异性IgE分子水平将96孔板用10 μg/mL OVA包被过夜,次日用PBST清洗3遍,加入1∶200稀释的血清样本室温孵育2 h,PBST清洗5遍;加入1∶1 000稀释的HRP标记山羊抗小鼠IgE二抗孵育1 h,PBST清洗5遍;加入1∶1混匀的ELISA显色液A和B液,室温显色20 min后,加入100 μL终止液终止显色,用Bio-Rad伯乐iMark酶标仪(美国)检测光密度(D)值。
1.8 流式细胞术分析DCs表面各分子表达水平骨髓来源DCs检测采用先筛除凋亡细胞(7AAD阴性)再标记CD11c(CD11c阳性)的策略,即为7AAD-CD11c+DCs的定位骨髓来源DCs的流式细胞术检测策略;肺组织源DCs检测采用先用CD16/32 抗体进行FcR封闭后,去除凋亡细胞(7AAD阴性)、筛除嗜酸粒细胞及肺泡巨噬细胞(Siglec-F阴性),再选择CD11c阳性及MHCⅡ阳性细胞为需要进一步分析的肺源DCs的策略,即为7AAD-/Siglec-F-/CD11c+/MHCⅡ+DCs的定位肺组织源DCs的流式细胞术检测策略[19]。分别检测各DCs表面CD40、CD80、CD86、MHCⅡ的表达水平。
1.9 体外实验观察自噬抑制剂3-甲基腺嘌呤(3MA)对DCs表面共刺激分子及MHCⅡ的影响根据1.3项下实验方法,分离培养骨髓来源的DCs并随机分为对照组、DCs OVA预处理组(OVA组)、DCs OVA预处理并3MA自噬抑制组(3MA组),其中OVA(100 μg/mL)预处理及3MA(40 μg/mL)处理时间为12 h,再分别收取各组DCs行流式细胞术检测。如1.8项下方法所述,以7AAD-CD11c+DCs定位骨髓来源DCs的流式细胞术检测策略,分别检测各DCs表面CD40、CD86、MHCⅡ的表达水平。
1.10 统计学处理数据分析采用Graph Pad Prism 5.0或SPSS 19.0统计软件完成。所有计量资料均用 x±s 表示。符合正态分布和方差齐性的数据采用单因素方差分析,不符合正态分布和方差齐性的数据则采用Kruskal-Wallis检验。检验水准(α)为0.05。
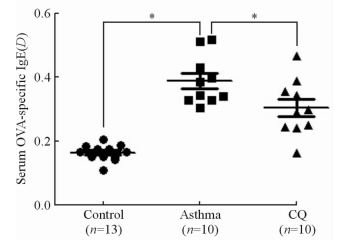
2 结 果 2.1 各组小鼠血清OVA特异性IgE的表达水平结果(图 1)显示,哮喘组小鼠血清OVA特异性IgE的表达水平高于对照组(P<0.05),而CQ组小鼠血清OVA特异性IgE的表达水平较哮喘组降低(P<0.05)。
|
图 1 各组小鼠血清OVA特异性IgE的表达水平 Fig 1 Comparison of serum OVA-specific IgE levels in all groups CQ: Chloroquine; OVA: Ovalbumin. *P<0.05. x±s |
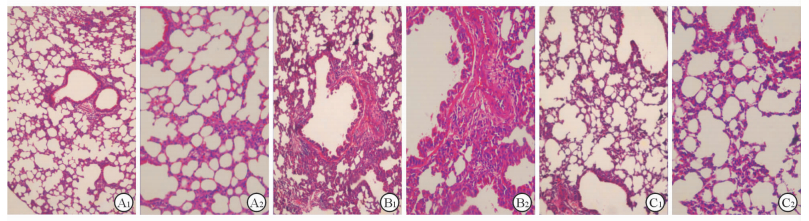
结果如图 2所示,哮喘组小鼠血管周围及细支气管有大量炎症细胞浸润,肺泡间隔部分有增宽,部分肺泡间隔可见断裂,炎症浸润多于对照组。与哮喘组相比,CQ组小鼠血管和支气管周围炎症细胞浸润明显减少。
|
图 2 各组小鼠肺组织病理结果(H-E染色) Fig 2 Lung inflammation as detected by H-E staining in all groups A1, A2: Control group; B1, B2: Asthma group; C1, C2: CQ group. CQ: Chloroquine. Original magnification: ×100(A1, B1, C1), ×200(A2, B2, C2) |
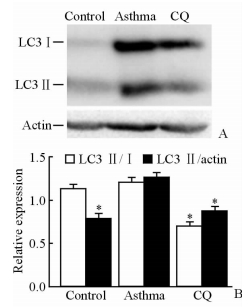
采用蛋白质印迹法检测各组LC3的表达水平,结果发现哮喘组小鼠肺DCs的LC3Ⅱ/actin比值高于对照组(P<0.05),LC3Ⅱ/Ⅰ比值也有升高趋势(P>0.05);而较于哮喘组,CQ组肺DCs的LC3Ⅱ/Ⅰ及LC3Ⅱ/actin比值均降低(P<0.05),说明哮喘组肺DCs自噬水平比对照组高,而CQ组肺DCs的自噬较哮喘组下降,见图 3。
|
图 3 各组小鼠肺DCs自噬水平的变化 Fig 3 Changes of autophagy levels in lung-DCs in each group A: Representative LC3-immunoblots of lung-DCs in all groups; B: The LC3-Ⅱ to the LC3-Ⅰ ratio and LC3-Ⅱ to actin ratio in all groups. DCs:Dendritic cells; CQ: Chloroquine; LC3: Microtubule-associated protein 1 light chain 3-β. *P<0.05 vs asthma group. n=3, x±s |
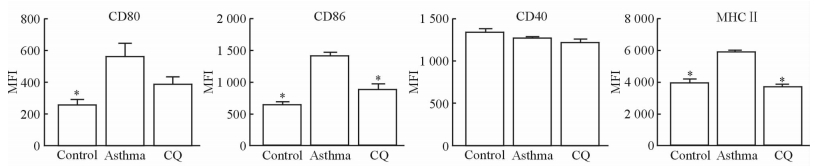
利用流式细胞仪检测各组小鼠肺DCs表面共刺激分子CD80、CD86、CD40及MHC Ⅱ的表达情况。结果(图 4)显示,相比对照组,哮喘组肺DCs表面CD80、CD86及MHC Ⅱ的表达水平均升高(P<0.05); CQ组与哮喘组相比,CD86及MHCⅡ的表达水平均降低(P<0.05),CD80也有下降趋势(P>0.05)。3组小鼠肺DCs表面CD40未见明显变化。
|
图 4 各组小鼠肺DCs表面共刺激分子及MHCⅡ的表达 Fig 4 Expression of surface co-stimulatory molecules and MHCⅡon lung DCs in each group MFI: Mean fluorescence intensity; CQ: Chloroquine; DCs: Dendritic cells; MHCⅡ: Major histocompatibility complex class Ⅱ. *P<0.05 vs asthma group. n=5, x±s |
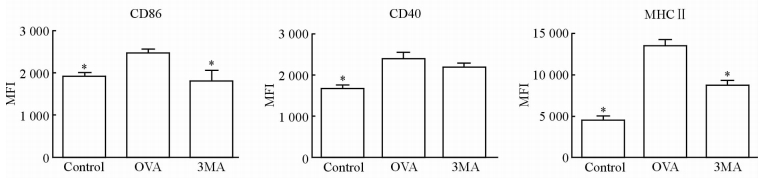
收取各组细胞检测非凋亡DCs表面共刺激分子CD86、CD40及MHC Ⅱ的表达情况。结果(图 5)显示,与对照组相比,OVA组DCs表面CD86、CD40及MHC Ⅱ的表达水平均升高(P<0.05);3MA组与OVA组相比,CD86及MHC Ⅱ的表达水平均降低(P<0.05),CD40也呈现下降趋势(P>0.05);3MA组与对照组相比差异无统计学意义。
|
图 5 3MA对DCs表面共刺激分子及MHCⅡ表达的影响 Fig 5 Impact of 3MA on surface co-stimulatory molecules and MHCⅡon DCs in each group MFI: Mean fluorescence intensity; OVA: Ovalbumin; 3MA: 3-Methyladenine; MHCⅡ: Major histocompatibility complex class Ⅱ; DCs:Dendritic cells. *P<0.05 vs OVA group. n=5, x±s |
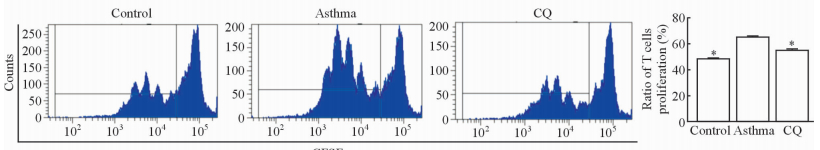
相较于对照组,哮喘组诱导的CD4+T细胞增殖增加(P<0.05),而CQ组与哮喘组相比诱导的T细胞增殖降低(P<0.05),且CQ组与对照组相比差异无统计学意义(P>0.05),说明抑制DCs自噬能降低DCs诱导的OT2小鼠T细胞的增殖能力,见图 6。
|
图 6 各组小鼠肺DCs诱导的T细胞增殖情况 Fig 6 Mouse lung DCs-induced proliferation of T cells in each group CFSE: Carboxyfluorescein diacedtate succinimidyl ester; CQ: Chloroqaine; DCs: Dendritic cells. *P<0.05 vs asthma group. n=6, x±s |
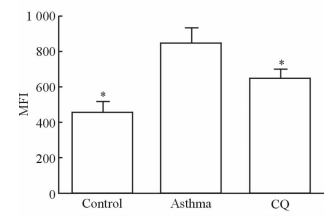
利用流式细胞术检测各组CD4+T细胞CD69的表达(图 7),结果发现哮喘组T细胞CD69的表达水平高于对照组(P<0.05),而CQ组低于哮喘组 (P<0.05) ,且CQ组与对照组相比差异无统计学意义(P>0.05),说明自噬抑制剂可以降低T细胞活化反应。
|
图 7 各组小鼠T细胞表面CD69的表达 Fig 7 CD69 expression in T cells surface of mice in each group MFI: Mean fluorescence intensity; CQ: Chloroquine. *P<0.05 vs asthma group. n=6, x±s |
过敏性哮喘是多种细胞及细胞组分参与的慢性炎症性疾病。本研究成功建立了OVA特异性过敏性哮喘小鼠模型,观察哮喘模型中肺DCs自噬水平的变化及抑制自噬对哮喘病情的影响并对其机制进行了初步探讨。
DCs在哮喘的发病过程中发挥重要的作用。以往研究发现,携带了抗原的DCs到达纵隔淋巴结T细胞聚集区域后,高表达一系列共刺激分子和MHC Ⅱ[20],这些成分能诱导幼稚T细胞增殖和分化[21, 22],而分化产生的不同T细胞对于气道的炎症具有不同作用[22, 23]。有研究提示哮喘小鼠气道壁DCs及肺组织自噬水平与对照组相比均有升高[24],本研究通过磁珠分选哮喘小鼠肺DCs,并采用蛋白质印迹法检测自噬相关蛋白LC3,结果提示LC3Ⅱ/Ⅰ比值(P>0.05)及LC3Ⅱ/actin比值(P<0.05)均高于对照组,说明小鼠肺DCs自噬水平在哮喘中升高。在此基础上进一步探索自噬抑制剂是否对哮喘的病情有影响,结果发现,CQ组OVA特异性IgE水平低于哮喘组(P<0.05),而且肺炎症细胞浸润程度也低于哮喘组,说明抑制自噬能改善哮喘病情。
MHCⅡ是DCs提呈加工后的外来抗原激活T淋巴细胞以致病的重要分子[25],CD80、CD86、CD40是DCs活化T淋巴细胞所需的表面共刺激信号分子[26]。有研究提示自噬影响MHCⅡ抗原复合物的形成而与DCs抗原提呈功能有关[27, 28],自噬抑制剂3MA能抑制MHCⅡ介导的抗原提呈[29]。本实验检测了各组小鼠肺DCs表面共刺激分子CD80、CD86、CD40及MHCⅡ的表达水平,结果发现,与对照组相比,哮喘组肺DCs表面 CD80、CD86及MHCⅡ均升高(P<0.05);与哮喘组比较,CQ组CD86及MHCⅡ则降低(P<0.05),CD80也有下降趋势,说明哮喘自噬抑制治疗组肺DCs表面共刺激分子及MHCⅡ较哮喘对照组降低。同时检测抑制DCs自噬后对LC3表达的影响,结果CQ组肺DCs LC3Ⅱ/Ⅰ及LC3Ⅱ/actin比值均降低(P<0.05),说明自噬抑制剂CQ能抑制哮喘肺DCs的自噬。本研究通过体外使用自噬抑制剂3MA处理DCs后检测DCs表面共刺激分子及MHCⅡ的表达,得到类似结果。
为进一步明确抑制哮喘模型中肺DCs自噬后对CD4+T细胞增殖和活化的影响,本实验利用OT2鼠作为CD4+T供体进行T细胞增殖与活化实验,结果提示较于哮喘组,CQ组小鼠T细胞的增殖能力和活化反应均降低(P<0.05),说明抑制DCs自噬能抑制DCs诱导的OT2小鼠T细胞增殖能力、降低T细胞活化反应。
本研究也发现CQ没能完全改善哮喘的病情,且在影响DCs表面共刺激分子中的趋势不一致。原因可能是自噬溶酶体的形成发生在自噬流的晚期,CQ只能抑制自噬溶酶体的形成而发挥抑制自噬的作用,目前尚无CQ影响自噬泡的形成及各自噬蛋白功能的报道,因此存在未能完全消减自噬作用的可能;另外CQ为一种抗疟疾药,具有抑制自噬以外的作用,并且不能非特异作用于某一种细胞。因此开发特异性自噬抑制剂将有助于进一步深入探讨自噬与哮喘的相关性。
综上所述,自噬抑制剂可能改善哮喘病情、抑制肺DCs的自噬、下调DCs表面共刺激分子及MHCⅡ的表达以及抑制DCs诱导的T细胞增殖能力。自噬与哮喘呼吸道病毒的复制和免疫反应相关,自噬基因Atg5多态性与哮喘相关[30],而且自噬水平可能与哮喘严重程度相关[31]。本研究首次较为深入地探索DCs自噬与哮喘的关系,拟通过DCs自噬条件性敲除动物模型进一步探索研究DCs自噬与哮喘发生和发展的关系,为哮喘的靶向治疗提供新的思路。
| [1] | Edwards M R, Bartlett N W, Hussell T, Openshaw P, Johnston S L. The microbiology of asthma[J]. Nat Rev Microbiol, 2012, 10: 459-471. |
| [2] | Ferreira L N, Brito U, Ferreira P L. Quality of life in asthma patients[J]. Rev Port Pneumol, 2010, 16: 23-55. |
| [3] | van Helden M J, Lambrecht B N. Dendritic cells in asthma[J]. Curr Opin Immunol, 2013, 25: 745-754. |
| [4] | Ryter S W, Mizumura K, Choi A M.The impact of autophagy on cell death modalities[J]. Int J Cell Biol, 2014, 2014: 502676. |
| [5] | Green D R, Levine B.To be or not to be how selective autophagy and cell death govern cell fate[J]. Cell, 2014, 157: 65-75. |
| [6] | Choi A M, Ryter S W, Levine B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368: 1845-1846. |
| [7] | Bhattacharya A, Eissa N T. Autophagy and autoimmunity crosstalks[J].Front Immunol, 2013, 4: 88. |
| [8] | Xu Y, Eissa N T. Autophagy in innate and adaptive immunity[J]. Proc Am Thorac Soc, 2010, 7: 22-28. |
| [9] | Mizumura K, Cloonan S M, Haspel J A, Choi A M. The emerging importance of autophagy in pulmonary diseases[J]. Chest, 2012, 142: 1289-1299. |
| [10] | Lee H K, Mattei L M, Steinberg B E, Alberts P, Lee Y H, Chervonsky A, et al. In vivo requirement for Atg5 in antigen presentation by dendritic cells[J]. Immunity, 2010, 32: 227-239. |
| [11] | Reed M, Morris S H, Jang S, Mukherjee S, Yue Z, Lukacs N W. Autophagy-inducing protein beclin-1 in dendritic cells regulates CD4 T cell responses and disease severity duringrespiratory syncytial virus infection[J]. J Immunol, 2013, 191: 2526-2537. |
| [12] | Jagannath C, Lindsey D R, Dhandayuthapani S, Xu Y, Hunter R L Jr, Eissa N T. Autophagy enhances the efficacy of BCG vaccine by increasing peptide presentation in mouse dendritic cells[J]. Nat Med, 2009, 15: 267-276. |
| [13] | Zhang Z, Wu X, Duan J, Hinrichs D, Wegmann K, Zhang G L, et al. Low dose rapamycin exacerbates autoimmune experimental uveitis[J]. PLoS One, 2012, 7: e36589. |
| [14] | Martinez F D, Vercelli D. Asthma[J]. Lancet, 2013, 382: 1360-1372. |
| [15] | Bhakta N R, Woodruff P G. Human asthma phenotypes: from the clinic, to cytokines, and back again[J]. Immunol Rev, 2011, 242: 220-232. |
| [16] | Inaba K, Inaba M, Romani N, Aya H, Deguchi M, Ikehara S, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J]. J Exp Med, 1992, 176: 1693-1702. |
| [17] | Kabeya Y, Mizushima N, Ueno T, Yamamoto A, Kirisako T, Noda T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19: 5720-5728. |
| [18] | Dickinson J D, Alevy Y, Malvin N P, Patel K K, Gunsten S P, Holtzman M J, et al. IL13 activates autophagy to regulate secretion in airway epithelial cells[J]. Autophagy, 2015, 12: 397-409. |
| [19] | Plantinga M, Guilliams M, Vanheerswynghels M, Deswarte K, Branco-Madeira F, Toussaint W, et al. Conventional and monocyte-derived CD11b+ dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen[J]. Immunity, 2013, 38: 322-335. |
| [20] | Stumbles P A, Thomas J A, Pimm C L, Lee P T, Venaille T J, Proksch S, et al. Resting respiratory tract dendritic cells preferentially stimulate T helper cell type 2 (Th2) responses and require obligatory cytokine signals for induction of Th1 immunity[J]. J Exp Med, 1998, 188: 2019-2031. |
| [21] | Vermaelen K Y, Carro-Muino I, Lambrecht B N, Pauwels R A. Specific migratory dendritic cells rapidly transport antigen from the airways to the thoracic lymph nodes[J]. J Exp Med, 2001, 193: 51-60. |
| [22] | Akbari O, Freeman G J, Meyer E H, Greenfield E A, Chang T T, Sharpe A H, et al. Antigen-specific regulatory T cells develop via the ICOS-ICOS-ligand pathway and inhibit allergen-induced airway hyperreactivity[J]. Nat Med, 2002, 8: 1024-1032. |
| [23] | Akbari O, DeKruyff R H, Umetsu D T. Pulmonary dendritic cells producing IL-10 mediate tolerance induced by respiratory exposure to antigen[J]. Nat Immunol, 2001, 2: 725-731. |
| [24] | 曹 足, 潘频华, 谭洪毅, 覃庆武, 王 展, 苏晓丽, 等.抗神经生长因子抗体对支气管哮喘小鼠肺组织自噬水平的影响[J].中华结核和呼吸杂志, 2014, 37:507-511. |
| [25] | Bakhru P, Sirisaengtaksin N, Soudani E, Mukherjee S, Khan A, Jagannath C. BCG vaccine mediated reduction in the MHC-Ⅱ expression of macrophages and dendritic cells is reversed by activation of Toll-like receptors 7 and 9[J]. Cell Immunol, 2014, 287: 53-61. |
| [26] | Pen J J, Keersmaecker B D, Heirman C, Corthals J, Liechtenstein T, Escors D, et al. Interference with PD-L1/PD-1 co-stimulation during antigen presentation enhances the multifunctionality of antigen-specific T cells[J]. Gene Ther, 2014, 21: 262-271. |
| [27] | Paludan C, Schmid D, Landthaler M, Vockerodt M, Kube D, Tuschl T, et al. Endogenous MHC class Ⅱ processing of a viral nuclear antigen after autophagy[J]. Science, 2005, 307: 593-596. |
| [28] | Schmid D, Pypaert M, Münz C. Antigen-loading compartments for major histocompatibility complex class Ⅱ molecules continuously receive input from autophagosomes[J]. Immunity, 2007, 26: 79-92. |
| [29] | Münz C. Enhancing immunity through autophagy[J]. Annu Rev Immunol, 2009, 27: 423-449. |
| [30] | Jyothula S S, Eissa N T.Autophagy and role in asthma[J]. Curr Opin Pulm Med, 2013, 19: 30-35. |
| [31] | Poon A, Eidelman D, Laprise C, Hamid Q. ATG5, autophagy and lung function in asthma[J]. Autophagy, 2012, 8: 694-695. |
 2016, Vol. 37
2016, Vol. 37


