2. 第二军医大学学员旅学员11队, 上海 200433;
3. 第二军医大学药学院无机化学教研室, 上海 200433
2. The 11th Team of Student Brigade, Second Military Medical University, Shanghai 200433, China;
3. Department of Inorganic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
恶性肿瘤是威胁人类健康的常见疾病[1, 2, 3]。化疗是临床治疗恶性肿瘤最主要的手段之一,但目前常用的化疗药物属全身性给药,肿瘤部位药物浓度偏低并伴随着较大的全身性不良反应,不仅损害了化疗患者的身体健康,而且严重限制了其临床应用[4]。因此使化疗药物能更有效靶向富集至肿瘤部位并在肿瘤部位有效释放的靶向性控释药物载体的研究备受关注。目前常用的靶向方法有生物靶向和物理靶向两大类,其中利用磁性物质在磁场作用下定向移动并滞留的特性进行靶向的方法是物理靶向中最常采用的方法之一[5]。本研究设想利用能够负载药物分子且自身具有pH敏感性的高分子聚合物聚乙二醇-b-聚天冬氨酸(PEG-b-PAsp)与超顺磁性的Fe3O4纳米粒构建形成化疗药物给药体系[6, 7],以期在外磁场作用下,化疗药物载体在体内能够定向移动并富集于肿瘤病灶部位,并在其肿瘤部位具有较低pH的生理条件下有效释放负载的化疗药物,增加药物在肿瘤部位的浓度、降低化疗药物的全身毒性,从而达到更好的化疗效果。
1 材料和方法 1.1 试剂与仪器盐酸多柔比星(DOX·HCl,大连美仑生物技术有限公司),4’,6-二脒基-2-苯基吲哚(DAPI,罗氏公司),六水合氯化铁(FeCl3·6H2O)、乙酸钠(NaAc)、柠檬酸三钠(Na3Cit)均购自国药集团化学试剂有限公司,氨基聚乙二醇单甲醚 (PEG-NH2,MW 5 000 )、L-天冬氨酸-β-苄酯[H-Asp(OBzl)-OH],3-氨基丙基三乙氧基硅烷(APTS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)及N-羟基琥珀酰亚胺(NHS)均购自美国阿拉丁工业公司。水热釜(YK-200,上海豫康科教仪器设备有限公司),激光粒度-zeta电位测定仪(Zetasizer Nano ZS,英国马尔文仪器有限公司),荧光显微镜(Olympus IX71,Olympus公司),流式细胞仪(BD FACS Calibur,BD公司),磁滞回线测试仪 (MicroSence EV9,德国VSM公司)。其他为实验室常用试剂与仪器。
1.2 磁性纳米复合粒的制备 1.2.1 磁性Fe3O4纳米粒的制备利用水热法[8]合成Fe3O4纳米粒,将0.24 g Na3Cit溶于20 mL乙二醇中,再加入0.54 g FeCl3·6H2O和1.21 g NaAc至完全溶解,置于水热釜中,200℃下反应10 h。冷却至室温后用钕铁硼磁铁收集磁性Fe3O4纳米粒,用无水乙醇和去离子水分别洗涤3次,真空干燥得到棕黑色磁性Fe3O4纳米粒。
1.2.2 氨基化磁性Fe3O4@SiO2-NH2纳米粒的制备通过Stöber法和溶胶凝胶法制备Fe3O4@SiO2-NH2纳米粒[9],将16 mg磁性Fe3O4纳米粒分散于90 mL水与乙醇体积比为1∶3.5的混合溶液中,超声并高速搅拌0.5 h,加入2 mL浓氨水,缓慢加入100 μL正硅酸乙酯(TEOS),500 r/min搅拌反应5 h后加入氨基化试剂APTS 50 μL。继续搅拌2 h,用钕铁硼磁铁吸附反应产物,用无水乙醇和去离子水超声洗涤3次,真空干燥,得到氨基化磁性Fe3O4@SiO2-NH2纳米粒。
1.2.3 pH响应性高分子聚合物PEG-b-PAsp的合成参照文献[10]的方法合成高分子聚合物PEG-b-PAsp。取2.5 g H-Asp(OBzl)-OH溶于30 mL无水四氢呋喃(THF)中,升温至60℃,加入3 g固体三光气,通风橱中搅拌至溶液澄清后,再加入过量正己烷并于4℃过夜沉淀;抽滤后用乙酸乙酯与正己烷体积比为1∶1的混合液重结晶,真空干燥得到天冬氨酸苄酯环内酸酐(BLA-NCA)。取0.5 g PEG-NH2和2.5 g BLA-NCA,分别用无水硫酸镁预处理的二氯甲烷溶解,两者在N2氛围下30℃搅拌反应72 h,用10倍体积无水乙醚沉淀,抽滤并真空干燥得到聚乙二醇-b-聚天冬氨酸苄酯(PEG-b-PBLA)。取4 g PEG-b-PBLA溶于200 mL THF与NaOH(1 mol/L)体积比为1∶1的混合溶液中,室温搅拌10 h,用0.1 mol/L HCl溶液调至中性,浓缩、透析、干燥得到白色固体PEG-b-PAsp。
1.2.4 负载DOX的pH响应磁性纳米复合粒Fe3O4@SiO2 @PEG-b-PAsp@DOX的制备参照武承林等[11]的方法,分别取20 mg Fe3O4@SiO2-NH2和PEG-b-PAsp均溶于4 mL的纯水,400 r/min搅拌混匀0.5 h后,加入溶于4 mL纯水的17 mg EDC·HCl和3.2 mg NHS,冰浴下反应4 h,再加入5 mL的DOX·HCl溶液(4.4 g/L),反应过夜,透析并真空干燥,得到负载DOX的磁性纳米复合粒Fe3O4@SiO2@PEG-b-PAsp@DOX。而空白材料Fe3O4@SiO2@PEG-b-PAsp则是将未加入DOX·HCl的复合物经透析真空干燥制备得到的。
1.3 载药磁性纳米复合粒的形貌、粒径、zeta电位和磁性测定制备的载药磁性纳米复合粒超声分散于无水乙醇中,碳膜铜网上制样并在透射电镜下观察其形貌。制备纳米复合粒纯水重悬液,用马尔文激光粒度仪测定其粒径分布和zeta电位,并通过外界施加磁场来对其磁性进行测定;同时取一定质量干燥的纳米复合粒,利用磁滞回线测试仪检测其超顺磁性和磁饱和度。
1.4 载药磁性纳米复合粒的载药量和包封率的测定取5 mg干燥的Fe3O4@SiO2@PEG-b-PAsp@DOX超声分散于400 mL pH 5.5的PBS溶液中,避光搅拌12 h,将含有药物的溶液进行离心、过滤,收集滤液,利用紫外可见分光光度法测定DOX在235 nm处的光密度(D)值。结合该条件下DOX的标准曲线,计算Fe3O4@SiO2@PEG-b-PAsp@DOX中DOX的含量,并按以下公式计算载药率与包封率:载药量(%)=(载药纳米粒中的DOX含量/载药纳米粒的总量)×100%,包封率(%)=(载药纳米粒中的DOX含量/投入的DOX量)×100%。
1.5 载药磁性纳米复合粒在不同pH缓冲溶液中的药物释放研究用精密分析天平称取相同质量的Fe3O4@SiO2@PEG-b-PAsp@DOX干燥粉末,分别溶于2 mL pH 分别为5.5和7.4的PBS中,置于截留相对分子质量为10 000的透析袋中,分别置于100 mL不同pH的缓冲溶液(pH 5.5,pH 7.4)[12]中,37℃以恒定速率振荡,在0.5、1、2、4、8、12、24、48、60、72、96 h取样3 mL,并补加相同体积的缓冲液。利用紫外分光光度仪测定235 nm处的D值,结合DOX的标准曲线计算出各个时间点的累积释放量。
1.6 细胞摄取实验和载药磁性纳米复合粒的体外磁靶向性考察取处于对数生长期的A549细胞以106/mL的密度接种于6孔板,加入浓度为5 μg/mL的Fe3O4@SiO2@PEG-b-PAsp@DOX,37℃、5% CO2条件下孵育2 h后,PBS清洗2次。用4%的多聚甲醛溶液固定,再用PBS清洗2次,用1 μg/mL的DAPI溶液染核20 min,PBS清洗2次,荧光显微镜观察DOX的红色荧光,考察A549细胞对DOX或载药纳米复合粒的摄取情况。另取等量A549细胞接种于2片等面积的玻片上,于同一培养皿中培养,在其中一玻片下施加外磁场。培养皿中加入载药纳米复合粒至5 μg/mL,混合均匀后共培养2 h,每15 min轻摇混匀,分别收集玻片上细胞,通过流式细胞仪测定比较两组摄取细胞的荧光强度,考察载药纳米复合粒的体外磁靶向性[13, 14]。
1.7 细胞毒性实验取A549细胞以1×104/孔接种于96孔板,37℃、5% CO2条件下培养过夜后分别加入不同浓度的Fe3O4@SiO2@PEG-b-PAsp、DOX和Fe3O4@SiO2@PEG-b-PAsp@DOX,其中Fe3O4@SiO2@PEG-b-PAsp@DOX中DOX含量与DOX溶液一致,分别在24、48 h弃去上层培养液后加入100 μL 10%的CCK-8培养基溶液,继续于37℃、5%CO2条件下孵育1~2 h,测量在450 nm处的D值,并结合以下公式计算:细胞相对存活率(%)=(D实验组-D空白溶剂组)/ (D阴性对照组-D空白溶剂组)× 100%。
1.8 细胞凋亡实验取A549 细胞调整密度为2×105/mL,取1 mL接种于6孔板中,在37℃、5% CO2的孵箱环境中培养过夜。分别加入不同浓度的Fe3O4@SiO2@PEG-b-PAsp、Fe3O4@SiO2@PEG-b-PAsp@DOX溶液,37℃条件下孵育24 h,离心并收集细胞行Annexin Ⅴ-FITC和碘化丙啶(PI)染色,流式细胞仪进行分析。
1.9 统计学处理使用SPSS 13.0软件进行统计学分析,计量资料以 x±s 表示,组间比较采用单因素方差分析。检验水准(α)为0.05。
2 结 果 2.1 pH响应性高分子聚合物PEG-b-PAsp的核磁共振氢谱图PEG-b-PAsp是通过在碱性条件下水解去除PEG-NH2引发BLA-NCA开环聚合产物的苄醇得到的。 图 1显示的分别为PEG-b-PBLA(图 1A)和PEG-b-PAsp(图 1B)的谱图,其中峰1、1’为聚乙二醇主链亚甲基吸收峰,峰2、2’为天冬氨酸主链上次甲基吸收峰(4.29),峰3、3’为天冬氨酸侧链上亚甲基保护峰(2.66~3.14),峰4和5分别为侧链保护基亚甲基(5.02~5.16)和苯环吸收峰(7.27)。由两者的图谱比较,可以看出侧链保护基团的吸收峰基本完全消失,说明聚合物已经水解充分,结合峰1和峰4的积分比可知所得产物为PEG-b-PAsp。
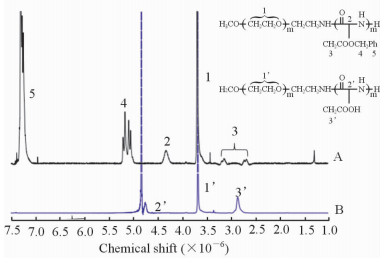
|
图 1 PEG-b-PBLA (A)和PEG-b-PAsp (B)的核磁共振氢谱图 Fig 1 The 1HNMR spectrum of PEG-b-PBLA (A) and PEG-b-PAsp (B) PEG: Polyethylene glycol; PBLA: Poly (β-benzyl-L-aspartate); PAsp: Polyaspartic acid |
制备的磁性纳米复合粒在透射电镜下观察可见形态呈圆球形,表面光滑且粒径较均一(图 2)。激光粒度仪测得Fe3O4的平均粒径为(138.4±1.1)nm,zeta电位(-18.9±0.3)mV;Fe3O4@SiO2的平均粒径为(160.3±1.3)nm,zeta电位(-30.2±0.5)mV;Fe3O4@SiO2@PEG-b-PAsp@DOX的平均粒径为(197.7±1.5)nm,zeta电位(-35.9±0.6)mV。
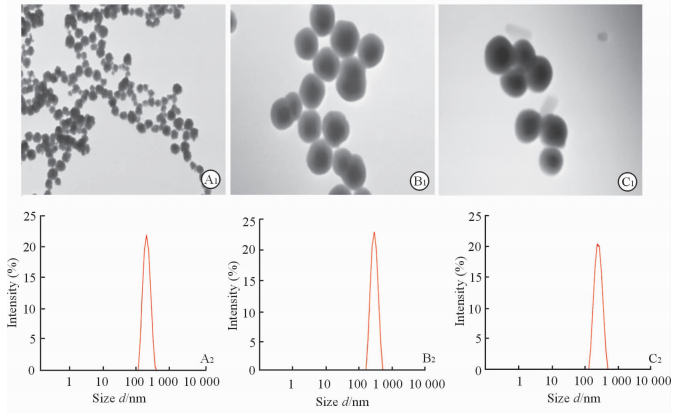
|
图 2 磁性纳米粒子的透射电镜形态(A1~C1)和粒径图(A2~C2) Fig 2 TEM photograph (A1-C1) and diameter (A2-C2)of magnetic nanoparticles A1,A2:Fe3O4; B1,B2: Fe3O4@SiO2;C1,C2:Fe3O4@SiO2@PEG-b-PAsp@DOX. TEM: Transmission electron microscope; PEG: Polyethylene glycol; PAsp: Polyaspartic acid; DOX: Doxorubicin. Original magnification: ×8 000(A1), ×20 000(B1, C1) |
利用紫外分光光度法,以不同浓度DOX溶液的浓度值为横坐标,D235值为纵坐标,建立直线回归方程为Y=0.018 1X-0.003 9(0.25~25 μg/mL,R=0.999 6,图 3A)。利用直线回归方程计算出载药磁性纳米复合粒的载药量为(20.36±0.67)%,S=0.600 6(n=3);包封率为(83.71±0.53)%,S=0.746 1 (n=3)。在磁性载药纳米复合粒的体外pH响应性释药实验中,以pH 5.5和pH 7.4的PBS溶液作为释放介质,结果(图 3B)显示在pH 5.5的PBS溶液中药物48 h累积释放率高达70%,高于pH 7.4(50%),差异有统计学意义(P<0.05),根据药物累积释放曲线可以看到载药体系Fe3O4@SiO2@PEG-b-PAsp@DOX的释药具有pH响应性。

|
图 3 DOX溶液的紫外吸收和光密度-浓度标准曲线(A)及药物的pH响应性释放曲线(B) Fig 3 Ultraviolet absorption curve and standard curve of absorbance-concentration of DOX solution (A) and pH sensitivity release curve of drugs in vitro (B) DOX: Doxorubicin. *P<0.05 vs pH 7.4. n=3, x±s |
利用人肺癌A549细胞并借助于DOX的自身红色荧光观察肿瘤细胞对载药磁性纳米复合粒的摄取情况。光镜下可见细胞中黑色纳米粒子的摄入和聚集(图 4A),在荧光显微镜下可看到DOX的红色荧光(图 4B)与细胞核染的蓝色荧光(图 4C)重合(图 4D),表明载有DOX的磁性纳米复合粒被细胞摄取后,DOX在细胞质中释放并能够有效进入细胞核。
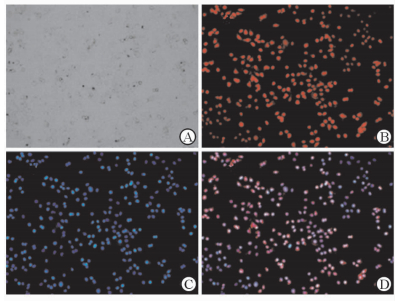
|
图 4 荧光显微镜下Fe3O4@SiO2@PEG-b-PAsp@DOX的细胞摄取情况 Fig 4 Cellular uptake of Fe3O4@SiO2@PEG-b-PAsp@DOX under fluorescent microscope A: Bright-field image; B: DOX; C: DAPI; D: Fe3O4@SiO2@PEG-b-PAsp@DOX. PEG: Polyethylene glycol; PAsp: Polyaspartic acid; DOX: Doxorubicin; DAPI: 4’6-diamidino-2-phenylindole. Original magnification: ×200 |
室温磁滞回线测定表明,Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2@PEG-b-PAsp@DOX的磁饱和强度Ms分别为48.07、13.7和10.97 A·m2/kg,矫顽力Hc均为0 A/m,表明经过修饰的Fe3O4@SiO2@PEG-b-PAsp@DOX纳米粒复合仍然具有良好的超顺磁性和磁饱和强度。在外界磁场作用下的聚集实验中,载药磁性纳米复合粒在15 min内向施加磁场一侧有效聚集(图 5A)。通过对同一培养体系中施加和不施加外磁场的肿瘤细胞荧光强度的测定(图 5B),可以发现施加外界磁场侧的细胞荧光强度(39.28)强于未施加外界磁场侧(27.29),差异具有统计学意义(P<0.05),表明该载体材料能在外界磁场作用下定向聚集,被肿瘤细胞更有效的摄取。

|
图 5 室温磁滞回线(A)和流式细胞术(B)示不同培养条件下A549细胞的荧光强度 Fig 5 Room temperature magnetic hysteresis curve(A) and flow cytometry(B) showing the fluorescence intensity of A549 cells under different culture conditions a: Complete medium; b: Fe3O4@SiO2@PEG-b-PAsp; c: Fe3O4@SiO2@PEG-b-PAsp@DOX; d: Under the magnetic field of Fe3O4@SiO2@PEG-b-PAsp@DOX. PEG: Polyethylene glycol; PAsp: Polyaspartic acid; DOX: Doxorubicin |
采用CCK-8法考察载药体系对A549细胞的毒性,结果(图 6A)发现空白载体Fe3O4@SiO2@PEG-b-PAsp自身的细胞毒性很小; 而载药体系DOX与Fe3O4@SiO2@PEG-b-PAsp@DOX对细胞的杀伤作用均随着浓度的增加而增强,差异具有统计学意义(P<0.05,图 6B)。
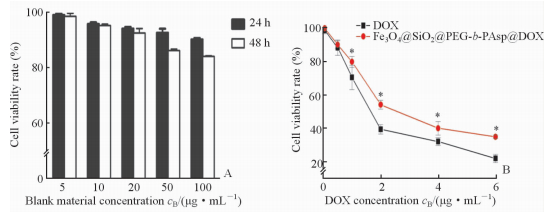
|
图 6 空白载体(A)及载药系统(B)对A549细胞的细胞毒性 Fig 6 Cytotoxicity of blank carrier (A) and the delivery system(B) to human lung cancer A549 cells PEG: Polyethylene glycol; PAsp: Polyaspartic acid; DOX: Doxorubicin. *P<0.05 vs DOX. n=3, x±s |
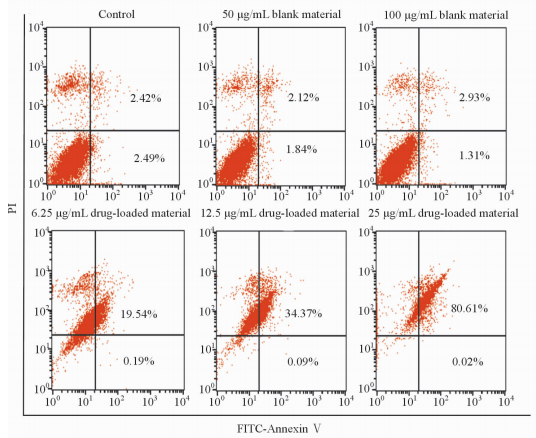
利用Annexin Ⅴ-FITC/PI 双染法对载药体系诱导A549细胞凋亡的测定结果发现,空白载体Fe3O4@SiO2@PEG-b-PAsp并未诱导细胞凋亡产生,而载药体系Fe3O4@SiO2@PEG-b-PAsp@DOX诱导A549细胞的凋亡呈现出明显的剂量依赖性(图 7)。
|
图 7 空白载体Fe3O4@SiO2@PEG-b-PAsp和 载药体系Fe3O4@SiO2@PEG-b-PAsp@DOX 对A549细胞凋亡的影响 Fig 7 Flow cytometry showing apoptosis of A549 cells induced by blank material Fe3O4@SiO2@PEG-b-PAsp and drug-loaded material Fe3O4@SiO2@PEG-b-PAsp@DOX PEG: Polyethylene glycol; PAsp: Polyaspartic acid; DOX: Doxorubicin |
本研究首先通过水热法合成了Fe3O4磁性纳米粒,为提高Fe3O4磁性纳米粒的稳定性并降低其聚合作用,通过Stöber法和溶胶凝胶法在Fe3O4磁性纳米粒表面包覆上SiO2层,最后通过酰胺化反应将pH响应性的聚合物载药材料PEG-b-PAsp与氨基化的SiO2层交联构建形成药物载体系统。以DOX为模型药物制备出Fe3O4@SiO2@PEG-b-PAsp@DOX,其平均粒径为(197.7±1.5)nm、zeta电位(-35.9±0.6)mV。利用DOX自身的氨基通过静电作用负载在Fe3O4@SiO2@PEG-b-PAsp上,在酸性环境中两者之间的静电力作用消失,加快了DOX的释放速率[15]。DOX可有效诱导肿瘤细胞的凋亡[16, 17, 18],本研究体外靶向性抗肿瘤的研究结果表明,该磁性纳米粒具备相对良好的生物安全性,同时可以有效地负载DOX定向进入细胞并可控地释放药物,且对肿瘤细胞的杀伤效果较为显著。
DOX之所以能够负载在磁性纳米复合粒上,是由于自身的氨基在中性或者偏碱性环境中能够与纳米复合粒表面聚天冬氨酸链段的羧基发生静电作用,在载药过程中加入适当量的三乙胺调节反应体系的pH并充分搅拌,可以提高DOX的载药量。而在偏酸性环境中DOX的氨基与高分子链段羧基间的静电力作用消失,因此可以体现出药物释放的pH响应性。
本研究构建的pH响应性的载药磁性纳米复合粒能够有效的负载抗肿瘤药物,表现出显著的药物pH响应性释放和磁靶向性,有望在外磁场作用下靶向到达肿瘤病灶部位,实现在肿瘤部位可控的释放药物的目的,最终提高抗肿瘤药物的生物利用度、减小抗肿瘤药物的化疗不良反应,为pH响应性磁靶向载药系统作为抗肿瘤药物传递系统的研究提供了有益探索。
| [1] | Norwood W D, Fuqua P A, Mancuso T F. Asbestos-an environmental health hazard[J]. Northwest Med, 1967, 66: 821-828. |
| [2] | Poonthananiwatkul B, Howard R L, Williamson E M, Lim R H. Cancer patients taking herbal medicines: a review of clinical purposes, associated factors, and perceptions of benefit or harm[J]. J Ethnopharmacol, 2015: 58-66. |
| [3] | Nygaard I. Balancing innovation and harm[J]. Am J Obstet Gynecol, 2014, 210: 383-384. |
| [4] | Chen Y C, Kok V C, Chien C H, Horng J T, Tsai J J. Cancer risk in patients aged 30 years and above with type 2 diabetes receiving antidiabetic monotherapy: a cohort study using metformin as the comparator[J]. Ther Clin Risk Manag, 2015, 11: 1315-1323. |
| [5] | Zou Y, Liu P, Liu C H, Zhi X T. Doxorubicin-loaded mesoporous magnetic nanoparticles to induce apoptosis in breast cancer cells[J]. Biomed Pharmacother, 2015, 69: 355-360. |
| [6] | Mu B, Liu P, Pu Q. A functional cross linked polymeric nanocapsule with pH-responsive brushes on its inner wall: preparation, characterization and controlled release[J]. React Funct Polym, 2010, 70: 578-584. |
| [7] | Felber A E, Dufresne M H, Leroux J C. pH-sensitive vesicles, polymeric micelles, and nanospheres prepared with polycarboxylates[J]. Adv Drug Deliv Rev, 2012, 64: 979-992. |
| [8] | Liu J, Sun Z, Deng Y, Zou Y, Li C, Guo X, et al. Highly water-dispersible biocompatible magnetite particles with low cytotoxicity stabilized by citrate groups[J]. Angew Chem Int Ed Engl, 2009, 48: 5875-5879. |
| [9] | Lu Y, Yin Y D, Mayers B T, Xia Y N. Modifying the surface properties of superparamagnetic iron oxide nanoparticles through a sol-gel approach [J]. Nano Lett, 2002, 2: 183-186. |
| [10] | 刘 赣.聚合物纳米载体的制备及其对蛋白质的投递[D].天津:南开大学, 2014. |
| [11] | 武 承林, 贺 欢, 高红军, 刘 赣, 马如江, 安英丽, 等.Fe3O4@SiO2@polymer复合粒子的制备及在药物控制释放中的应用[J].中国科学:化学, 2010, 40:269-275. |
| [12] | Vu F, Guinand S, Pasche O, Zürcher S, Ronga A, Arnold C, et al. [2014 literature findings in internal general medicine] [J]. Rev Med Suisse, 2015, 11: 174, 176-180. |
| [13] | 朱 杰, 廖 蕾, 朱丽娜, 孔继烈, 刘宝红.叶酸功能化介孔碳纳米球负载阿霉素的细胞靶向传递及可控释放[J].化学学报, 2013, 71:69-74. |
| [14] | Fang J H, Lai Y H, Chiu T L, Chen Y Y, Hu S H, Chen S Y, et al. Magnetic core-shell nanocapsules with dual-targeting capabilities and co-delivery of multiple drugs to treat brain gliomas[J]. Adv Healthc Mater, 2014, 3: 1250-1260. |
| [15] | Kojima C, Suehiro T, Watanabe K, Ogawa M, Fukuhara A, Nishisaka E, et al. Doxorubicin-conjugated dendrimer/collagen hybrid gels for metastasis-associated drug delivery systems[J]. Acta Biomater, 2013, 9: 5673-5680. |
| [16] | Jain A, Kesharwani P, Garg N K, Jain A, Jain S A, Jain A K, et al. Galactose engineered solid lipid nanoparticles for targeted delivery of doxorubicin[J]. Colloids Surf B Biointerfaces, 2015, 134: 47-58. |
| [17] | Attia S M, Bakheet S A. Effect of dihydrokainate on the capacity of repair of DNA damage and apoptosis induced by doxorubicin[J]. Mutagenesis, 2013, 28: 257-261. |
| [18] | 帅 怡, 郭 隽, 彭双清, 张立实.金属硫蛋白抑制阿霉素引起的心肌细胞凋亡作用研究[J].四川大学学报(医学版), 2007, 38:620-623. |
 2016, Vol. 37
2016, Vol. 37


