2. 暨南大学医学院生物化学教研室, 广州 510632;
3. 暨南大学附属第一医院普外科, 广州 510632
2. Department of Biochemistry, Medical College, Jinan University, Guangzhou 510632, Guangdong, China;
3. Department of General Surgery, First Affiliated Hospital, Jinan University, Guangzhou 510632, Guangdong, China
胃癌起源于胃黏膜上皮,病因复杂、发病率高,是消化道最常见的恶性肿瘤,病死率在所有恶性肿瘤中居第2位[1]。化学药物治疗是肿瘤治疗的重要手段之一,但是由于化学药物存在细胞毒性大及易产生肿瘤耐药性的缺点,因此天然药物的开发成为抗肿瘤药物研究的热点之一。随着中药研究逐步深入,人们发现并证实了许多对肿瘤有治疗作用的中药,如槐耳[2]、康莱特注射液[3]、华蟾素片[4]等,这些中草药制剂已在临床上取得了让人欣喜的治疗效果。黄酮类化合物已经被证实具有广泛的药理学作用,包括抗菌、保护心血管、解痉、祛痰、抑制酶活性、免疫调节、抗氧化、抗辐射、利尿等[5, 6]。木犀草素作为一种天然的黄酮类化合物,具有上述各种药理学作用,而且有大量关于木犀草素抑制恶性肿瘤增殖的文献报道[7, 8, 9, 10],发现其主要通过诱导凋亡和使细胞发生周期阻滞等方式来抑制恶性肿瘤细胞。为了解木犀草素对胃癌细胞生长的影响并初步探索其作用机制,本实验探讨了木犀草素对胃癌MGC803细胞的生长抑制、细胞周期阻滞、致凋亡及致自噬作用,为研究开发抗癌新药提供实验依据。
1 材料和方法 1.1 实验材料胃癌细胞株MGC803由暨南大学生物化学教研室刘誉教授惠赠。木犀草素(含量98%)购自西安飞达生物有限公司,用DMSO溶解成100 mmol/L,分装,贮存于-20℃。RPMI 1640 培养液、新生牛血清购自Gibco 公司;AnnexinⅤ-PI 双染试剂盒购自美国BD公司; GAPDH、Bax、CDK4、CDK6、CyclinD1、CyclinD3、CyclinE2、CyclinA、CyclinB、Myt1、p-cdc2(Tyr15)、LC3、Beclin-1抗体及细胞裂解液购自美国Cell Signaling Technology (CST)公司;PARP、p62、Bcl-2、Bcl-xL、Mcl-1、cleaved-Caspase-3的抗体购于美国Epitomics公司;pro-Caspase-8、pro-Caspase-3、pro-Caspase-9、p-Wee1抗体购自SAB(Signalway Antibody)公司;自噬阻断剂BafilomycinA1购自Santa Cruz公司。
1.2 细胞培养胃癌细胞MGC803用含10%新生牛血清的RPMI 1640 培养液培养,置37℃、5% CO2培养箱中,每2~3 d用0.25%胰蛋白酶消化传代培养,实验选用对数生长期细胞。
1.3 MTT法检测细胞增殖抑制取对数生长期的细胞,用含10%新生牛血清的RPMI 1640培养液调细胞密度为5×104/mL,每孔100 μL接种到96孔板,即每孔细胞数为5 000。孔板周边空孔加少许PBS,以防培养孔内培养液蒸发,置37℃、5% CO2培养箱培养24 h。每孔加入木犀草素至其终浓度分别为0、12.5、25、50、100 μmol/L,DMSO对照组浓度≤0.1%,高浓度药物组含有DMSO浓度为0.8%。继续于培养箱中培养24、48、72 h后,取出96孔板,培养孔每孔加入20 μL MTT试剂,放入培养箱中继续培养4~6 h;取出孔板清除孔内液体,然后每孔加入150 μL DMSO,再置于微板振荡器振荡10 min左右,立即于酶标仪检测光密度值(D570)。根据公式计算各组细胞增殖抑制率:增殖抑制率(%) =(1-D实验组/D对照组) ×100%。利用CalcuSyn软件计算药物的IC50。
1.4 克隆形成抑制实验取对数生长期的胃癌细胞MGC803,制成细胞悬液后调节细胞密度为500/mL,然后接种于12孔板,每孔1 mL细胞悬液。每组设2个复孔,置于培养箱培养24 h后加木犀草素,每孔加入木犀草素后终体积为2 mL(不足体积以含血清RPMI 1640培养液补齐),使木犀草素终浓度分别为0、1.25、2.5、5、10 μg/mL,DMSO组浓度为0.1%。继续于CO2培养箱中培养7 d,取出孔板,去除培养液,PBS洗涤2次,加入固定液甲醇∶冰醋酸(3∶1),10 min后晾干,然后结晶紫染色15 min,接着流水冲洗,以洗净染色液,晾干后记细胞克隆数并拍照。
1.5 PI单染法检测细胞周期的改变取对数生长期的MGC803细胞,调制密度为4.0×105/mL的细胞悬液。取6孔培养板一块,每孔加入1 mL新鲜的培养液,再加入细胞悬液500 μL,使每孔的细胞数为2.0×105,置于CO2培养箱中培养24 h,然后加木犀草素至其终浓度为0、12.5、25、50 μmol/L,DMSO组浓度≤0.1%。此时每孔终体积为1.6 mL(不足体积以含血清RPMI 1640培养液补齐)。继续培养48 h后消化收集细胞,用预冷的PBS液洗涤细胞3次后,70%乙醇固定,保存于4℃冰箱过夜。次日再用4℃预冷的PBS洗涤细胞2次,加入PI染色液,使PI作用的终浓度为40 mg/L,避光染色30 min。流式细胞仪检测细胞DNA含量,不同木犀草素作用浓度组都随机分析10 000个细胞。
1.6 AnnexinⅤ-PI 双染法测定细胞凋亡取对数生长期的MGC803细胞,调制密度为4.0×105/mL的细胞悬液。取6孔培养板一块,每孔加入1 mL新鲜的培养液,再加入细胞悬液500 μL,使每孔的细胞数为2.0×105,置于CO2培养箱培养24 h。24 h后加入不同浓度的木犀草素,使每孔终体积为1.6 mL,木犀草素的作用浓度为12.5、25、50 μmol/L,继续培养48 h。用预冷的 PBS洗涤细胞3次,再加入200 μL的结合缓冲液重悬细胞,然后分别加入5 μL PI和10 μL AnnexinⅤ-FITC,避光染色后立即将标本置于冰上处理,将处理好的细胞置于流式细胞仪中检测,观察其凋亡情况。
1.7 蛋白质印迹法检测蛋白表达变化木犀草素处理48 h后收集悬浮及贴壁的细胞,950×g离心10 min,用PBS洗2次,吸尽PBS;加入细胞裂解液于冰上裂解15 min,1 200×g离心15 min,收集上清液。经BCA法测蛋白浓度后,等量样品以体积分数为10%~15%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质。电泳后将蛋白转印至PVDF膜上。用体积分数5%的脱脂奶粉封闭后,一抗封闭过夜,再以二抗封闭液常温封闭2 h,ECL发光液孵育后置于CCD成像系统显影,保存结果。同时检测自噬的发生,用木犀草素处理48 h,除在收蛋白6 h前加BafilomycinA1外,其他操作和蛋白印迹法检测蛋白表达变化的步骤一致。
1.8 统计学处理用SPSS 13.0统计软件处理数据。计量资料以 x±s 表示,采用完全随机设计的单因素方差分析(One-way ANOVA)比较组间差异。检验水准(α)为0.05。
2 结 果 2.1 木犀草素对胃癌细胞MGC803的增殖抑制作用不同浓度的木犀草素作用于MGC803细胞24、48和72 h后,与对照组(DMSO和0 μmol/L木犀草素为双重对照)相比均有增殖抑制作用(P<0.05),IC50分别为127.37、76.12、16.84 μmol/L。随着时间的增加,木犀草素对胃癌MGC803细胞的增殖抑制作用更加明显,表明木犀草素以剂量-时间依赖的方式抑制MGC803细胞的增殖(图 1)。
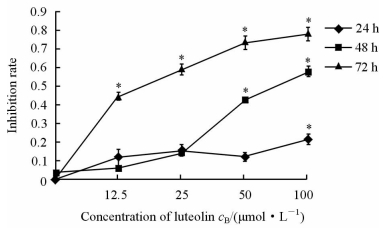
|
图 1 木犀草素对胃癌细胞MGC803增殖的抑制作用 Fig 1 Proliferation inhibition of MGC803 cells by luteolin Various concentrations of luteolin were added, and the cells were incubated for 24, 48 and 72 h. * P<0.05 vs 0 μmol/L luteilin at same time. n=3, x±s |
不同浓度的木犀草素作用于MGC803细胞7 d后,细胞的克隆形成数逐渐减少,尤其浓度为10 μmol/L的实验组,与对照组(DMSO和0 μmol/L木犀草素为双重对照)相比有明显的差异(图 2)。
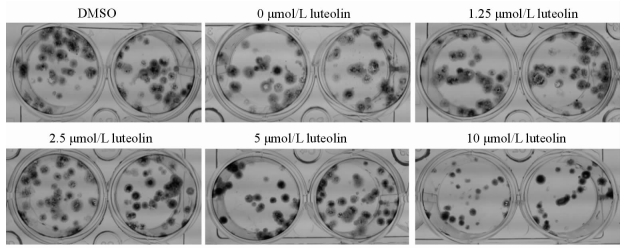
|
图 2 木犀草素对MGC803细胞克隆形成的影响 Fig 2 Effects of luteolin at different concentrations on MGC803 cell colony formation |
不同浓度的木犀草素作用于MGC803细胞48 h后,与DMSO组和0 μmol/L组两个对照组相比,随着药物浓度的增加,G1期细胞比例逐渐减少,S期比例基本不变,G2/M 期比例逐渐增加;其中G2期由DMSO组的9.1%和0 μmol/L组的8.3%增加到25 μmol/L的19.7%(图 3)。
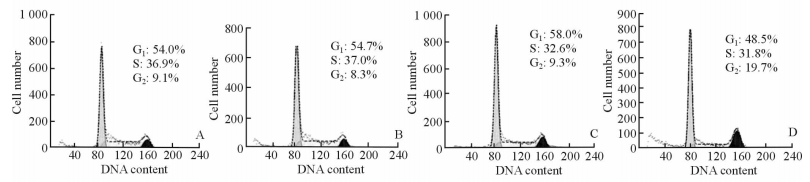
|
图 3 木犀草素对MGC803细胞周期的影响 Fig 3 Effect of luteolin at different concentrations on cell cycle arrest in MGC803 cells A: DMSO; B: 0 μmol/L luteolin; C: 12.5 μmol/L luteolin; D: 25 μmol/L luteolin |
木犀草素作用于MGC803细胞48 h 后,随着药物浓度的增加,CDK4、CDK6、CyclinE2表达减少,CyclinD1、CyclinD3和p-Wee1表达基本不变,CyclinA、CyclinB、Myt1、p-cdc2(Tyr15)表达增高(图 4)。
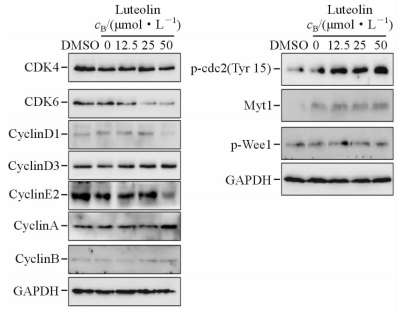
|
图 4 蛋白质印迹法检测周期相关蛋白的表达 Fig 4 Expression of cell cycle-associated proteins was analyzed by Western blotting after exposure to different concentrations of luteolin |
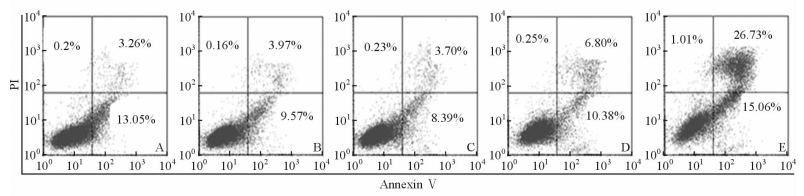
不同浓度的木犀草素作用于MGC803细胞48 h后,细胞的早期凋亡率和晚期凋亡率会随着药物浓度的增加而增多;50 μmol/L组变化最明显,由DMSO组的16.31%和0 μmol/L组的13.54%增加到41.79%(图 5)。
|
图 5 AnnexinⅤ-PI双染法检测木犀草素对细胞凋亡的影响 Fig 5 Effect of luteolin on apoptosis in MGC803 cells after exposure to different concentrations of luteolin A: DMSO; B: 0 μmol/L luteolin; C: 12.5 μmol/L luteolin; D: 25 μmol/L luteolin; E: 50 μmol/L luteolin |
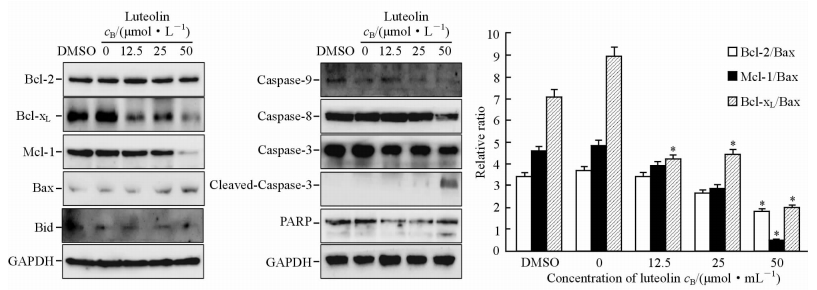
不同浓度木犀草素作用MGC803细胞48 h后,抗凋亡蛋白Mcl-1及Bcl-xL、Caspase-3、Caspase-8、Caspase-9蛋白表达随药物浓度增加而减少,而抗凋亡蛋白Bcl-2表达量变化不大,促凋亡蛋白Bax表达量增加,因而引起Bcl-2/Bax、Mcl-1/Bax和Bcl-xL/Bax的比例下降;同时还可见到Caspase-3和PARP出现了切割的条带(图 6)。
|
图 6 蛋白印迹法检测凋亡相关蛋白的表达 Fig 6 Expression of apoptosis associated protein in MGC803 cells after exposure to different concentrations of luteolin *P<0.05 vs DMSO or 0 μmol/L luteolin. n=3, x±s |
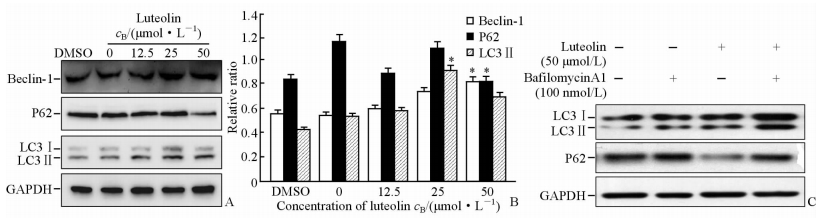
不同浓度的木犀草素作用于MGC803细胞后,随着药物浓度的增加,P62表达下降,而LC3Ⅱ 和Beclin-1的表达增加(图 7A、7B)。而用木犀草素处理48 h时在收蛋白6 h前加BafilomycinA1,结果出现LC3Ⅱ和P62的累积,表明木犀草素诱导MGC803细胞发生自噬(图 7C)。
|
图 7 蛋白印迹法检测自噬相关蛋白的表达 Fig 7 Expression of cell autophagy proteins was analyzed by Western blotting analysis after exposure to different concentrations of luteolin A, B: MGC803 cells were incubated with different concentrations of luteolin for 48 h; C: MGC803 cells were incubated with luteolin at 50 μmol/L for 48 h and BafilomycinA1 for 6 h. *P<0.05 vs DMSO or 0 μmol/L luteolin. n=3, x±s |
中药抗肿瘤研究由来已久,许多体外抗肿瘤研究的实验均采用从中草药中提取单体成分,如去氢骆驼蓬碱、水飞蓟宾等[11],这些研究为中草药应用于临床抗肿瘤治疗提供了理论基础。木犀草素是一种多靶点的抗肿瘤药物[7, 8, 9, 10],陈庆等[12]的研究发现,木犀草素对于正常的肝细胞L02毒副作用小。有证据表明木犀草素可以像喜树碱类抗癌药物一样,能够诱导拓扑异构酶Ⅱ相关的DNA损伤从而诱导HeLa-60细胞发生凋亡[13],可以通过周期阻滞诱导肝癌细胞发生凋亡[8]等。但是在胃癌细胞中相关研究甚少,更没有确切的机制报道。本实验显示木犀草素对胃癌MGC803细胞有较强的增殖抑制作用,且表现出明显的剂量-时间依赖性。
Wu等[14]发现木犀草素能够使胃癌细胞AGS阻滞在G2期。细胞周期阻滞包括G1期阻滞和G2/M期阻滞,其中G2/M期阻滞更具普遍性。研究表明细胞周期中G2/M 检查点是细胞存活和死亡的主要决定点[15]。在G2/M期检查点,一方面Cip/Kip家族成员通过抑制CDK1(cdc2)的活性发挥其作用[16, 17],另一方面Wee1可以通过磷酸化CDKs的活性位点酪氨酸残基(大部分CDKs为Tyr15)而起抑制作用。除此以外,Myt1可以磷酸化Tyr15和Thr14这2个邻近的位点,起到抑制作用[17]。本实验中随木犀草素浓度增加,G1期细胞比例减少,S期比例基本不变,而G2期比例增加。我们对周期相关蛋白检测发现CyclinD1、CyclinD3和p-Wee1表达基本不变,CyclinE2表达减少,CyclinA、CyclinB和Myt1、p-cdc2(Tyr15)表达增高,表明木犀草素能够使胃癌细胞MGC803抑制在G2期。
PARP是DNA修复酶,也是Caspase-3的作用底物,所以PARP又被称为死亡底物。PARP蛋白的剪切是细胞凋亡的标志,线粒体凋亡途径是重要的凋亡途径,Bcl-2家族蛋白在线粒体扮演着非常关键的角色,其中的促凋亡蛋白和抗凋亡蛋白的比例决定着细胞是走向凋亡还是继续存活。抗凋亡蛋白表达的增加会抑制CytoC等促凋亡因子从线粒体释放,而促凋亡蛋白的表达增加则导致CytoC等促凋亡因子大量释放[18];这些促凋亡因子将会激活细胞质中的Caspase,继而发生级联反应,导致凋亡的发生。在Bcl-2蛋白家族中,Bax通过促进线粒体PTP孔的开放,使线粒体内促凋亡因子释放而导致凋亡的发生,而Bcl-2、Bcl-xL则抑制PTP孔的开放而抵抗细胞凋亡的发生[19, 20]。在本实验中随着木犀草素浓度的增加,PARP的剪切增加,同时Caspase-3的活化量也逐渐增加;Mcl-1、Bcl-xL的表达减少,Bcl-2表达量变化不大,Bax表达增加,引起Bcl-2/Bax、Mcl-1/Bax和Bcl-xL/Bax比例下降,表明木犀草素作用于MGC803细胞后通过线粒体途径使其发生凋亡。
细胞自噬是一个复杂的过程,许多蛋白参与其中,这提示我们可以通过检测一些重要蛋白的表达变化来明确细胞是否发生了自噬。Beclin-1、LC3、P62是自噬过程中3个比较重要的蛋白[21, 22, 23]。在本次实验中可以看到P62表达下降,而LC3 Ⅱ表达增加,表明木犀草素也可以使细胞发生自噬。总之木犀草素引起胃癌细胞MGC803的凋亡是通过线粒体通路实现的,同时伴有细胞自噬性死亡,但是木犀草素通过哪种具体的信号途径发挥作用有待进一步研究。
| [1] | Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study[J]. Histopathology, 2008, 52: 797-805. |
| [2] | 吴志慧, 蒋建伟, 曹明溶, 陈 涛, 张小鹰, 吴风云.槐耳清膏诱导胃癌SGC7901细胞凋亡的实验研究[J].上海交通大学学报( 医学版), 2009, 29:370-373. |
| [3] | 陈 军, 马 岩, 李 榆, 秦 龙, 姚 莉.康莱特注射液对人乳腺癌MCF-7细胞增殖和凋亡的影响[J].中国中医药信息杂志, 2014, 21:48-51. |
| [4] | 郝春蕾.华蟾素治疗恶性肿瘤及其不良反应[J].中国药师, 2007, 10:704-706. |
| [5] | Horváthová K, Chalupa I, Šebová L, Tóthová D, Vachálková A. Protective effect of quercetin and luteolin in human melanoma HMB-2 cells[J]. Mutat Res-Fund Mol M, 2005, 565: 105-112. |
| [6] | Zhang X, Guo Q, Chen J, Chen Z. Quercetin enhances cisplatin sensitivity of human osteosarcoma cells by modulating microRNA-217-KRAS Axis[J]. Mol Cells, 2015, 38: 638-642. |
| [7] | Lee H J, Wang C J, Kuo H C, Chou F P, Jean L F, Tseng T H. Induction apoptosis of luteolin in human hepatoma HepG2 cells involving mitochondria translocation of Bax/Bak and activation of JNK[J]. Toxicol Appl Pharmacol, 2005, 203: 124-131. |
| [8] | Leung H W, Wu C H, Lin C H, Lee H Z. Luteolin induced DNA damage leading to human lung squamous carcinoma CH27 cell apoptosis[J]. Eur J Pharmacol, 2005, 508: 77-83. |
| [9] | Ong C S, Zhou J, Ong C N, Shen H M. Luteolin induces G1 arrest in human nasopharyngeal carcinoma cells via the Akt-GSK-3β-Cyclin D1 pathway[J]. Cancer Lett, 2010, 298: 167-175. |
| [10] | Yu D, Li M, Tian Y, Liu J, Shang J. Luteolin inhibits ROS-activated MAPK pathway in myocardial ischemia/reperfusion injury[J]. Life Sci, 2015, 122: 15-25. |
| [11] | 杨传标, 徐克成.中药的抗肿瘤作用[J].国际医药卫生导报, 2004, 10:9-12. |
| [12] | Chen Q, Liu S, Chen J, Zhang Q, Lin S, Chen Z, et al. Luteolin induces mitochondria-dependent apoptosis in human lung adenocarcinoma cell[J]. Nat Prod Commun, 2012, 7: 29-32. |
| [13] | Yamashita N, Kawanishi S. Distinct mechanisms of DNA damage in apoptosis induced by quercetin and luteolin[J]. Free Radic Res, 2000, 33: 623-633. |
| [14] | Wu B, Zhang Q, Shen W, Zhu J. Anti-proliferative and chemosensitizing effects of luteolin on human gastric cancer AGS cell line[J]. Mol Cell Biochem, 2008, 313: 125-132. |
| [15] | 邹向阳, 李连宏.细胞周期调控与肿瘤[J].国际遗传学杂志, 2006, 29:70-73. |
| [16] | Schwermer M, Lee S, Köster J, van Maerken T, Stephan H, Eggert A, et al. Sensitivity to cdk1-inhibition is modulated by p53 status in preclinical models of embryonal tumors[J]. Oncotarget, 2015, 6: 15425-15435. |
| [17] | Wang Z, Slipicevic A, Frsund M, Trope C G, Nesland J M, Holm R. Expression of CDK1 Tyr15, pCDK1 Thr161, Cyclin B1 (total) and pCyclin B1 Ser126 in vulvar squamous cell carcinoma and their relations with clinicopatological features and prognosis[J]. PLoS One, 2015, 10: e0121398. |
| [18] | Adams J M, Cory S.The Bcl-2 apoptotic switch in cancer development and therapy[J]. Oncogene, 2007, 26: 1324-1337. |
| [19] | 孟祥东.BCL-2家族与线粒体对细胞凋亡的调控[J].细胞与分子免疫学杂志, 2005, 21(S1):77-79. |
| [20] | 施 勤, 刘继明, 张学光.细胞凋亡的线粒体调控与Bcl-2基因家族[J].现代免疫学, 2000, 20:59-61. |
| [21] | Jin S, White E. Role of autophagy in cancer: management of metabolic stress[J]. Autophagy, 2007, 3: 28-31. |
| [22] | Klionsky D J, Abdalla F C, Abeliovich H, Abraham R T, Acevedo-Arozena A, Adeli K, et al. Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2012, 8: 445-544. |
| [23] | Pankiv S, Clausen T H, Lamark T, Brech A, Bruun J A, Outzen H, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J]. J Biol Chem, 2007, 282: 24131-24145. |
 2016, Vol. 37
2016, Vol. 37


