2. 第三军医大学附属新桥医院泌尿外科重点实验室, 重庆 400037;
3. 重庆市中山医院ICU, 重庆 400013
2. Key Laboratory of Urology, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China;
3. Department of ICU, Chongqing Zhongshan Hospital, Chongqing 400013, China
2型糖尿病是当前威胁全球人类健康的最重要的慢性非传染性疾病之一,根据国际糖尿病联盟统计,2011年全球糖尿病患者人数已达3.7亿,其中80%分布于包括我国在内的发展中国家[1]。大量研究显示,糖尿病患者除了持续高浓度的血糖及部分胰岛素抵抗外,还伴随着不同程度的脂代谢紊乱,而后者具有诱发血管病变的作用[2]。游离脂肪酸(包括软脂酸和油酸)是脂类代谢中最活跃的部分,2型糖尿病患者上述两类脂肪酸的水平均出现明显升高[3]。然而,脂肪酸究竟怎样诱发胰岛微血管的病变进而导致胰岛功能损伤的机制目前仍不清楚,如何有效干预糖尿病患者血管病变的进展和迁移过程更是鲜有报道。有学者认为,胰岛微血管内皮细胞功能的损害是触发2型糖尿病患者血管病变发生的关键病理过程,靶向调节该环节具有遏制血管病变的重要作用[4]。
山萘酚属于黄酮醇类化合物,广泛存在于水果、蔬菜、豆类等植物中,具有抗氧化、抗肿瘤、消炎和抑制血小板聚集等生物学作用[5]。动物实验研究发现,适量的山萘酚摄入能够显著抑制肥胖,降低心血管疾病的发生率,同时还可作为血管紧张素转换酶抑制剂用于血压的控制[6]。体外实验表明,山萘酚可诱导甲状腺激素的合成,增加环磷酸腺苷的生成,从而提高细胞能量代谢和脂肪代谢的能力[7]。更为重要的是,有研究发现,山萘酚还能控制糖尿病动物的血糖水平、仿胰岛素、刺激肌糖原合成[8]。然而,山萘酚是否具有拮抗糖尿病患者血管病变的效应目前仍未见报道。据此,本研究以小鼠胰岛微血管内皮MS-1细胞为研究对象,探讨山萘酚对脂肪酸诱导的胰岛微血管内皮功能损伤的保护效应及关键调控基因多聚腺苷二磷酸核糖聚合酶1[poly(ADP-ribose)polymerases-1,PARP-1]的作用,以期为防治2型糖尿病血管病变提供实验科学依据。
1 材料和方法 1.1 细胞及试剂小鼠胰岛微血管内皮MS-1细胞购自美国国立细胞库(American type culture collection,ATCC),编号:CRL-2279TM;四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]、软脂酸(palmitate,PA)、油酸(oleate,OA)均购于美国Sigma公司;山萘酚(纯度≥95.0%,溶解于二甲基亚砜,避光保存)购于上海康九化工有限公司;Dulbecco改良Eagle培养基(Dulbecco modified Eagle medium,DMEM)、胰蛋白酶、胎牛血清均购于美国Gibco公司;TUNEL细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;一氧化氮(nitric oxide,NO)、总一氧化氮合酶(total nitric oxide synthase,tNOS)、结构型一氧化氮合酶(constitutive NOS,cNOS)、诱导型一氧化氮合酶(inducible NOS,iNOS)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和还原型谷胱甘肽(glutathione,GSH)检测试剂盒均由南京建成生物工程研究所生产;活性氧(reactive oxygen species,ROS)探针购于北京索莱宝科技有限公司;总RNA提取试剂盒由南京凯基生物科技有限公司生产;TaKaRa反转录和荧光定量PCR扩增试剂盒均购于宝生物工程(大连)有限公司;PARP-1抑制剂BYK204165、PARP-1、iNOS和cNOS抗体均购自美国Santa Cruz公司;β-actin抗体和辣根过氧化物酶标记二抗均购自北京中杉金桥生物有限公司;其他试剂均为国产分析纯。
1.2 实验分组与处理MS-1细胞用含10%(体积分数)胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的DMEM培养液,于37℃、5.0%CO2、适当湿度条件下培养,待细胞生长至85%~90%融合时用于实验。实验分组如下:(1)正常对照组和溶剂对照组,分别用DMEM培养液和DMSO处理;(2)脂肪酸组,用0.25 mmol/L PA+0.5 mmol/L OA处理;(3)山萘酚组,用50 μmol/L山萘酚处理;(4)脂肪酸+山萘酚组,用50 μmol/L山萘酚+0.25 mmol/L PA+0.5 mmol/L OA处理;(5)PARP-1抑制剂+脂肪酸组,用8 μmol/L BYK204165预处理1 h+0.25 mmol/L PA+0.5 mmol/L OA处理;(6)PARP-1抑制剂+脂肪酸+山萘酚组,用8 μmol/L BYK204165预处理1 h + 0.25 mmol/L PA+0.5 mmol/L OA+50 μmol/L山萘酚处理。
1.3 MTT比色法检测细胞存活率将MS-1细胞以1×104/孔的密度接种于96孔板,37℃、5.0% CO2过夜培养至细胞贴壁,每种处理设置8个复孔;处理结束后,弃去培养液,加入新鲜配制的MTT溶液100 μL(0.5 mg/L),置于37℃孵箱中避光孵育4 h,然后吸尽全部液体,每孔加入100 μL二甲基亚砜,室温振荡5 min,待紫色结晶完全溶解后,利用美国Bio-Rad公司Model 580型酶标仪在570 nm波长处测定光密度(D)值,计算每个处理组的细胞存活率:细胞存活率(%)=D处理组/D对照组×100%。
1.4 TUNEL法检测细胞凋亡率将细胞以1×105/孔的密度接种于6孔板内的细胞爬片上,待细胞贴壁后,各组予以相应的干预处理;结束后,采用 TUNEL细胞凋亡检测试剂盒测定细胞的凋亡水平,操作步骤严格依据说明书执行,并计算各个处理组的细胞凋亡率:细胞凋亡率(%)=(凋亡细胞数/计数细胞总数)×100%,共计数500个细胞。
1.5 荧光定量PCR法检测PARP-1、iNOS、cNOS mRNA表达 1.5.1 引物设计与合成PCR引物的合成均由上海Invitrogen公司完成,引物序列参考文献[9, 10, 11]。目的基因PARP-1引物:上游5′-ATG CTA CCA CGC ACA AC-3′,下游5′-CCA ATC GGG TCT CCC T-3′;iNOS引物:上游5′-ATG GAA CAT CCC AAA TAC GA-3′,下游5′-GTC GTA GAG GAC CAC TTT GT-3′;cNOS引物:上游5′-TGG GGA CAT CAT TCT CGC CGT C-3′,下游5′-TGG TCT CCA GGT GTG TGG TGA A-3′。GAPDH引物:上游5′-GCG ATA CTC ACT CTT CTA CTT TCG A-3′,下游5′-TCG TAC CAG GAA ATG AGC TTG AC-3′。
1.5.2 总RNA提取收集处理后各组细胞,利用TRIzol法提取总RNA,整个提取过程严格按照说明书操作,同时利用NanoDrop 2000c分光光度计(美国Thermo公司)测定RNA浓度,取1 μg RNA反转录为cDNA(20 μL体系),反转录结束后将cDNA稀释,置于-80℃冰箱保存。
1.5.3 实时荧光定量PCR荧光定量PCR仪由美国Bio-Rad公司生产,型号TL988型。以25 μL体系模板量进行实时荧光定量PCR;PCR反应参数条件:95℃预变性5 min;95℃变性10 s、58℃(PARP-1)或60℃(iNOS、cNOS)退火15 s、72℃延伸20 s,持续40个循环;65~95℃绘制熔解曲线;选择SYBR Green Ⅰ/HRM Dye通道,读取Ct值;每个样本每种目的基因设置3个复孔,分别计算各样本各个基因的Ct值,以2-ΔΔCt方法进行定量分析,以GAPDH作为内参对照,并用GAPDH的Ct值进行校正。
1.6 蛋白质印迹法检测PARP-1、iNOS、cNOS蛋白表达处理结束后,收集细胞,裂解,取上清提取蛋白,取每个样本各30 μg蛋白行SDS-PAGE,转膜、室温封闭2 h,再分别孵育PARP-1一抗(1∶500)、iNOS一抗(1∶300)、cNOS一抗(1∶500)和β-actin(1∶400),4℃孵育过夜。洗涤后以1∶5 000的比例孵育辣根过氧化物酶标记的二抗,采用ECL化学发光后,用Bio-Rad凝胶成像系统显像,采用Image J软件进行蛋白定量分析,并用β-actin表达量予以校正。
1.7 NO含量以及tNOS、iNOS和cNOS活性的检测干预结束后胰酶消化收集细胞,冰上裂解1 h,离心取上清,-20℃保存备用。分别采用NO含量以及tNOS、iNOS和cNOS活性检测试剂盒测定每组细胞样本中上述各项指标的变化水平;并用BCA法测定的蛋白浓度予以校正。检测过程均按照说明书要求严格执行,利用7200型可见光分光光度计(上海尤尼柯仪器有限公司)读取光密度值。
1.8 ROS、GSH、MDA和SOD水平的检测以1 ×105/孔的密度将细胞接种于6孔板内事先放置的盖玻片(24 mm × 24 mm)上,处理结束后,洗涤细胞,加入终浓度为1.5 μmol/L的DCFH-DA探针,避光37℃孵育1 h,取出载玻片,吸尽探针残液,置于荧光显微镜488~525 nm波长下观察各组处理细胞的绿色荧光,采用Image Pro-Plus软件分析和计算平均光密度(average optical density,AOD)。将同期处理的细胞用胰酶消化收集,充分裂解后取上清液,利用GSH、MDA和SOD检测试剂盒分别予以测定,操作过程严格依据说明书要求,采用7200型可见光分光光度计读取光密度值。
1.9 统计学处理所有实验均独立重复3次,每种处理设置3个以上平行孔。所有数据均用SPSS 18.0软件予以整理和分析,且均采用 x±s 表示;符合正态分布且方差齐的资料,多组间的比较运用单因素方差分析,组间两两比较利用LSD-t检验;对不符合正态性或方差不齐的数据,多组间比较利用秩和检验。检验水准(α)为0.05。
2 结 果 2.1 山萘酚对脂肪酸诱导的MS-1细胞活力和凋亡的影响及PARP-1的作用脂肪酸处理后MS-1细胞存活率下降至41.94%,低于正常对照组(P<0.05),但脂肪酸+山萘酚组的存活率则可达77.30%,高于脂肪酸组(P<0.05,图 1A);脂肪酸诱导MS-1细胞凋亡水平升高,而山萘酚干预则可降低脂肪酸诱发的细胞凋亡水平(图 1B)。PARP-1抑制剂(BYK204165)+脂肪酸+山萘酚组的细胞活力和凋亡水平与正常对照组比较差异均无统计学意义(P>0.05)。
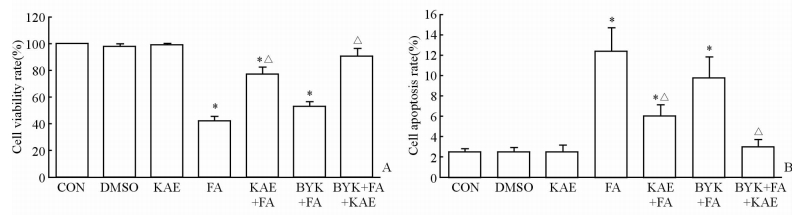
|
图 1 山萘酚对脂肪酸诱导的MS-1细胞活力(A)和凋亡(B)的影响及PARP-1的作用 Fig 1 Effects of kaempferol on fatty acid-induced MS-1 cell viability (A) and apoptosis (B) and the role of PARP-1 PARP-1: Poly (ADP-ribose) polymerase-1; CON: Control; DMSO: Dimethyl sulphoxide; KAE: Kaempferol; FA: Fatty acid; BYK: BYK204165 (PARP-1 inhibitor). *P<0.05 vs CON group; △P<0.05 vs FA group. n=3, x±s |
如图 2所示,脂肪酸处理增加了MS-1细胞内NO的含量,并且升高了tNOS、iNOS和cNOS的活性(P<0.05);而山萘酚干预处理则可改善上述指标的变化(P<0.05)。研究结果还显示,PARP-1抑制剂(BYK204165)+脂肪酸+山萘酚组的NO含量和3种NOS的活性与正常对照组比较差异无统计学意义(P>0.05),提示抑制PARP-1能够增强山萘酚对脂肪酸的拮抗效应。
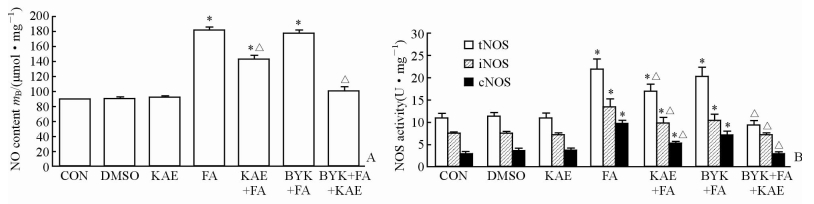
|
图 2 山萘酚对脂肪酸诱导的NO含量(A)及NOS活性(B)的影响及PARP-1的作用 Fig 2 Effects of kaempferol on fatty acid-induced NO content (A) and NOS activities (B) and the role of PARP-1 NO: Nitric oxide; NOS: Nitric oxide synthase; tNOS: Total NOS; iNOS: Inducible NOS; cNOS: Constitutive NOS; PARP-1: Poly(ADP-ribose) polymerase-1; CON: Control; DMSO: Dimethyl sulphoxide; KAE: Kaempferol; FA: Fatty acid; BYK: BYK204165 (PARP-1 inhibitor). *P<0.05 vs CON group; △P<0.05 vs FA group. n=3, x±s |
如图 3所示,脂肪酸处理后MS-1细胞的ROS水平急剧升高,脂质过氧化产物MDA含量增加,酶性抗氧化物质SOD的活性和非酶性抗氧化物质GSH的含量均降低(P<0.05);山萘酚干预处理后,ROS和MDA的水平均下降(P<0.05),SOD的活性和GSH含量均升高(P<0.05);而在抑制PARP-1的条件下,山萘酚对脂肪酸诱导的氧化应激的拮抗效应更为显著,各指标与正常对照组相比差异无统计学意义(P>0.05)。
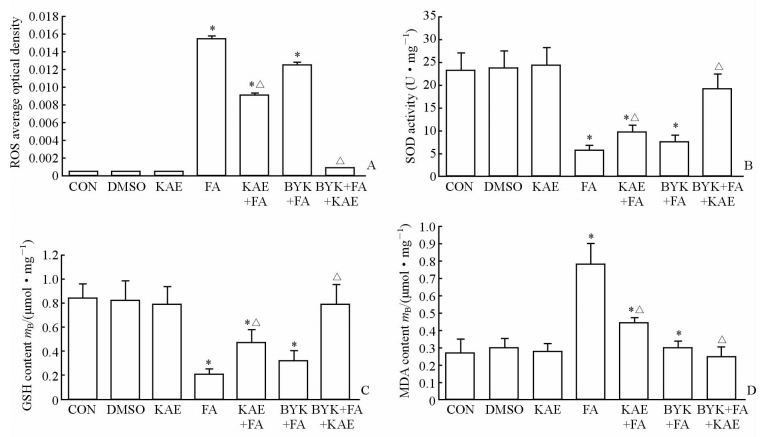
|
图 3 山萘酚对脂肪酸诱导的氧化应激损伤的影响及PARP-1的作用 Fig 3 Effects of kaempferol on fatty acid-induced oxidative stress and the role of PARP-1 A: ROS average optical density in each group; B: SOD activity in each group; C: GSH content in each group; D: MDA content in each group. PARP-1: Poly (ADP-ribose) polymerase-1; ROS: Reactive oxygen species; SOD: Superoxide dismutase; GSH: Glutathione; MDA: Malondialdehyde; CON: Control; DMSO: Dimethyl sulphoxide; KAE: Kaempferol; FA: Fatty acid; BYK: BYK204165 (PARP-1 inhibitor). *P<0.05 vs CON group; △P<0.05 vs FA group. n=3, x±s |
如图 4所示,脂肪酸处理可促使PARP-1、iNOS和cNOS的mRNA和蛋白表达量升高(P<0.05);但山萘酚干预后,3项指标的mRNA和蛋白表达均降低;而在抑制PARP-1的条件下,山萘酚对iNOS和cNOS表达的抑制作用更为显著,各指标与正常对照组相比差异无统计学意义(P>0.05)。
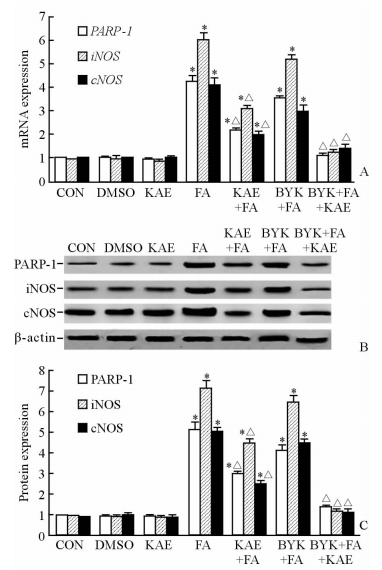
|
图 4 山萘酚对脂肪酸诱导的PARP-1、iNOS和cNOS异常表达的影响 Fig 4 Effects of kaempferol on fatty acid-induced PARP-1, iNOS and cNOS deregulation A: PARP-1, iNOS and cNOS mRNA expression level in each group; B: PARP-1, iNOS and cNOS representative images of Western blotting assay; C: PARP-1, iNOS and cNOS protein expression level in each group. PPAR-1: Poly (ADP-ribose) polymerase-1; iNOS: Inducible nitric oxide synthase; cNOS: Constitutive nitric oxide synthase; CON: Control; DMSO: Dimethyl sulphoxide; KAE: Kaempferol; FA: Fatty acid; BYK: BYK204165 (PARP-1 inhibitor). *P<0.05 vs CON group; △P<0.05 vs FA group. n=3, x±s |
游离的脂肪酸在人体内有着至关重要的生理功能,不仅可为器官和组织提供代谢所需的能源,还是促进胰岛β细胞释放胰岛素的关键因子。但是,当血液中游离脂肪酸的含量持续升高时,肝脏、骨骼肌或脂肪组织等无法再将其氧化生成三酰甘油,脂肪酸便可大量堆积,对正常组织或细胞的生理功能和代谢过程产生损害,又被称为脂毒性[12]。大量研究表明,2型糖尿病患者存在餐后高游离脂肪酸血症的症状,同时,该症状也是诱发糖尿病血管病变的主要机制之一,可直接导致血管的形态和内皮功能受到损害[3, 13]。因此,如何采取有效措施干预或逆转脂肪酸诱导的血管内皮损伤势在必行。
胰岛微血管内皮细胞是胰岛微血管的重要组成部分,主要附于胰岛的微血管内壁,不仅可以向胰岛细胞输送代谢所需的氧或营养物质,还能促进胰岛β细胞的增殖和分泌功能[14]。因此,本研究选取小鼠的胰岛微血管内皮MS-1细胞为研究对象,深入探讨脂肪酸对胰岛微血管内皮细胞功能的损伤效应及其干预方式。结果显示,脂肪酸直接处理MS-1细胞可促使细胞产生大量的ROS,抑制SOD、GSH等抗氧化物质的水平,导致脂质过氧化产物MDA的水平急剧升高,进而导致细胞发生凋亡,细胞活力水平降低;同时脂肪酸处理还能直接诱导细胞生成NO,刺激tNOS、iNOS和cNOS等酶的活性及表达水平的上升,继而诱发血管内皮功能的紊乱。这些结果充分表明,脂肪酸是诱发胰岛微血管内皮细胞功能损伤的重要因素;氧化应激和NO生成是导致胰岛微血管内皮功能紊乱的潜在机制。
本研究首次利用MS-1细胞模型揭示,山萘酚处理可减轻脂肪酸诱导的血管内皮功能紊乱,减轻氧化应激和凋亡水平,抑制NO的大量生成。该结果不仅提示山萘酚对脂肪酸引发的胰岛微血管内皮功能损伤具有保护效应,也表明其拮抗效应的机制可能与氧化应激、NO合成抑制和细胞凋亡等紧密相关。
PARP-1是真核细胞中催化聚腺苷二磷酸核糖化的细胞核酶。研究发现,PARP-1参与的聚腺苷二磷酸核糖化是真核细胞蛋白质翻译后修饰的主要方式,可介导包括DNA损伤修复、细胞凋亡在内的多种病理生理反应。而且,PARP-1的缺失还能增加DNA对外源性物质损伤的敏感性[15]。体外和体内研究均表明,抑制PARP-1的表达可减弱DNA的修复功能,进而增强治疗的效果,提示PARP-1抑制剂具有潜在的靶向治疗作用[16]。研究还显示,NO是iNOS/凋亡信号通路的主要效应分子,而且持续高浓度的NO也能够直接损伤DNA,激活PARP-1的表达,使细胞进入程序性死亡[17]。为进一步深入探讨山萘酚拮抗脂肪酸诱导的胰岛微血管内皮功能损伤效应机制,研究采用强效PARP-1抑制剂BYK204165预处理1 h的方式调控PARP-1介导的凋亡损伤效应。结果发现,PARP-1抑制剂+脂肪酸可在一定程度上抑制脂肪酸的微血管内皮损伤作用,表明PARP-1可能介导了脂肪酸诱导的微血管氧化应激和细胞凋亡过程,并参与了NO的合成;PARP-1抑制剂增强了山萘酚的保护效应,一方面提示山萘酚的拮抗机制可能经由PARP-1介导;另一方面说明,两者协同应用可以取得更好的预期保护作用。
综上所述,本研究发现,脂肪酸可直接引起胰岛微血管内皮功能损伤,而山萘酚具有拮抗脂肪酸毒性的作用,且抑制PARP-1的表达水平能增强山萘酚的保护效应,提示应用PARP-1抑制剂和(或)山萘酚均能够起到拮抗脂毒性的作用,且两者联合应用效果更佳。
| [1] | Yang W, Weng J. Early therapy for type 2 diabetes in China[J]. Lancet Diabetes Endocrinol, 2014, 2: 992-1002. |
| [2] | Morgantini C, Meriwether D, Baldi S, Venturi E, Pinnola S, Wagner A C, et al. HDL lipid composition is profoundly altered in patients with type 2 diabetes and atherosclerotic vascular disease[J]. Nutr Metab Cardiovasc Dis, 2014, 24: 594-599. |
| [3] | Na L X, Li Y, Pan H Z, Zhou X L, Sun D J, Meng M, et al. Curcuminoids exert glucose-lowering effect in type 2 diabetes by decreasing serum free fatty acids: a double-blind, placebo-controlled trial[J]. Mol Nutr Food Res, 2013, 57: 1569-1577. |
| [4] | Li X, Yuan L, Xu G, Qi C, Li J, Li H, et al. Effect of renin angiotensin system blockade on the islet microvessel density of diabetic rats and its relationship with islet function[J]. J Huazhong Univ Sci Technolog Med Sci, 2009, 29: 684-688. |
| [5] | Chen A Y, Chen Y C. A review of the dietary flavonoid, kaempferol on human health and cancer chemoprevention[J]. Food Chem, 2013, 138: 2099-2107. |
| [6] | Kim K, Kim S, Moh S H, Kang H. Kaempferol inhibits vascular smooth muscle cell migration by modulating BMP-mediated miR-21 expression[J]. Mol Cell Biochem, 2015, 407(1/2): 143-149. |
| [7] | Hoang M H, Jia Y, Mok B, Jun H J, Hwang K Y, Lee S J. Kaempferol ameliorates symptoms of metabolic syndrome by regulating activities of liver X receptor-β[J]. J Nutr Biochem, 2015, 26: 868-875. |
| [8] | Luo C, Yang H, Tang C, Yao G, Kong L, He H, et al. Kaempferol alleviates insulin resistance via hepatic IKK/NF-κB signal in type 2 diabetic rats[J]. Int Immunopharmacol, 2015, 28: 744-750. |
| [9] | Sosna J, Voigt S, Mathieu S, Lange A, Thon L, Davarnia P, et al. TNF-induced necroptosis and PARP-1-mediated necrosis represent distinct routes to programmed necrotic cell death[J]. Cell Mol Life Sci, 2014, 71: 331-348. |
| [10] | Shaker O, Ghallab N A, Hamdy E, Sayed S. Inducible nitric oxide synthase (iNOS) in gingival tissues of chronic periodontitis with and without diabetes: immunohistochemistry and RT-PCR study[J]. Arch Oral Biol, 2013, 58: 1397-1406. |
| [11] | Yadav V P, Dangi S S, Chouhan V S, Gupta M, Dangi S K, Singh G, et al. Expression analysis of NOS family and HSP genes during thermal stress in goat (Capra hircus)[J]. Int J Biometeorol, 2016, 3: 381-389. |
| [12] | Legrand-Poels S, Esser N, L'homme L, Scheen A, Paquot N, Piette J. Free fatty acids as modulators of the NLRP3 inflammasome in obesity/type 2 diabetes[J]. Biochem Pharmacol, 2014, 92: 131-141. |
| [13] | Nosadini R, Tonolo G. Role of oxidized low density lipoproteins and free fatty acids in the pathogenesis of glomerulopathy and tubulointerstitial lesions in type 2 diabetes[J]. Nutr Metab Cardiovasc Dis, 2011, 21: 79-85. |
| [14] | Lu C L, Wang Y, Yuan L, Li Y, Li X Y. The angiotensin-converting enzyme 2/angiotensin (1-7)/Mas axis protects the function of pancreatic β cells by improving the function of islet microvascular endothelial cells[J]. Int J Mol Med, 2014, 34:1293-1300. |
| [15] | Langelier M F, Planck J L, Roy S, Pascal J M. Structural basis for DNA damage-dependent poly (ADP-ribosyl) ation by human PARP-1[J]. Science, 2012, 336: 728-732. |
| [16] | Bai P, Cantó C. The role of PARP-1 and PARP-2 enzymes in metabolic regulation and disease[J]. Cell Metab, 2012, 16: 290-295. |
| [17] | Cohausz O, Althaus F R. Role of PARP-1 and PARP-2 in the expression of apoptosis-regulating genes in HeLa cells[J]. Cell Biol Toxicol, 2009, 25: 379-391. |
 2016, Vol. 37
2016, Vol. 37


