肾下型腹主动脉瘤(infrarenal abdominal aortic aneurysm,IAAA)是大动脉瘤中发病率最高的一种类型[1]。随着高分辨率计算机断层血管摄影(computed tomography angiography,CTA)的普及和腔内技术的成熟与推广,越来越多的IAAA被早期诊断及治疗。并且,由于腹主动脉瘤腔内修复术(endovascular aneurysm repair,EVAR)具有微创、恢复快、安全等特点,已逐渐替代开放手术成为IAAA早期手术治疗的首选方法。目前有关EVAR的研究工作大多聚焦于治疗效果、支架有无移位、术后内漏等情况,而对于术后外周血管缺血并发症,尤其是脊髓缺血(spinal cord ischemia,SCI)的关注却很少。
SCI是动脉瘤术后罕见但灾难性的并发症,一旦发生往往导致不可逆性神经功能受损,这将对患者及社会造成沉重的负担。现回顾分析2008年1月至2014年10月期间在第二军医大学长海医院及长征医院血管外科诊治的IAAA病例EVAR术后SCI的发生情况,结合现有文献资料,初步探讨其发病率、可能病因,以及持续脑脊液引流对其的治疗作用。
1 资料和方法 1.1 一般资料收集2008年1月至2014年10月期间在第二军医大学长海医院及长征医院血管外科接受治疗的IAAA病例,排除急性病例及先兆破裂动脉瘤病例后,总计400例。其中男性320例,女性80例,年龄51~85岁,平均(75.33±3.51)岁。所有病例均为慢性病程,无腹痛、腹胀等先兆破裂或破裂症状。
1.2 既往病史及影像学检查患者中既往具有高血压史284例、糖尿病史157例、高血脂史132例、吸烟史203例。既往患有冠心病74例、脑血管病52例、下肢缺血性疾病63例。
所有患者入院后均经全主动脉CTA检查、主动脉数字减影血管造影(digital subtraction angiography,DSA)明确动脉瘤影像学数据及髂动脉情况。所有病例均为IAAA,动脉瘤平均直径(77.84±13.21) mm,瘤颈长度最短20 mm,动脉瘤腔内均有不同程度腹壁血栓形成。髂动脉情况显示共60例动脉瘤累及双侧髂总动脉,其中16例同时合并髂内动脉瘤;30例动脉瘤累及单侧髂总动脉,其中9例合并同侧髂内动脉瘤;10例动脉瘤合并单侧孤立性髂内动脉瘤或髂外动脉狭窄;其余病例髂动脉未见异常。
1.3 治疗排除手术禁忌证后,均行择期全麻下EVAR手术。平均手术时间(87.20±32.51) min,平均使用造影剂(70.13±30.22) mL。术中同期封堵双侧髂内动脉60例,其中8例同期弹簧圈栓塞单侧髂内动脉瘤(女性1例);封堵单侧髂内动脉70例,其中10例同期弹簧圈不完全栓塞髂内动脉瘤。髂内动脉封堵病例术中远端锚定区均未行球囊成形,未封堵病例中64例行远端锚定区球囊成形。术中即刻造影显示动脉瘤均封堵完全,均未出现明显内漏。术中均未出现显著的低血压、低氧血症。术后均至监护病房苏醒观察,平均住院时间(20.43±11.36) d。
1.4 随访随访时间2~48个月,平均(16.07±10.23)个月,中位随访时间12个月。于第6、12个月复查全主动脉CTA。
2 结 果术后因术后5 d突发急性心肌梗死抢救无效死亡1例。急性下肢动脉缺血2例,急性SCI 1例,慢性下肢间跛1例(>3个月),无盆腔、臀肌缺血病例。ⅠB型内漏4例(2例为合并髂内动脉瘤病例),Ⅱ型内漏2例,Ⅲ型内漏1例,无支架移位、动脉瘤破裂病例。术后外周血管缺血事件发生率为1%,其中SCI发病率为0.25%(1/400)。2例急性下肢缺血为动脉粥样硬化性栓塞,经抗凝、溶栓治愈;1例慢性下肢间跛为髂动脉扭曲导致髂支展开不全、血栓形成所致,经溶栓、球囊及支架成形术治愈。急性SCI病例为85岁男性患者,既往有高血压病史,全主动脉CTA检查示“巨大IAAA累及双侧髂总动脉及髂内动脉”(图 1)。入院后择期行全麻下EVAR手术治疗,术中同期双侧髂支覆膜支架封堵双侧髂内动脉,未行髂内动脉栓塞。术后即刻四肢感觉活动正常,12 h后出现间断低血压,并逐渐出现SCI症状(下肢麻木、无力)。经系统性升压、抗血小板、大剂量激素冲击、持续脑脊液引流(cerebrospinal fluid drainage,CSFD)等治疗后,SCI症状稍缓解,双下肢麻木基本恢复,肌力恢复至4~5级。
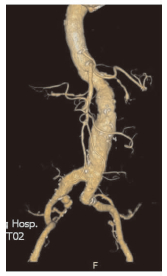
| 图 1 巨大肾下型腹主动脉瘤累及双侧髂总动脉、髂内动脉 |
SCI是大动脉瘤术后的罕见并发症类型之一,一般主要见于胸主动脉或胸腹主动脉瘤术后,发病率为3%~12%[2, 3, 4];在腹主动脉瘤的开放手术中也常有文献报道,总结发病率约0.26%[5, 6]。而有关IAAA EVAR术后SCI的文献及报道却极少,在PubMed数据库中共搜索到11篇相关文献[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16]。排除重复病例、术中转开放手术[6]及复合手术病例[11]后,总计有14例EVAR术后SCI病例。其中,Berg等[6]的报道为现有样本量最大的回顾性观察研究,作者在EUROSTAR数据库的2 862例IAAA EVAR患者中共发现6例SCI病例,总结发病率为0.21%。相似的是,Feezor等[14]在450例患者中共发现1例SCI(0.22%);Freyrie等[16]在262例患者中发现1例SCI(0.38%)。而在本研究中,SCI的总体发病率为0.25%(1/400),与国外数据大致相仿。所以,总结现有文献及资料,IAAA EVAR术后SCI的发病率为0.21%~0.38%,与其开放手术中0.26%的发病率类似。
对于SCI的病因及发病机制,目前尚未完全明确。但是,大多数学者均认同这一观点——覆膜支架大面积隔绝或栓塞等导致脊髓血供来源之一的主动脉壁支分支缺血,包括肋间动脉、腰动脉、髂骶和腰骶动脉等,从而造成相应节段脊髓血流灌注不足[6]。肋间动脉、腰动脉栓塞已基本被证实是EVAR术后SCI的病因之一[6]。而栓子的最主要来源是过多的血管内操作所导致的斑块或血栓脱落,其根本原因是血管严重迂曲或狭窄等造成的导丝、支架输送困难。然而,对于盆腔血管网络血供主要来源之一的髂内动脉在EVAR术后SCI中的作用却存在极大的争议。最初,Kwok等[8]报道了1例因EVAR术中双侧髂内动脉栓塞而发生SCI的患者,从而认为至少应保留一侧髂内动脉以保证末梢脊髓的血供。但是随后,Mehta等[17]在107例EVAR术中阻断髂内动脉的患者(8例双侧、99例单侧)中并没有观察到SCI的发生,因此认为阻断髂内动脉可能是相对安全的。此外,Lee等[18]在28例双侧髂内动脉阻断的患者中也没有观察到SCI的发生。在本研究所回顾文献的14例病例中,仅有1例双侧髂内动脉封堵,5例单侧髂内动脉封堵,并且甚至有1例术中重建被封堵的单侧髂内动脉的患者仍发生了SCI[6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16]。而本研究所报道的1例SCI病例,其症状继发于术后间断性低血压。因此,该例SCI病例虽然术中同期封堵双侧髂内动脉,但更可能是在此基础上合并了围手术期低血压所导致的。术后低血压直接加重、恶化了双侧髂内动脉封闭后已经欠佳的脊髓灌注,最终导致SCI的发生。所以,就现有数据而言,我们可能更倾向于髂内动脉在EVAR术后SCI中可能起到一定作用,但并没有起到核心作用的观点。
总结本研究及回顾文献的15例SCI病例的病因及发病机制,分别是7例与大量血管内操作导致的栓塞有关[6, 7, 10];1例与术前髂内动脉的栓塞有关[8];1例与起源于腰动脉的Adamkiewicz动脉栓塞伴双侧髂内动脉慢性闭塞有关[9];1例(本研究所报道的病例)与双侧髂内动脉封堵合并术后低血压有关;余下的病例没有明确提出可能的病因。综上所述,对于动脉瘤术后SCI,除了分支血管封堵的因素外,围手术期的恰当处理、术中控制腔内操作的次数及范围等方面同样重要。然而,由于当前缺乏相应的大样本随机对照试验,并且受限于脊髓供血的差异性、复杂性以及检测手段有限等原因,髂内动脉封堵在SCI中的具体作用及地位尚不清楚。下一步的研究更应聚焦于多种因素的综合性作用,而不仅仅是局限于单个分支血管封堵的作用。
目前对于动脉瘤术后SCI的主要应对措施是术中尽可能保护脊髓血供,比如通过重建重要分支血管的血流、术中CSFD等措施来预防SCI的发生。因为一旦发生SCI,其预后往往是极差的,而且有效的治疗方法也较少。目前主要的治疗方法包括抗血小板、神经保护、神经营养、血压控制、CSFD等;其中CSFD被认为可能是目前比较有效的治疗方法[19],但也仅限于使神经功能部分恢复。CSFD的作用机制为利用脊髓灌注压为血压与脑脊液压之差的原理,通过降低脑脊液压力间接增加脊髓血流灌注。在现有文献中,仅有2例EVAR术后SCI的患者的神经症状经CSFD治疗后得到部分恢复[9, 10]。在本研究所报道的病例中,通过CSFD将脑脊液压力控制于10 cm H2O (1 cm H2O=0.98 kPa)左右,同时结合升血压、神经营养、抗神经水肿等对症治疗后,患者神经系统症状得到部分恢复。但是,CSFD在SCI治疗中具体作用价值以及是否为核心治疗措施仍需进一步的研究。
总之,SCI是IAAA EVAR术后极罕见的、不可预测的和灾难性的并发症。其发病机制是多因素的,就目前研究来看尚不清楚。结合本研究病例来看,髂内动脉可能对马尾段脊髓血供较为重要,但脊髓血供存在极大的个体差异性,如何在术前明确脊髓血供的重要分支动脉是今后主要的研究工作之一。同时,我们认为,在下一步的病因机制研究中,不仅需要考虑到脊髓供血血管的作用,同时也需综合考虑患者围手术期的一般情况,如手术时间、术中及术后的低血压等。对于SCI的治疗,CSFD联合升血压、神经营养、抗水肿、祛聚治疗目前来看可能是行之有效的,但CSFD是否起到核心作用也同样需进一步研究。
| [1] | Steckmeier B. [Epidemiology of aortic disease: aneurysm, dissection, occlusion][J]. Der Radiologe, 2001, 41: 624-632. |
| [2] | Coselli J S, Bozinovski J, LeMaire S A. Open surgical repair of 2 286 thoracoabdominal aortic aneurysms[J]. Ann Thorac Surg, 2007, 83: S862-S864. |
| [3] | Cheung A T, Pochettino A, McGarvey M L, Appoo J J, Fairman R M, Carpenter J P, et al. Strategies to manage paraplegia risk after endovascular stent repair of descending thoracic aortic aneurysms[J]. Ann Thorac Surg, 2005, 80: 1280-1289. |
| [4] | Makaroun M S, Dillavou E D, Kee S T, Appoo J J, Fairman R M, Carpenter J P, et al. Endovascular treatment of thoracic aortic aneurysms: results of the phase Ⅱ multicenter trial of the GORE TAG thoracic endoprosthesis[J]. J Vasc Surg, 2005, 41: 1-9. |
| [5] | Rosenthal D. Spinal cord ischemia after abdominal aortic operation: is it preventable? [J]. J Vasc Surg, 1999, 30: 391-397. |
| [6] | Berg P, Kaufmann D, van Marrewijk C J, Buth J. Spinal cord ischemia after stent-graft treatment for infra-renal abdominal aortic aneurysms. Analysis of the Eurostar database[J]. Eur J Vasc Endovasc Surg, 2001, 22: 342-347. |
| [7] | Rockman C B, Riles T S, Landis R. Lower extremity paraparesis or paraplegia subsequent to endovascular management of abdominal aortic aneurysms[J]. J Vasc Surg, 2001, 33: 178-180. |
| [8] | Kwok P C, Chung T K, Chong L C, Chan S C, Wong W K, Chan M K, et al. Neurologic injury after endovascular stent-graft and bilateral internal iliac artery embolization for infrarenal abdominal aortic aneurysm[J]. J Vasc Interv Radiol, 2001, 12:761-763. |
| [9] | Garcia N D, Tehrani H, Morasch M, Pearce W, Matsumura J. Spinal cord ischemia following endovascular repair of an infrarenal aortic aneurysm[J]. Ann Vasc Surg, 2002, 16: 509-512. |
| [10] | Bhama J K, Lin P H, Voloyiannis T, Bush R L, Lumsden A B. Delayed neurologic deficit after endovascular abdominal aortic aneurysm repair[J]. J Vasc Surg, 2003, 37: 690-692. |
| [11] | Reid J A, Mole D J, Johnston L C, Lee B. Delayed paraplegia after endovascular repair of abdominal aortic aneurysm[J]. J Vasc Surg, 2003, 7: 1322-1323. |
| [12] | Fortes D L, Atkins B Z, Chiou A C. Delayed paraplegia following infrarenal abdominal aortic endograft placement: case report and literature review[J]. Vascular, 2004, 12: 130-135. |
| [13] | Maldonado T S, Rockman C B, Riles E, Douglas D, Adelman M A, Jacobowitz G R, et al. Ischemic complications after endovascular abdominal aortic aneurysm repair[J]. J Vasc Surg, 2004, 40: 703-709. |
| [14] | Feezor R J, Huber T S, Martin T D, Beaver T M, Hess P J, Klodell C T, et al. Perioperative differences between endovascular repair of thoracic and abdominal aortic diseases[J]. J Vasc Surg, 2007, 45: 86-89. |
| [15] | Eagleton M J, Shah S, Petkosevek D, Mastracci T M, Greenberg R K. Hypogastric and subclavian artery patency affects onset and recovery of spinal cord ischemia associated with aortic endografting[J]. J Vasc Surg, 2014, 59: 89-94. |
| [16] | Freyrie A, Testi G, Gargiulo M, Faggioli G, Mauro R, Stella A. Spinal cord ischemia after endovascular treatment of infrarenal aortic aneurysm. Case report and literature review[J]. J Cardiovasc Surg, 2011, 52: 731-734. |
| [17] | Mehta M, Veith F J, Ohki T, Cynamon J, Goldstein K, Suggs W D. Unilateral and bilateral hypogastric artery interruption during aortoiliac aneurysm repair in 154 patients: a relatively innocuous procedure[J]. J Vasc Surg, 2001, 33: 27-32. |
| [18] | Lee C W, Kaufman J A, Fan C M, Geller S C, Brewster D C, Cambria R P, et al. Clinical outcome of internal iliac artery occlusions during endovascular treatment of aortoiliac aneurysmal diseases[J]. J Vasc Interv Radiol, 2000, 11: 567-571. |
| [19] | Coselli J S, Lemaire S A, Koksoy C, Schmittling Z C, Curling P E. Cerebrospinal fluid drainage reduces paraplegia after thoracoabdominal aortic aneurysm repair: results of a randomized clinical trial[J]. J Vasc Surg, 2002, 35: 631-639. |
 2016, Vol. 37
2016, Vol. 37


