2. 第二军医大学药学院有机化学教研室, 上海 200433
2. Department of Organic Chemistry, School of Pharmacy, Second Military Medical University, Shanghai 200433, China
乳腺癌是严重威胁女性身心健康的恶性肿瘤之一,其发病率居于全球女性肿瘤之首并呈现逐年上升的趋势[1, 2, 3]。在乳腺癌的治疗药物中,选择性雌激素受体(ER)调节剂(SERMs)以其毒性和不良反应少、治疗成本低等优点备受关注[4]。SERMs通过作用于ER而在不同组织细胞中发挥特异性调节作用[5],是治疗乳腺癌的主要药物[6]。目前应用于临床的代表药物包括他莫昔芬(TAM)、托瑞米芬、雷洛昔芬和屈洛昔芬等[7]。
新药研发的途径多种多样[8],而老药新用策略可提高新药研发的速度[9]。前期研究结果[10]显示抗真菌老药酮康唑具有选择性ER调节活性。计算机模拟对接结果(图 1)显示,酮康唑和雷洛昔芬与ER的作用方式非常类似,酮康唑与雷洛昔芬的叠合趋势也大体一致。生物活性测试结果显示,酮康唑能特异性地作用于ERβ,抑制乳腺癌细胞MDA-MB-231的增殖,其活性与乳腺癌内分泌治疗一线药物TAM相当。
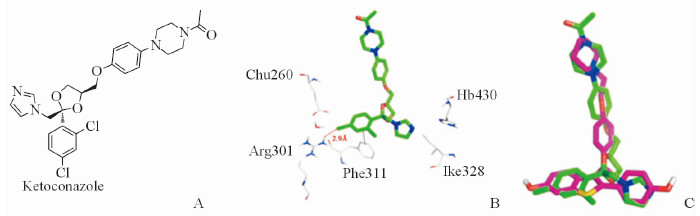
|
图 1 酮康唑结构图(A)、酮康唑与ERβ的对接图(B)以及酮康唑与雷洛昔芬的叠合图(C) Fig 1 Structure chart of ketoccnazole(A), docking of ketoconazole with ERβ (B) and superposition of ketoconazole with raloxifene (C) vessels ERβ: Estrogen receptor β |
经典的SERMs具备以下特点[11]:含酚羟基苯环,具有碱性基团的含胺侧链,且含胺侧链与母核之间的连接基团以2个碳原子为宜。本研究依据之前得到的氮唑类药物与ER的对接图进行药物设计,保留先导化合物酮康唑分子氮唑母核结构中的2,4-二氯苯基和三氮唑环,对侧链进行改造,侧链部分主要选自SERMs的含胺侧链结构,希望通过侧链的改造能够增强化合物的活性。
1 试剂、瘤株和仪器本研究合成实验中所用试剂均为上海泰坦科技股份有限公司的化学纯或分析纯试剂;柱层析硅胶为烟台江友硅胶开发有限公司生产(生产批号020150211);Bruker AC-300P核磁共振仪测定核磁共振氢谱,溶剂为CDCl3,内标为四甲基硅烷(TMS);LC-MS采用安捷伦1100系列,ZF-Ⅰ型三用紫外分析仪为上海顾村电光仪器厂生产;乳腺癌细胞MDA-MB-231和MCF-7由第二军医大学东方肝胆外科医院苏长青教授提供。
2 方法和结果在合成路线中,我们使对苄氧基苯酚1与2-溴乙醇在丙酮、氢氧化钠水溶液中发生亲核取代反应,生成中间体2,再与对甲苯磺酰氯反应生成中间体3,与各种胺通过亲核取代反应生成中间体4,最后钯碳氢气氢解脱去苄基得到中间体5,具体的合成路线见图 2。中间体6与中间体5在氢化钠作用下,通过亲核取代反应得到目标化合物A1~A11,具体的合成路线见图 3,目标化合物的理化数据见表 1。
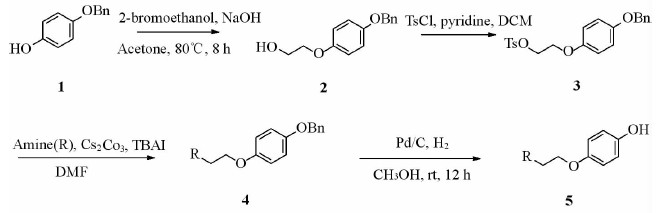
|
图 2 中间体5的合成路线 Fig 2 Synthesis route of compound 5 vessels TsCl: 4-Toluene sulfochloride; DCM: Dichloromethane; DMF: N, N-Dimethylformamide; TBAI: Tetrabutylammonium; rt: Room temperature |
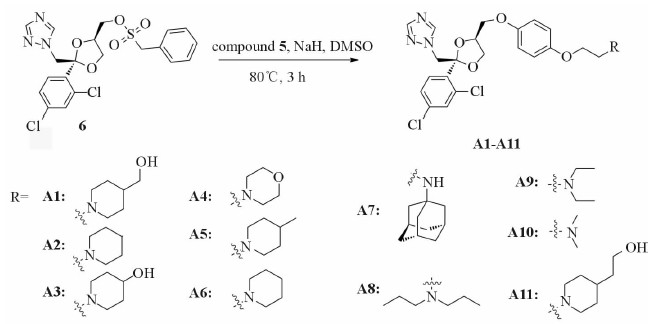
|
图 3 目标化合物的合成路线 Fig 3 Synthesis route of the target compounds vessels DMSO: Dimethyl sulfoxide |
|
|
表 1 目标化合物物理数据 Tab 1 Physical data of title compounds |
在1 000 mL 三颈瓶中,加入对苄氧基苯酚 1 (40.0 g,200 mmol)、2-溴乙醇(52.6 g,420 mmol)、丙酮200 mL,溶解后加入1 mol/L氢氧化钠水溶液240 mL,控制外温80℃反应8 h。反应结束后蒸除丙酮,加入400 mL水,二氯甲烷600 mL×2萃取,合并二氯甲烷溶液,加入无水硫酸钠干燥,次日过滤,浓缩,二氯甲烷重结晶,得到42.0 g白色粉末状固体化合物 2 ,收率为86%。1HNMR(300 MHz,CDCl3):7.35~7.49(m,5H),6.97(d,J= 9.0 Hz,2H),6.91(d,J= 9.0 Hz,2H),5.07(s,2H),4.07~4.10(m,2H),3.97~4.00(m,2H)。
2.2 2-((4-苄氧基)-苯氧基)-乙基-4-甲基苯磺酸酯(3)的合成在1 000 mL 单口瓶中,加入中间体 2 (20.00 g,82 mmol)、二氯甲烷200 mL、吡啶50 mL,溶解后冰浴下缓慢滴入用二氯甲烷稀释的对甲苯磺酰氯(31.2 g,164 mmol),40 min内滴完,转移至室温,反应过夜。反应结束后,加入1 mol/L盐酸溶液洗涤2次,饱和氯化钠水溶液洗1次,无水硫酸钠干燥过夜。次日过滤,浓缩,硅胶柱层析得31.94 g淡红色粉末状固体 3 ,收率98%。1HNMR(300 MHz,CDCl3):7.82(d,J= 6.0 Hz,2H),7.33~7.44(m,7H),6.87(d,J= 9.0 Hz,2H),6.72(d,J= 9.0 Hz,2H),5.01(s,2H),4.32~4.35(m,2H),4.08~4.11(m,2H),2.45(s,3H)。
2.3 (1-(2-(4-(苄氧基)苯氧基)乙基)哌啶-4-基)甲醇(4)的合成在25 mL 单口瓶中,加入中间体 3 (300 mg,0.75 mmol)、哌啶-4-基甲醇(172 mg,1.5 mmol)、无水DMF 5 mL和碳酸铯(487 mg,1.5 mmol),室温搅拌下加入催化量四丁基碘化铵,控制外温80℃继续反应2 h。反应结束后加入50 mL水,二氯甲烷60 mL×2萃取,合并二氯甲烷溶液,加入无水硫酸钠干燥,次日过滤,浓缩溶剂得 4 ,产物直接用于下一步反应。
2.4 4-(2-(4-(羟甲基)哌啶-1-基)乙氧基)苯酚(5)的合成在25 mL 单口瓶中,加入中间体 4 、甲醇5 mL,溶解后加入钯碳20 mg,置换H2,室温搅拌过夜。滤除钯碳,浓缩溶剂,硅胶柱层析得143 mg油状化合物 5 ,两步反应总收率57%。1HNMR(300 MHz,CD3OD): 6.69~6.79(m,4H),4.04(t,J= 5.6 Hz,2H),3.40(d,J= 6.4 Hz,2H),3.08(d,J= 11.8 Hz,2H),2.81(t,J= 5.6 Hz,2H),2.16~2.23(m,2H),1.76(d,J= 13.0 Hz,2H),1.45~1.56(m,1H),1.28~1.37(m,2H)。
2.5 (1-(2-(4-(((2S,4R)-2-((1H-1,2,4-三唑-1-基)甲基)-2-(2,4-二氯苯基)-1,3-二氧戊环-4-基)甲氧基)苯氧基)乙基)哌啶基-4-基)甲醇( A1 )的合成在25 mL 单口瓶中,加入中间体 5 (143 mg,0.57 mmol)、无水DMSO 4 mL,溶解后加入氢化钠(23 mg,0.55 mmol),室温搅拌30 min后加入中间体 6 (256 mg,0.63 mmol),室温反应1 h后升温至80℃,继续反应3 h。反应结束后,加入50 mL水,二氯甲烷60 mL×2萃取,合并二氯甲烷溶液,无水硫酸钠干燥过夜。次日过滤,浓缩,硅胶柱层析得200 mg白色粉末状化合物 A1 。化合物 A2~A11 分别以不同的取代苯酚为原料按此法合成。
2.6 抗乳腺癌细胞增殖活性实验本实验采用MTT法[12]对所合成的11个目标化合物进行抗乳腺癌细胞增殖活性测试,以他莫昔芬为阳性对照药,测试目标化合物不同浓度下对乳腺癌细胞MDA-MB-231和MCF-7的抑制效果,计算IC50,结果见表 2。
|
|
表 2 目标化合物对MDA-MB-231和MCF-7细胞的IC50 Tab 2 IC50 of target compounds against breast cancer MDA-MB-231 and MCF-7 cells cB/(μmol·L-1) |
从活性测试结果可以看出,除A5外所有目标化合物对乳腺癌细胞MDA-MB-231的抑制活性优于阳性对照药他莫昔芬。化合物A7的活性最好,对乳腺癌细胞MDA-MB-231和MCF-7均有较好的抑制活性,且对前者的抑制活性(IC50 =4.41 μmol/L)远远高于他莫昔芬(IC50 =26.01 μmol/L),可能由于金刚烷胺本身对细胞有一定的活性,将金刚烷胺与酮康唑母核拼合会使其活性进一步增强。另外,通过比较活性较好的化合物 A1、A2、A11 发现,侧链部分为4-羟乙基哌啶基和4-羟甲基哌啶基时活性优于四氢吡咯基,说明含胺侧链的对位极性基团羟基可增强化合物的活性;因此推测成环的含胺侧链部分较脂肪胺对活性有利。活性筛选结果显示,目标化合物对乳腺癌细胞MDA-MB-231的体外抗增殖活性优于乳腺癌细胞MCF-7,大多数目标化合物对后者的抑制活性比阳性对照药他莫昔芬差,与计算机辅助药物设计预测结果有一定差别,有待进一步的研究。
根据目标化合物对乳腺癌细胞MDA-MB-231的活性评价结果,可以初步总结氮唑类抗乳腺癌化合物的构效关系:氮唑类母核结构中的2,4-二氯苯基和1,2,4-三氮唑环对增强化合物抗乳腺癌细胞活性有利;引入环状胺侧链可以增强化合物对乳腺癌细胞的抑制活性,且成环含胺侧链的对位存在极性基团对增强活性有利;当极性基团与环状胺之间的连接部分为甲基或乙基时活性最强。
| [1] | Jemal A, Bray F, Center M M, Ferlay J, Ward E, Forman D. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61: 69-90. |
| [2] | 丁芋友, 姚德姣.乳腺癌的治疗现状[J].湖南中医杂志, 2014, 30:179-181. |
| [3] | Xu Y L, Sun Q, Shan G L, Zhang J, Liao H B, Li S Y, et al. A case-control study on risk factors of breast cancer in China[J]. Arch Med Sci, 2012, 8: 303-309. |
| [4] | Malfettone A, Saponaro C, Paradiso A, Simone G, Mangia A. Peritumoral vascular invasion and NHERF1 expression define an immunophenotype of grade 2 invasive breast cancer associated with poor prognosis[J]. BMC Cancer, 2012, 12: 106. |
| [5] | 贾 臻, 胡夕春.乳腺癌的药物治疗进展[J].药品评价, 2012, 9:4-9. |
| [6] | Fan L, Strasser-Weippl K, Li J J, Louis J S, Finkelstein D M, Yu K D, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15: e279-e289. |
| [7] | 吴清芹, 朱小东.乳腺癌放射治疗研究进展[J].中国癌症防治杂志, 2009, 1:92-94. |
| [8] | Silverman S L. New selective estrogen receptor modulators(SERMs) in development[J]. Curr Osteoporos Rep, 2010, 8: 151-153. |
| [9] | Goldstein S R, Patrick N, Steven C, Terence C, Runowicz C D, Cummings S, et al. Postmenopausal evaluation and risk reduction with lasofoxifene (PEARL) trial: 5-year gynecological outcomes[J]. Menopause, 2011, 18: 17-22. |
| [10] | Cheng F, Liu C, Jiang J, Lu W, Li W, Liu G, et al. Prediction of drug-target interactions and drug repositioning via network-based inference[J]. PLoS Comput Biol, 2012, 8: e1002503. |
| [11] | Shang Y, Brown M. Molecular determinants for the tissue specificity of SERMs[J]. Science, 2002, 295: 2465-2468. |
| [12] | Kung A W, Chu E Y, Xu L. Bazedoxifene: a new selective estrogen receptor modulator for postmenopausal osteoporosis[J]. Expert Opin Pharmacother, 2009, 10: 1377-1385. |
 2016, Vol. 37
2016, Vol. 37


