2. 第二军医大学基础部病原生物学教研室, 上海 200433
2. Depatment of Pathogen Biology, College of Basic Medical Sciences, Second Military Medical University, Shanghai 200433, China
巴贝虫(Babesia)在分类上属孢子虫纲梨浆虫亚纲梨浆虫目巴贝虫科巴贝虫属,主要寄生于哺乳动物的红细胞内,偶可寄生于人体,在人体红细胞中繁殖,使大量红细胞被破坏。其呈世界性分布,种类超过100多种,但感染人巴贝虫主见于田鼠巴贝虫(Babesia microti, B.microti)和分歧巴贝虫[1]。巴贝虫病是由巴贝虫经蜱传播引起的一种血源性寄生虫病,在全球热带和亚热带地区广泛流传,影响人类的健康[2, 3, 4]。美国报道的巴贝虫病例大多是田鼠巴贝虫感染,由硬肩突蜱传播[5],而欧洲的巴贝虫病仅仅是由分歧巴贝虫感染脾切除患者引起[6]。大多数患者被感染巴贝虫的蜱虫叮咬后1~4周患病,而输入被其感染的血液者在输血后1~9周患病[2]。冷战、出汗是常见的症状,可能也伴有头痛、肌痛、厌食、干咳、关节痛和恶心,发烧是最常见的标志,可能合并脾肿大、咽红斑、肝肿大[7]。巴贝虫病严重性主要取决于患者的免疫状态和引起感染的巴贝虫种,免疫缺陷或低下的人群较易被感染,多发生在有蜱地区,特别是在蜱活跃的春秋季节感染较为严重[8]。巴贝虫病也是血源性寄生虫病,还可通过输血传播,而血站尚没有针对寄生虫病的检测项目。无偿献血员是一个特殊人群,需要严谨检查人群中血源性疾病的感染状况及分布特征。
检测巴贝虫病的方法有基于光学显微镜的病原学检测法、血清学方法,如间接免疫荧光(indirect immunofluorescence assay,IFA)法和酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)等,但这些方法存在费时、灵敏度不高、特异性不强等缺点[9]。本研究利用巴贝虫属18S rRNA的巢氏PCR(Nest-PCR)方法先进行大量标本阳性筛查,再结合巴贝虫属β-tubulin的Nest-PCR、形态学观察、IFA确认筛查结果,进而调查分析广西的巴贝虫感染情况。
1 材料和方法 1.1 样本采集与保存2013年某月广西某血站无菌条件下采集献血员外周血,保存于含有抗凝剂的采血管中,共计1 900人份,取部分涂制薄血片染色和抽提基因组DNA,剩余部分-80℃冷冻保存。同时进行流行病学调查,包括外出情况、有无输血史和蜱虫叮咬史等。
1.2 主要材料田鼠巴贝虫引自中国疾病控制中心上海寄生虫病预防控制所,由BALB/c小鼠传代保种。新型植物基因组DNA提取试剂盒为TIANGEN公司产品,2×PCR Master Mix购自上海莱枫生物科技有限公司,100 bp DNA Ladder购自上海索宝生物科技有限公司,所用引物由英潍捷基(上海)贸易有限公司合成,Diff-Quik快速染液、羊抗人IgG荧光标记二抗购自上海鼎国生物科技有限公司。
1.3 DNA的提取按照TIANGEN公司新型植物基因组DNA提取试剂盒操作说明书,提取1 900份外周血DNA作为模板。同法提取田鼠巴贝虫DNA作为阳性对照。
1.4 Nest-PCR检测 1.4.1 巴贝虫属18S rRNA的Nest-PCR根据巴贝虫属18S rRNA,参照文献[10]合成引物(表 1)。Nest-PCR扩增体系为:2×PCR Master Mix 12.5 μL,10 μmol/L上、下游引物各1 μL,首轮模板DNA 3 μL,加diH2O至总体积25 μL。首轮反应的产物作为次轮的模板,次轮模板是1 μL。阴性对照均为diH2O。首轮PCR反应条件为94℃ 40 s、56℃ 40 s、72℃ 1 min,循环30次;72℃ 5 min。次轮PCR反应条件为94℃ 40 s、56℃ 40 s、72℃ 40 s,循环35次;72℃ 5 min。
|
|
表 1 巴贝虫属巢氏PCR检测血标本的引物 Tab 1 Primers used for detecting the blood sample by nested PCR of B.microti |
根据巴贝虫属β-tubulin基因序列,参考文献[11]合成引物(表 1)。以巴贝虫属18S rRNA的Nest-PCR阳性检测样品DNA为模板进行巴贝虫属β-tubulin的Nest-PCR,扩增反应体系同巴贝虫属18S rRNA。阴性对照均为diH2O。首轮反应条件为94℃ 40 s、60℃ 1 min、72℃ 1 min,循环30次;72℃ 7 min。次轮反应条件为94℃ 40 s、60℃ 40 s、72℃ 40 s,循环35次;72℃ 7 min。
1.4.3 电泳检测扩增产物配制1.5%琼脂糖凝胶,置于1×TAE电泳缓冲液中,Nest-PCR扩增产物以4 μL/孔点样;在80 V、25 mA条件下电泳26 min,利用全自动倒置凝胶成像系统进行拍照。
1.4.4 扩增产物测序及序列比对目标扩增片段送铂尚(上海)生物科技有限公司进行测序,并采用BLAST( http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析序列同源性。
1.5 形态学观察将采集的广西献血员外周血涂制薄血片,干燥后进行Diff-Quik染色,油镜镜检(×400),并拍照记录。
1.6 免疫学检测巴贝虫抗原片由上海寄生虫病防治研究所提供,保鲜膜单张包裹,保存于-80℃。取出巴贝虫抗原片,恢复至室温后去除保鲜膜;PBST洗片1次,晾干;用3%脱脂奶粉PBS覆盖血膜,37℃封闭孵育1 h;PBST洗片1次,晾干;用蜡笔将抗原片平均分隔成10个区域;巴贝虫属18S rRNA的Nest-PCR阳性标本血清用3%脱脂奶粉PBS倍比稀释为1∶16、1∶32、1∶64、1∶128、1∶256、1∶512、1∶1 024;每张抗原片上的10个区域内滴加5 μL稀释好的待检标本,设置巴贝虫病患者血清阳性对照和正常血清阴性对照,37℃湿盒中孵育2 h;PBST洗片5次,晾干;滴加5 μL 3%脱脂奶粉PBS稀释的羊抗人FITC-IgG二抗在曾滴加待检标本的部分上,37℃湿盒避光孵育1 h;PBST洗片5~7次,在暗处晾干;荧光显微镜下观察并记录结果。抗体滴度≤1∶64视为阴性[12]。
2 结 果 2.1 Nest-PCR检测结果巴贝虫属18S rRNA的Nest-PCR扩增产物经1.5%琼脂糖凝胶电泳,得到阳性条带与巴贝虫阳性对照条带基本一致,获得的阳性条带大小约387 bp。Nest-PCR产物直接双向测序,经BLAST序列比对,48份血样标本与B.microti(登录号为KF891472.1)的同源性高达98%以上,广西献血员巴贝虫阳性感染率为2.53%(48/1 900)。用巴贝虫属β-tubulin的Nest-PCR验证48份阳性标本,结果只有6份BLAST序列比对是B.microti。为此,设计了两种引物灵敏度测试实验,模板是阳性对照的基因组DNA,初始浓度是25 ng/μL,5倍梯度倍比稀释,共16个梯度,结果巴贝虫属18S rRNA引物最低检测浓度是2.048×10-8 ng/μL,β-tubulin引物最低检测浓度是1.28×10-5 ng/μL,相差625倍,说明巴贝虫属18S rRNA引物比β-tubulin引物灵敏(图 1)。
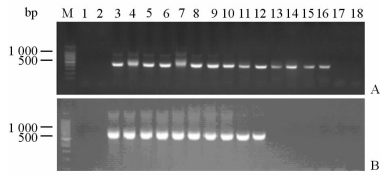
|
图 1 巴贝虫属18S rRNA(A)与β-tubulin(B)的Nest-PCR灵敏度测试结果 Fig 1 Comparison of Nest-PCR sensitivities between Babesia 18S rRNA (A) and Babesia β-tubulin (B) 1, 2: Negative; 3-18: The concentration of Babesia DNA being 25, 5, 1, 0.2, 0.04, 8×10-3, 1.6×10-3, 3.2 ×10-4, 6.4×10-5, 1.28×10-5, 2.56×10-6, 5.12×10-7, 1.024×10-7, 2.048×10-8, 4.096×10-9, 8.192×10-10 ng/μL, respectively; M: 100 bp DNA Ladder |
38份被检测标本因血涂片染色后保存时间不同,导致镜下观察背景不同。阳性血涂片在红细胞内发现有核呈圆形且致密、胞质呈环形且纤细的环状体(图 2A~2C),与疟原虫极为相似;但该环状体无疟色素沉着,胞质量少而稀薄,亦可见类似疟原虫裂殖体样结构(图 2D)。10份未见典型的巴贝虫形态,但不能排除未被巴贝虫感染。
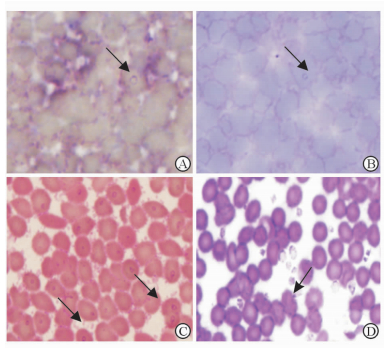
|
图 2 薄血涂片的形态学观察结果 Fig 2 Microscopic observation of blood thin-smeared slide A, B, C, and D: Blood smears after Diff-Quik dyeing (The arrows pointing to Babesia microti).Original magnification: ×400 |
被检测血清标本未见特异性荧光,阳性对照可见,阴性对照未见(图 3)。
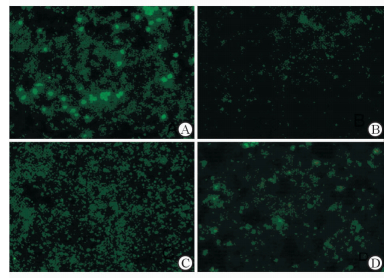
|
图 3 阳性标本的血清IFA结果 Fig 3 The IFA result of positive serum samples IFA: Indirect immunofluorescence assay. A: Positive control; B: Negative control; C: One of the 48 positive samples (titer ≤1∶16); D: One of the 48 positive samples (titer≥1∶64). Original magnification:×400 |
巴贝虫病呈全球分布,世界各地均有报道[13],我国只有少数巴贝虫病的报道,其中云南省2例(1984年)、内蒙古自治区1例(1996年)、台湾省3例(1994年、1994年及1998年)、浙江省1例(2002年),但对疫源地的调查开展较少[9]。本研究采集的标本对象是广西某血站献血员,广西是亚热带地区,丛林密布,此种环境会有蜱虫出没。本组检测结果阳性的人员中有1名献血员是被蜱虫叮咬后确诊为巴贝虫病,其他人员被怀疑有巴贝虫感染。
本实验结果显示巴贝虫属18S rRNA的Nest-PCR阳性标本48份,巴贝虫感染总阳性率2.53%(48/1 900),而巴贝虫属β-tubulin的Nest-PCR只有6份测序比对结果是巴贝虫,其差异性由两种引物的灵敏度测试实验可以说明,前者灵敏度远高于后者。镜下观察到38份阳性标本的血涂片红细胞内有核呈圆形且致密、胞质呈环形且纤细的环状体,亦可见类似疟原虫裂殖体样结构;其余10份阳性标本的血涂片没有观察到巴贝虫,但是红细胞有棘突,淋巴细胞常见。有文献报道,镜检巴贝虫是最便宜、最快速的传统方法,而灵敏度和特异性有限制,需经验丰富的镜检观察者且血液中有足够量的寄生虫才可以被检测到,低寄生虫血症不会被镜检到[14, 15, 16],这提示有隐蔽的寄生虫血症和(或)低于检测极限下的寄生虫血症的存在。另外,48份阳性标本血清IFA未见特异性荧光,血清学方法检测巴贝虫的缺点在于抗巴贝虫特异性抗体在感染的动物体内需要几天或几周才出现,感染早期或血清转化很难被检测到,急性感染期尚未产生针对巴贝虫的抗体[11, 17, 18]。本研究的标本采集完成后在广西某实验室存放,经过很长时间空运到实验室,4℃放置一段时间后才取血清存放于-20℃待Nest-PCR筛选后进行IFA检测,可能在标本运输、保存这个阶段内抗体效价已经大打折扣,而且阳性标本镜检原虫率本就很低,寄生虫低水平感染会使得IFA检测困难[18]。Nest-PCR方法灵敏度高、特异性强,本研究以巴贝虫属18S rRNA的Nest-PCR方法筛查采集的标本进行巴贝虫病的相关调查,外周血基因组DNA提取、Nest-PCR在不同房间的生物安全柜进行,避免了样品污染可能,阳性标本扩增的核苷酸片段大小不同,与阳性对照田鼠巴贝虫序列经MegAlign软件进行比对,序列在保守区域相似度极高,并不完全相同。48份阳性标本BLAST序列与不同种的巴贝虫序列经Clustal X软件对位排列,采用MegAlign软件做系统进化树构建,设立什曼原虫(Leishmaria obnovari)为外群,结果与NCBI的BLAST结果一致,均与田鼠巴贝虫亲缘关系很近。
有文献表明,引起巴贝虫病的主要是田鼠巴贝虫[11],而巴贝虫病是以蜱为媒介的血源性寄生虫病,一种新发传染病,在全球热带和亚热带地区广泛流行[19]。近年来由于输血而引起感染的病例持续增多[20],作为血源性寄生虫病,在血站血液质量管理中更加值得重视。通常血站血液检测项目有:采用ELISA法检测HBsAg、抗HCV、抗HIV;采用赖氏法检测ALT,采用RPR法、TRUST法检测梅毒,尚无血源性寄生虫病检测项目。通过输血传播的巴贝虫病潜伏期为1~9周,临床症状的轻重与巴贝虫虫种以及宿主的免疫功能有关,接受输血的人群多数身体虚弱、免疫力低下,如果接受了隐性感染者的血液或将出现严重后果,甚至死亡。文献报道无症状的感染可持续数月至数年,特别是40岁以下健康人可能在整个过程中保持亚临床状态;而脾切除患者、接受免疫抑制剂治疗患者、合并HIV感染及年龄超过50岁的患者临床表现常较严重,可出现急性呼吸窘迫综合征(ARDS)、弥散性血管内凝血(DIC)、充血性心力衰竭、肾衰竭、心肌梗死、脾梗死或脾破裂导致致命并发症,重型者于5~8 d内死亡[8]。另外,检测隐性感染人群可进行疾病的早期治疗,避免持久的寄生虫血症,也可以从血库中排除已被污染的血液[21]。故血源性寄生虫病需要得到血站关注。
近年来蜱病流行频率逐渐增加,蜱虫叮咬人类病例屡有报道[22, 23],有必要严谨检查人群中的感染状况及分布特征,建议有关部门加强血源管理,在蜱高峰期季节、有巴贝虫病病例报道的区域加强对供血者检测,以便更好地做好传染病管理工作,同时避免媒介蜱类活动季节进入疫区、定期灭蜱、尽量避免与啮齿动物接触。本研究也为巴贝虫感染提供了高灵敏性、强特异性且快速的检测方法。
| [1] | 何登明, 王宇明.人巴贝虫病研究进展[J].中华传染病杂志, 2012, 10:638-640. |
| [2] | Vannier E, Krause P J.Human babesiosis[J].N Engl J Med, 2012, 366: 2397-2407. |
| [3] | Jefferies R, Ryan U M, Muhlnickel C J, Irwin P J. Two species of canine Babesia in Australia: detection and characterization by PCR[J].J Parasitol, 2003, 89: 409-412. |
| [4] | Qi C, Zhou D, Liu J, Cheng Z, Zhang L, Wang L, et al.Detection of Babesia divergens using molecular methods in anemic patients in Shandong Province, China[J].Parasitol Res, 2011, 109: 241-245. |
| [5] | Herwaldt B L, Linden J V, Bosserman E, Young C, Olkowska D, Wilson M.Transfusion-associated babesiosis in the United States: a description of cases[J]. Ann Intern Med, 2011, 155: 509-519. |
| [6] | Hunfeld K P, Hildebrandt A, Gray J S.Babesiosis: recent insights into an ancient disease[J]. Int J Parasitol, 2008, 38: 1219-1237. |
| [7] | Vannier E, Gewurz B E, Krause P J.Human babesiosis[J].Infect Dis Clin North Am, 2008, 22: 469-488, viii-ix. |
| [8] | 汪恭富, 钱存忠, 王存刚, 殷玉武, 梁 军, 王启顺, 等.南京地区犬巴贝斯虫病的诊断与治疗[J].中国兽医寄生虫病, 2007, 15:20-23. |
| [9] | 范东辉, 李 明, 徐翮飞, 呼满霞, 张 箭, 孙 毅.鼠与蜱感染人致病性巴贝虫状况的初步研究[J]. 中华卫生杀虫药械, 2012, 18:48-50. |
| [10] | Wei Q, Tsuji M, Zamoto A, Kohsaki M, Matsui T, Shiota T, et al.Human babesiosis in Japan: isolation of Babesia microti-like parasites from an asymptomatic transfusion donor and from a rodent from an area where babesiosis is endemic[J]. J Clin Microbiol, 2001, 39: 2178-2183. |
| [11] | Zamoto A, Tsuji M, Wei Q, Cho S H, Shin E H, Kim T S, et al.Epizootiologic survey for Babesia microti among small wild mammals in northeastern Eurasia and a geographic diversity in the β-tubulin gene sequences[J]. J Vet Med Sci, 2004, 66: 785-792. |
| [12] | Young C, Chawla A, Berardi V, Padbury J, Skowron G, Krause P J;Babesia Testing Investigational Containment Study Group.Preventing transfusion-transmitted babesiosis: preliminary experience of the first laboratory-based blood donor screening program[J]. Transfusion, 2012, 52: 1523-1529. |
| [13] | Armstrong P M, Katavolos P, Caporale D A, Smith R P, Spielman A, Telford S R 3rd. Diversity of Babesia infecting deer ticks (Ixodes dammini)[J]. Am J Trop Med Hyg, 1998, 58: 739-742. |
| [14] | Cacciò S, Cammà C, Onuma M, Severini C.The β-tubulin gene of Babesia and Theileria parasites is an informative marker for species discrimination[J]. Int J Parasitol, 2000, 30: 1181-1185. |
| [15] | Homer M J, Aguilar-Delfin I, Telford SR 3rd, Krause P J, Persing D H. Babesiosis[J]. Clin Microbiol Rev, 2000, 13: 451-469. |
| [16] | Mosqueda J, Olvera-Ramirez A, Aguilar-Tipacamu G, Canto G J. Current advances in detection and treatment of babesiosis[J]. Curr Med Chem, 2012, 19: 1504-1518. |
| [17] | Ong K R, Stavropoulos C, Inada Y.Babesiosis, asplenia, and AIDS[J].Lancet, 1990, 336: 112. |
| [18] | Tonnetti L, Eder A F, Dy B, Kennedy J, Pisciotto P, Benjamin R J, et al.Transfusion-transmitted Babesia microti identified through hemovigilance[J]. Transfusion, 2009, 49: 2557-2563. |
| [19] | Liu A, Yin H, Guan G Q, Schnittger L, Lin Z J, Ma M L, et al. At least two genetically distinct large Babesia species infective to sheep and goats in China [J].Vet Parasitol, 2007, 147(3-4): 246-251. |
| [20] | Guhemot D M , Lucey C T, Lee K C, Conley G B, Holness L G, Wise R P. Babesia infection through blood transfusions:reports received by the US Food and Drug Administration, 1997-2007[J]. Clin Infect Dis, 2009, 48: 25-30. |
| [21] | 孙嘉慧, 韩建平, 冯 正, 胡 薇.田鼠巴贝虫病诊断方法的研究进展[J].中华寄生虫学与寄生虫病杂志, 2013, 3:235-241. |
| [22] | 张 萍.蜱叮咬伤6例临床分析[J].中国社区医师, 2008, 10:113. |
| [23] | 王 建, 石 年, 陈用军.蜱咬伤1例[J].中国医学文摘: 皮肤科学, 2011, 24:182. |
 2016, Vol. 37
2016, Vol. 37


