2. 第二军医大学长海医院创伤骨科, 上海 200433
2. Department of Trauma Orthopaedics, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
目前因多种因素导致的骨缺损的治疗仍是临床的难点。骨移植是骨缺损的首选治疗方法,其中自体骨移植是骨移植的金标准,但存在取材有限、增加患者痛苦等缺点[1, 2]。同种异体骨和异体骨虽然取材较自体骨广,但也存在感染疾病、免疫反应等风险,且患者不易接受[3]。骨移植材料的研究给临床上治疗骨缺损带来了福音。大豆异黄酮(isoflavone,IS)的化学结构与雌激素十分相似,能与雌激素受体结合,产生类似雌激素的生物效应[4],具有良好的生物相容性和生物活性,可促进成骨细胞生长、增加成骨细胞的蛋白质合成,还能增加成骨细胞的生物学标记物——碱性磷酸酶(ALP)的活性,使DNA和钙含量增加[5, 6, 7] 。介孔玻璃水泥(介孔孔径:2~10 nm)具有巨大的比表面积和孔容及可调的纳米孔道,具有药物负载量大和缓释效果良好的特点[8, 9, 10]。本研究探索将两种材料均匀组合复合支架材料形成载药的可注射生物活性材料,于2013年6月至2014年6月完成本实验,旨在评价IS介孔玻璃水泥支架材料修复兔股骨骨缺损的效果,为临床治疗骨软骨缺损提供实验依据。
1 材料和方法 1.1 实验材料硝酸钙[Ca(NO3)2·4H2O]、硝酸镁[Mg(NO3)2·6H2O](美国Sigma-Aldrich公司),大豆IS(西安迪诺生物科技有限公司),游标卡尺、线锯(上海赛拓五金工具有限公司),倍尔康非接触电子体温计(JXB-180,广州市番禺金鑫宝电子有限公司),电子称( WX-46A-1,北京世纪卓越信息技术有限公司),医用测深器(80W/YL,安徽省宿州金鹿医疗器械销售有限公司),硬组织切片机(Leica 1600,上海创迅医疗器械有限公司),H-E 染色剂(第二军医大学长海医院中心实验室提供),戊巴比妥钠(北京雅安达生物技术有限公司),青霉素钠(哈药集团制药总厂)。
1.2 IS介孔硅酸钙镁/硫酸钙骨水泥的制备 1.2.1 介孔硅酸钙镁(mesoporous magnesium calcium silicate,m-MCS)粉末的制备采用模板诱导和自组装方法合成m-MCS粉末。用非离子型嵌段共聚物P123(相对分子质量 5 800,Sigma-Aldrich)作为结构导向剂,将P123溶解在去离子水中,磁力搅拌器强烈搅拌至溶液澄清;用37%浓盐酸调节溶液体系的pH值至1,所得溶液在磁力搅拌下经水热处理,将溶液加热到56℃。称取7.9 g Ca(NO3)2·4H2O、7.3 g Mg(NO3)2·6H2O和15 g 正硅酸乙酯(TEOS)加入混合溶液中,56℃强烈搅拌4 h后形成均匀的白色沉淀。将该溶胶在80℃下陈化1 d后烘干,烘干的粉末用马弗炉于550℃焙烧6 h,升温速率1℃/min,得到m-MCS粉末。
1.2.2 硫酸钙(calcium sulphate,CS)粉末的制备精密称取硫酸钾43.59 g、Ca(NO3)2 64 g分别溶于500 mL蒸馏水中,混合以上两种溶液,静置沉淀。布氏漏斗过滤抽干沉淀,洗涤沉淀后再过滤抽干,40℃下烘干沉淀并研磨,置于200℃干燥箱中干燥24 h后立即取出溶于100 mL蒸馏水中并浸泡24~48 h。待溶液形成良好晶形后,滤掉上层溶液,低温烘干并研磨过120目筛,在鼓风干燥器中110℃烘干粉末即得二水硫酸钙(CaSO4·2H2O)。将CaSO4·2H2O粉末在常压下经120℃加热煅烧60 min,使其脱去1.5个结晶水,即得CS粉末。
1.2.3 复合骨水泥的制备按质量配比0∶100、20∶80和40∶60,精密称取相应质量的m-MCS和CS粉末放入调和盘中,搅拌均匀,加入固化液调成水泥浆后倒入聚四氟乙烯模具中成型,制成12 mm×2 mm的圆片。取制备好的圆片材料放入100%相对湿度、37℃环境中固化24 h即制得CS、20 m-MCS/CS和40 m-MCS/CS 3种骨水泥。
1.2.4 大豆IS载药体系的制备取0.5 g大豆IS溶于100 mL乙醇溶液中,加入5 g m-MCS粉末,磁力搅拌2 h,1 252×g离心,除去上清液,沉淀于37℃烘干待用。将吸附了IS的m-MCS粉末按1.2.3 项中的质量配比与CS混合,加入固化液调成水泥浆并固化,制成载有IS的CS/IS、20 m-MCS/CS/IS和40 m-MCS/CS/IS骨水泥。
1.3 大豆IS缓释实验取制备好的20 m-MCS/CS/IS、40 m-MCS/CS/IS和CS/IS骨水泥分别置于10 mL离心管中,滴入PBS(pH 7.4),置于37℃恒温振荡箱中,分别在1、3、5、7、10、15、21、25 d时取出,吸取1 mL上清液于96孔板中,用紫外分光光度计测定光密度(D)值,并根据回归方程算出缓释量,得出缓释比例,计算不同时间点大豆IS的累积释放率。
1.4 动物分组及骨缺损模型制作采用新西兰大白兔右侧股骨末端骨缺损作为骨缺损模型进行支架材料修复。出生2个月左右、体质量为2.0~2.5 kg的健康雄性新西兰大白兔60只,由第二军医大学动物实验中心提供[动物许可证号SYXK(沪)2012-0003],随机分成4组: CS组、20 m-MCS/CS组、40 m-MCS/CS组和40 m-MCS/CS/IS组,每组15只。所有兔在相同环境下饲养。术前剃去兔手术部位的毛发,用75%乙醇消毒。在无菌环境下进行手术,首先按体质量1 mL/kg的剂量经兔耳缘静脉注射4%戊巴比妥钠溶液,全身麻醉后切开兔右侧股骨末端的皮肤和肌肉,使用拉钩拨开肌肉组织,暴露右侧股骨末端。用骨科钻钻出6 mm×6 mm的孔,用纱布止血后,根据分组分别植入CS、20 m-MCS/CS、40 m-MCS/CS或40 m-MCS/CS/IS骨水泥于骨洞中,然后对伤口进行缝合,并用青霉素消毒。术后连续3 d注射青霉素以防伤口感染,持续观察兔术后的恢复情况。
1.5 同步辐射micro-CT成像术后第4、8、12 周各组随机处死5只兔,取兔植入骨水泥的股骨,剔去肌肉等软组织后送micro-CT检测,骨标本在上海同步辐射-生物医学应用光束线站(BL13W)进行成像分析。采用Image-Pro Plus 6.3图像分析软件对收集的图像去除背景,并用VG studio MAX 2.1 CT可视化软件(Volume Graphics公司)对图像进行三维重构。
1.6 术后组织学检查取上述骨标本用2.5%的戊二醇固定3 d,然后浸泡于甲醛-甲酸液中脱钙1周,脱钙结束后用PBS清洗骨标本,再用乙醇梯度脱水。将脱水后的骨标本用聚丙烯酸甲酯进行包埋,用硬组织切片机在垂直方向连续切片,获得厚度为150~200 μm的组织切片。取组织切片行三色染色:用二甲苯对脱钙切片进行脱蜡处理,苏木精染色10 min,并将玻璃上的多余染液用蒸馏水洗净。用1%盐酸-乙醇溶液(70%乙醇配制)进行分色,通过显微镜观察控制,分色到细胞核及染色质清晰为止。蒸馏水冲洗30 min后丽春红酸性品红溶液染色5 min,再次蒸馏水洗净多余染液,之后用1%磷酸钼溶液染色3 min,浸入苯胺蓝冰醋酸中染色5 min,最后用水迅速冲洗,将切片置于60℃干燥箱中烘干,用二甲苯透明2次,滴加适量中性树脂后加盖玻片封片,置于倒置显微镜下观察。每个骨标本切取1张切片,分析植入部位新生骨的生成以及材料的降解等情况。通过Image-Pro Plus软件对切片进行成骨量分析:将切片放置在倒置显微镜下,随机选取4个视野,视野的中心位置应距边界0.5 mm以上,通过测量切片成骨面积的平均值来分析每个骨标本的成骨量。
1.7 统计学处理采用SPSS 17.0统计软件进行分析,所有数据均以x±s表示,多组均数的多重比较用方差分析的LSD检验或Dunnett检验,检验水准(α)为0.05。
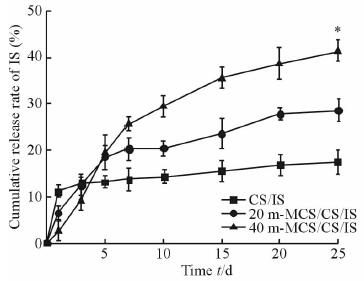
2 结 果 2.1 骨水泥缓释IS效应通过Origin软件计算CS/IS、20 m-MCS/CS/IS和40 m-MCS/CS/IS骨水泥对大豆IS缓释25 d的缓释曲线。结果(图 1)发现单纯CS/IS骨水泥对IS的释放在第1天为突释,释放量为(11.0±1.2)%,高于其他两组,差异具有统计学意义(P<0.05);但此后释放缓慢,几乎没有释放,到第25天总释放量为(16.0±2.6)%。20 m-MCS/CS/IS和40 m-MCS/CS/IS骨水泥对IS的释放均为缓释,但40 m-MCS/CS/IS的缓释效能及总缓释量更高:在第5天时两种骨水泥的缓释量相仿,差异无统计学意义(P>0.05);但在第25天20 m-MCS/CS/IS的释放量为(29.0±2.7)%,而40 m-MCS/CS/IS的释放量已高达(41.0±1.8)%,高于CS/IS组和20 m-MCS/CS/IS组(P<0.05)。
|
图 1 CS/IS、20 m-MCS/CS/IS、40 m-MCS/CS/IS骨水泥对IS的缓释曲线 Fig 1 Controlled release curves of IS by bone cement of CS/IS,20 m-MCS/CS/IS and 40 m-MCS/CS/IS m-MCS:Mesoporous magnesium calcium silicate;CS:Calcium sulphate; IS: Isoflavone. *P<0.05 vs the other two groups. n=5,x±s |
骨水泥支架植入兔股骨骨缺损3 d后,各组兔基本恢复正常,能正常进食、活动和排泄。术后1~14 d,各组兔植入材料区域均无感染现象,伤口愈合良好,所有切口甲级愈合;之后植入区域亦无感染现象发生。术后3个月内无一只兔发生意外死亡。以上现象表明植入材料对实验动物无明显不良影响。
4组支架材料植入兔股骨末端4、8和12周后,结果(图 2)显示,植入4周后,4组兔股骨缺损基本都愈合,植入材料已不可见,40 m-MCS/CS/IS组缺损部位的炎症反应比较明显;植入8周后,各组新生骨的骨面均基本与周围正常骨平齐,新生骨面探诊基本与正常骨相似。植入材料与周围骨组织间界面基本消失,材料在降解吸收的同时新骨长入骨缺损部位,新长入的骨已经和周围组织结合紧密;植入12周后,各组新生骨组织已经成熟、致密,与周围组织没有明显差别,表明4组骨水泥材料都具有优良的生物相容性和降解性能。

|
图 2 CS、20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS骨水泥植入4、8和12周后兔股骨骨缺损的愈合情况 Fig 2 Bone union of femoral defect of rabbits 4,8,and 12 weeks after implantation of bone cement CS,20 m-MCS/CS,40 m-MCS/CS and 40 m-MCS/CS/IS m-MCS:Mesoporous magnesium calcium silicate; CS: Calcium sulphate; IS:Isoflavone |
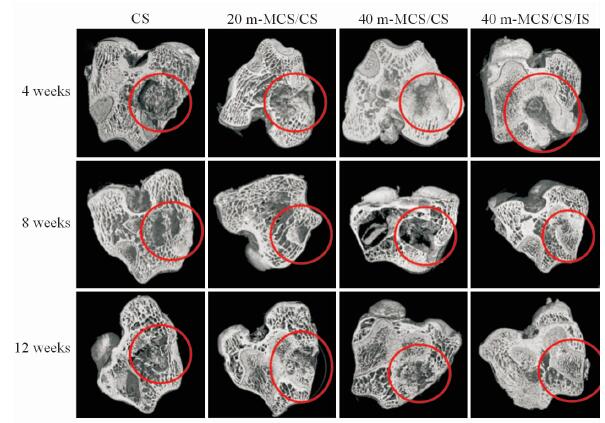
通过上海同步辐射光源的断层扫描成像技术及CT三维重构成像技术得到骨水泥支架植入缺损部位不同时间后的micro-CT三维图像(图 3)。可以发现随着时间的增长,20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS组3组支架植入的缺损部位均有新生骨组织向材料生长的迹象,而CS组在12周后缺损仍比较明显。在12周时,20 m-MCS/CS组缺损部位已有了一定程度的修复,40 m-MCS/CS组缺损部已基本愈合,而40 m-MCS/CS/IS组缺损部位已接近完全愈合并且骨小梁已贯穿骨缺损区。结果表明,CS组的骨修复性能较差,而40 m-MCS/CS组骨水泥相比于20 m-MCS/CS组骨水泥具有更高的成骨活性,40 m-MCS/CS/IS组骨水泥的骨修复性能最为出色。
|
图 3 CS、20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS骨水泥植入4、8和12周后兔股骨骨缺损的micro-CT图像 Fig 3 Micro-CT images of femoral defect of rabbits 4,8,and 12 weeks after implantation of bone cement CS,20 m-MCS/CS,40 m-MCS/CS and 40 m-MCS/CS/IS m-MCS: Mesoporous magnesium calcium silicate; CS: Calcium sulphate; IS: Isoflavone |
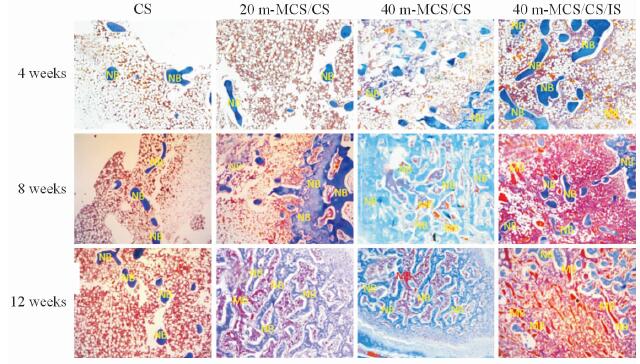
对4组骨水泥支架材料植入兔股骨末端4、8和12周后行三色染色,蓝色代表新生骨组织,深红色代表成熟骨组织,结果见图 4。
|
图 4 CS、20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS骨水泥植入4、8和12周后兔股骨骨缺损的三色染色图 Fig 4 Masson trichrome staining of femoral defect of rabbits 4,8,and 12 weeks after implantation of bone cement CS,20 m-MCS/CS,40 m-MCS/CS and 40 m-MCS/CS/IS NB: New bone; MB: Matrue bone; m-MCS: Mesoporous magnesium calcium silicate; CS: Calcium sulphate; IS: Isoflavone. Original magnification: ×100 |
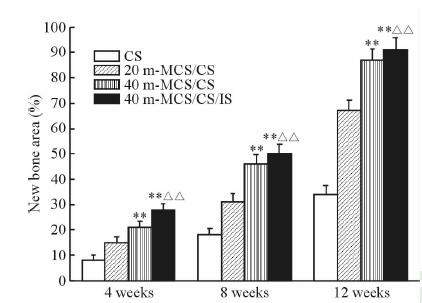
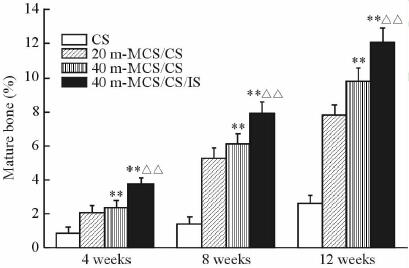
利用Image-Pro Plus软件对三色染色组织切片进行了统计学分析,得到支架植入后缺损部位不同时间的新生骨量及成熟骨量(图 5、6),4组支架植入体内后,材料均随着时间不断降解,并有新生骨和成熟骨的形成。支架植入体内12周后,CS组新生骨面积仅占(34.0±3.4)%,而成熟骨面积仅为(2.6±0.4)%;20 m-MCS/CS组新生骨面积为(67.0±3.6)%,成熟骨面积为(7.8±0.6)%;40 m-MCS/CS组材料基本降解,新生骨面积为(86.0±3.5)%,成熟骨面积达到(9.8±0.5)%;而40 m-MCS/CS/IS组材料也基本降解,新生骨面积为(91.0±3.4)%,成熟骨面积达到(11.8±0.7)%。结果表明,CS组的降解能力较差,成骨性能较低;20 m-MCS/CS组骨水泥降解速度较快,可以促进新生骨组织生长,但成熟骨面积小;40 m-MCS/CS和40 m-MCS/CS/IS组有更快的降解速度,能够促进大量新生骨和成熟骨的产生,两者促骨再生能力优于CS组及20 m-MCS/CS组(P<0.01),并且40 m-MCS/CS/IS组骨水泥的促成骨能力优于40 m-MCS/CS组,差异具有统计学意义(P<0.01),说明其具有良好的骨修复效果,而搭载IS后进一步增强了其成骨性能。
|
图 5 CS、20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS骨水泥植入4、8和12周后兔股骨骨缺损的新生骨量 Fig 5 New bone mass of femoral defect of rabbits 4,8,and 12 weeks after implantation of bone cement CS,20 m-MCS/CS,40 m-MCS/CS and 40 m-MCS/CS/IS m-MCS: Mesoporous magnesium calcium silicate; CS: Calcium sulphate; IS: Isoflavone. **P<0.01 vs CS and 20 m-MCS/CS; △△P<0.01 vs 40 m-MCS/CS. n=5,x±s |
|
图 6 CS、20 m-MCS/CS、40 m-MCS/CS和40 m-MCS/CS/IS骨水泥植入4、8和12周后兔股骨骨缺损的成熟骨量 Fig 6 Mature bone mass of femoral defect of rabbits 4,8,and 12 weeks after implantation of bone cement CS,20 m-MCS/CS,40 m-MCS/CS and 40 m-MCS/CS/IS m-MCS: Mesoporous magnesium calcium silicate; CS: Calcium sulphate; IS: Isoflavone. **P<0.01 vs CS and 20 m-MCS/CS; △△P<0.01 vs 40 m-MCS/CS. n=5,x±s |
本实验通过在CS中添加m-MCS增加了复合材料的孔隙率,而且通过体外药物缓释实验也发现,m-MCS的介孔结构起到了药物控释的效果。随着m-MCS含量的增加,复合材料的介孔增多,比表面积也增大,大量的药物被吸附进入介孔孔道,药物的缓释可以达到更好的效果。CS水泥的释放量在开始24 h内呈现突释,主要是因为部分IS附着在水泥表面,而内部的药物被固定在CS水泥结构内部,无法轻易释放出来。而40 m-MCS/CS的水泥表面有大量的介孔材料,因此药物可以有效地缓慢释放,提示m-MCS在药物装载和释放领域具有广泛的应用前景。
本研究通过在新西兰大白兔体内植入IS介孔玻璃水泥支架验证其对骨缺损的修复能力。植入4周后,缺损基本都愈合,但40 m-MCS/CS/IS组缺损部位存在一定的炎症反应,8周后炎症反应消失,可能跟大豆IS药物缓释相关。此外,所有动物的植入区域均未出现感染,切口均甲级愈合,表明IS介孔玻璃水泥支架具有良好的生物相容性。
本研究使用micro-CT观察各组在材料植入后骨缺损的修复过程,40 m-MCS/CS/IS组优于40 m-MCS/CS组,40 m-MCS/CS组优于20 m-MCS/CS组,而20 m-MCS/CS组优于单纯CS骨水泥组,可以看出,随着m-MCS比例的增加,支架的理化性能和骨代谢水平均提高,有效提高了骨组织支架的生物活性。
IS是一种良好的诱导骨生长的因子[11],组织学切片的观察结果与影像学的结果一致,40 m-MCS/CS/IS复合骨水泥有更快的降解速度,能够促进大量新生骨和成熟骨的产生,其促成骨能力也优于40 m-MCS/CS,说明IS介孔玻璃水泥具有良好的生物相容性和成骨能力,进一步证实载IS药物的m-MCS/CS骨水泥支架骨诱导性更强,因而骨再生能力更佳。
理想的骨移植材料应当具有良好的生物活性和生物相容性,在体内能完全降解,而且还应具有骨传导和骨诱导作用[12, 13, 14] 。本研究表明,IS介孔玻璃水泥作为骨修复移植物,具有优越的成骨作用和良好的降解性能,有望成为新型骨缺损修复材料。
| [1] | Meagher P J, Morrison W A. Free fibula flap-donor-site morbidity: case report and review of the literature[J]. J Reconstr Microsurg, 2002, 18: 465-468. |
| [2] | Gu Y D, Cheng D S, Zhang G M, Chen X M, Xu J G, Yang X B. Long-term results of toe transfer: retrospective analysis[J]. J Reconstr Microsurg, 1997, 13: 405-408. |
| [3] | Oikarinen J, Korhonen L K. The bone inductive capacity of various bone transplanting materials used for treatment of experimental bone defects[J]. Clin Orthop Relat Res, 1979, 140: 208-215. |
| [4] | Vitale D C, Piazza C, Melilli B, Drago F, Salomone S. Isoflavones: estrogenic activity, biological effect and bioavailability[J]. Eur J Drug Metab Pharmacokinet, 2013, 38: 15-25. |
| [5] | Singh S P, Wahajuddin, Ali M M, Jain G K. High-throughput quantification of isoflavones,biochanin A and genistein, and their conjugates in female rat plasma using LC-ESI-MS/MS: application in pharmacokinetic study[J]. J Sep Sci, 2010, 33: 3326-3334. |
| [6] | Jeon B J, Ahn J, Kwak H S. Effect of isoflavone-enriched milk on bone mass inovariectomized rats[J]. J Med Food, 2009, 12: 1260-1267. |
| [7] | D'Adamo C R, Sahin A. Soy foods and supplementation: a review of commonly perceived health benefits and risks[J]. Altern Ther Health Med, 2014, 20(Suppl 1): 39-51. |
| [8] | Schneider P, Hudec P, Solcova O. Pore-volume and surface area in microporous-mesoporous solids[J]. Micropor Mesopor Mater, 2008, 115: 491-496. |
| [9] | Vallet-Regí M, Balas F, Arcos D. Mesoporous materials for drug delivery[J]. Angew Chem Int Ed Engl, 2007, 46: 7548-7558. |
| [10] | vander Pol U, Mathieu L, Zeiter S, Bourban P E, Zambelli P Y, Pearce S G, et al. Augmentation of bone defect healing using a new biocomposite scaffold: an in vivo study in sheep[J]. Acta Biomater, 2010, 6: 3755-3762. |
| [11] | Zheng X, Lee S K, Chun O K. Soy isoflavones and osteoporotic bone loss: a review with an emphasis on modulation of bone remodeling[J]. J Med Food, 2016,19: 1-14. |
| [12] | Le Nihouannen D, Saffarzadeh A, Aguado E, Goyenvalle E, Gauthier O, Moreau F, et al. Osteogenic properties of calcium phosphate ceramics and fibrin glue based composites[J]. J Mater Sci Mater Med, 2007, 18: 225-235. |
| [13] | Horner E A, Kirkham J, Wood D, Curran S, Smith M, Thomson B, et al. Long bone defect models for tissue engineering applications: criteria for choice[J]. Tissue Eng Part B Rev, 2010, 16: 263-271. |
| [14] | Garcia P, Histing T, Holstein J H, Klein M, Laschke M W, Matthys R, et al. Rodent animal models of delayed bone healing and non-union formation: a comprehensive review[J]. Eur Cell Mater, 2013, 26: 1-14. |
 2016, Vol. 37
2016, Vol. 37


