近年来,肾肿瘤的发病率逐年升高,其中大多数为T1期肿瘤[1]。保留肾单位手术现已成为治疗T1a期肾肿瘤的金标准[2]。在保留肾功能方面,保留肾单位手术明显优于肾切除术,这也是推动保留肾单位手术持续开展的重要原因[3]。患者术后肾功能的保留主要取决于4个因素,即缺血的时间和类型、患者术前的肾功能、术中肾实质的保留量以及手术方式的选择[4]。术中降温和缩短肾缺血时间被认为是有效保护肾功能的方式[5]。然而在腹腔镜和机器人手术中,术中降温却开展困难[5],不能良好地达到有效的冷缺血温度;另一方面,腹腔镜手术操作难度较高,在缩短肾缺血时间方面也存在一定阻碍[6]。因此在微创保留肾单位手术中,缩小肾缺血范围是保护肾功能的另一有效方案。2011年,Gill等[7]提出了可行的选择性肾动脉阻断法,特异性阻断支配肿瘤的分支动脉,从而可使所保留的肾脏“零缺血”,但该方法操作难度及危险系数高,对术者操作能力要求高,不能有效地大规模开展。为了简化选择性肾动脉阻断技术,我们通过对尸体肾脏和肾切除术后的肾脏的肾门动脉进行解剖,发现肾动脉逐级分支为肾段动脉后,多数都紧贴肾门“门框”处进入肾脏,遂提出了 “蛙跳式”选择性分支动脉阻断法,并初步探讨了该方法在保留肾单位手术中的可行性及安全性。
1 材料和方法 1.1 “蛙跳式”选择性肾动脉阻断法的解剖基础2014年8月至2015年8月,对5对尸体肾脏和20个行肾切除术的肾脏行肾动脉血管解剖。对5对尸体肾脏的动静脉给予注胶,分别以红色和蓝色来标注动脉和静脉。观察肾门处分支动脉和分支静脉的走行及其与肾门的位置关系。对20个肾切除术的肾脏的肾门动脉进行解剖,观察动脉的分支走行及与肾门的位置关系。
1.2 “蛙跳式”选择性肾动脉阻断法的临床探索2014年8月至2015年8月,回顾性研究10例腹腔镜保留肾单位手术,其中5例采用“蛙跳式”选择性分支动脉阻断法,另外5例随机选取同期行传统选择性分支动脉阻断法的病例。分别记录游离肾脏肿瘤后至阻断肿瘤靶向分支动脉的时间和热缺血时间。
1.2.1 术前检查术前对患者行双肾CTA检查,仔细寻找支配肿瘤的靶向分支动脉,观察靶向分支动脉与肿瘤及肾动脉主干之间的位置关系以及是否存在明确的多支动脉支配,从而辅助制定手术方案。
1.2.2 传统选择性分支动脉阻断法先分离肾动脉主干,根据“从主到次”的顺序依次分离次级动脉,直至寻找出支配肿瘤的分支动脉(图 1A)。

|
图 1 传统选择性分支动脉阻断法(A,红色箭头)和“蛙跳式”选择性分支动脉阻断法(B,红色箭头)示意图 Fig 1 Laparoscopic partial nephrectomy using traditional superselective artery clamping (A, red arrows) and “island hopping” superselective approach (B, red arrows) |
首先分离肾动脉主干,随后跨越肾门,直接寻找肿瘤所在位置,并紧贴肾实质表面剔除肾脏表面脂肪,沿着肿瘤朝肾门的方向逐步分离至肾门“门框”处,直接寻找支配肿瘤的分支动脉,给予阻断并行肿瘤切除及创面缝合(图 1B)。
2 结 果 2.1 解剖学基础通过对尸体肾脏及肾切除术中被切除肾脏肾门部的血管进行解剖,并结合理论解剖知识,我们发现肾动脉逐级分支为肾段动脉后,多数都紧贴肾门“门框”处进入肾脏(图 2、3)。5对尸体肾脏共见54根分支动脉进入肾脏,其中39根(72.2%)分支动脉紧贴“门框”进入肾脏。20例肾切除术后的肾脏中共见96根分支动脉进入肾脏,其中有68根(70.8%)动脉沿着肾门“门框”处进入肾脏。
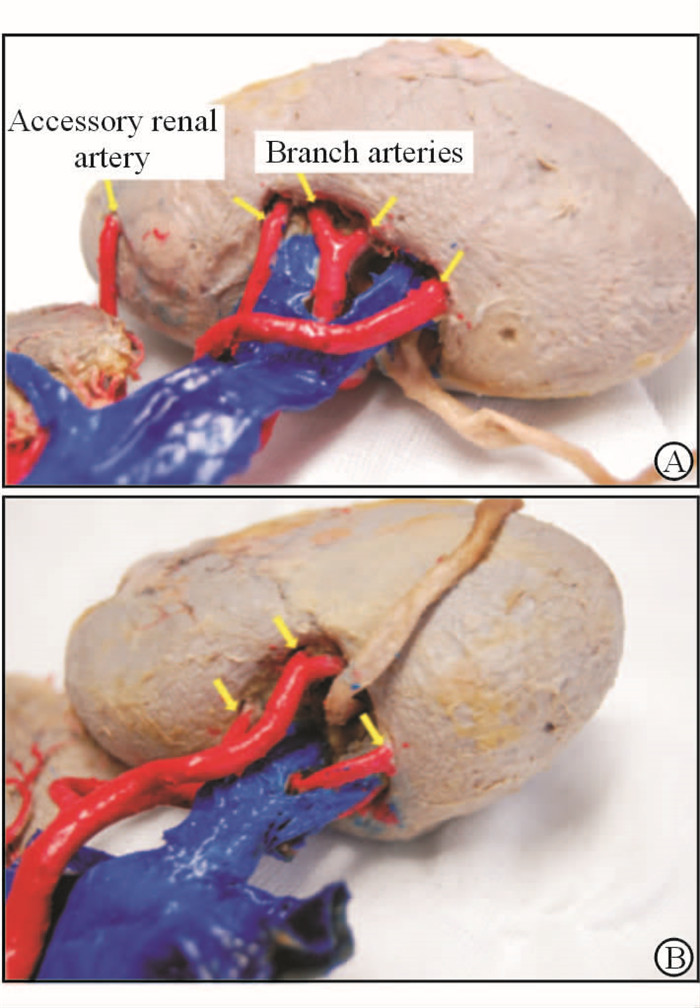
|
图 2 尸体肾脏解剖标本 Fig 2 Anatomic views of cadaveric kidneys Arrows mark the branch arteries |
|
图 3 2例(A、B)肾脏切除术后肾脏肾门分支动脉解剖图 Fig 3 Anatomic views of branch arteries of the kidneys from radical nephrectomy of 2 patients (A, B) Arrows mark the branch arteries |
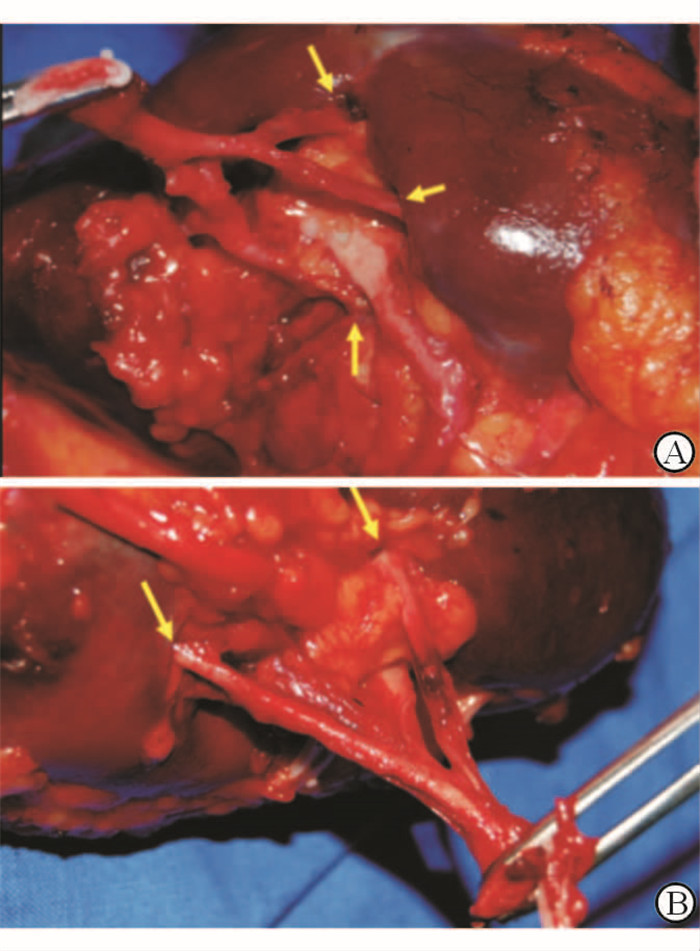
10例患者手术均安全顺利完成,肿瘤切缘均阴性,无中转肾切除术,无中转开放(图 4、5)。5例“蛙跳式”肾动脉阻断组的患者中有1例因分支动脉阻断效果不理想,更改为阻断肾动脉主干。行传统选择性分支动脉阻断法的游离肿瘤后至阻断分支动脉的时间为10~18 min,热缺血时间为15~25 min;行“蛙跳式”选择性分支动脉阻断法的游离肿瘤后至阻断分支动脉时间为6~11 min,热缺血时间为14~26 min。

|
图 4 传统分支动脉阻断法实际操作图 Fig 4 Laparoscopic partial nephrectomy using traditional superselective artery clamping |
|
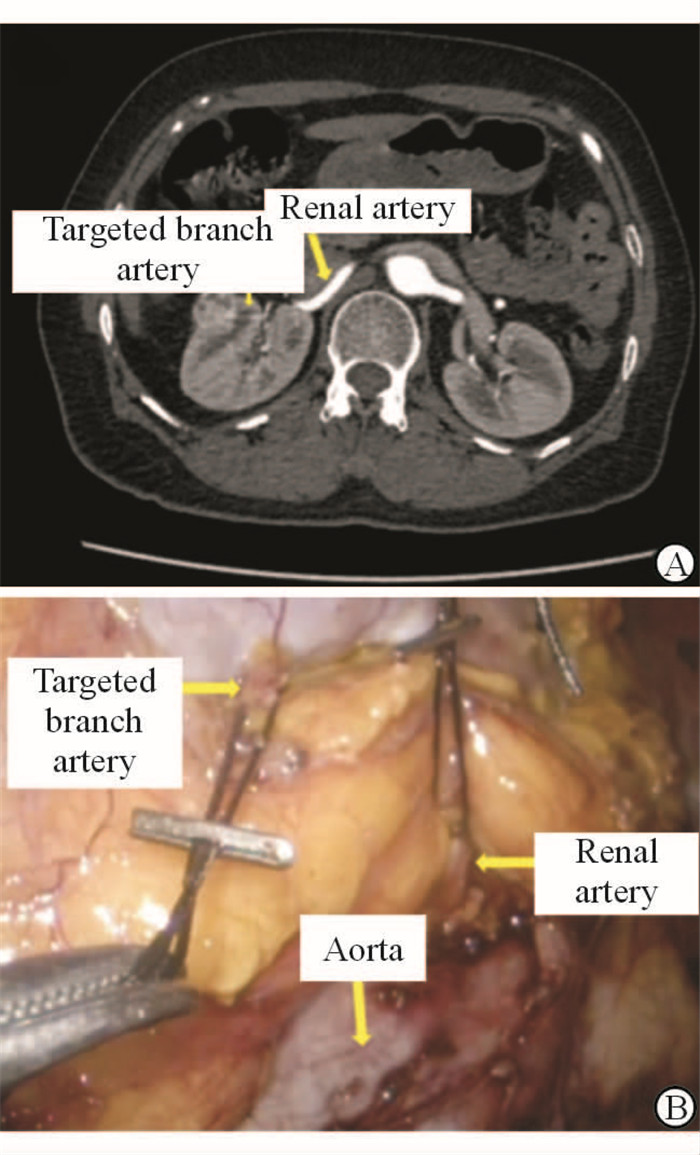
图 5 “蛙跳式”选择性分支动脉阻断法实际操作图 Fig 5 Laparoscopic partial nephrectomy using “island hopping” superselective artery clamping A: The preoperative CTA of the patient (arrows mark the renal artery and targeted branch artery); B: Arrows mark the aorta, renal artery and targeted branch artery. CTA: Computed tomography angiography |
保留肾单位手术是治疗T1a期肾肿瘤的金标准[2]。随着微创时代的到来,微创保留肾单位手术(腹腔镜保留肾单位手术和机器人辅助腹腔镜保留肾单位手术)逐渐推广盛行,并逐渐成为首选的手术方式[8]。为了将肿瘤完整切除,降低切缘阳性率,清晰的手术视野对微创保留肾单位手术尤为重要,而肾动脉阻断是提供清晰手术视野的必要条件[8]。肾门阻断既往被认为是保留肾单位手术中提供无血视野的标准步骤,然而肾脏血流的阻断会导致肾缺血损伤,热缺血损伤被认为是影响术后肾功能恢复的最重要的手术因素[9]。由于微创手术技术难度高,导致微创保留肾单位手术对肾缺血时间需求更长,因此降低术后肾功能损害是该术式的难点和热点。尽管冷缺血较热缺血而言能更好地保护肾脏功能,但在微创保留肾单位手术中却难以开展且很难达到有效的冷却温度[5]。因此,缩小肾缺血体积是微创保留肾单位手术减少肾功能损伤的另一突破点。
2008年,Nohara等[10]首次提出了选择性肾动脉阻断的概念。随后,Benway 等[11]证实了该方法可有效地改善肾功能。2011年,Gill等[7]提出了可行的选择性分支动脉阻断的方法,使得该技术得以采纳。2014年,Desai等[12] 比较了机器人保留肾单位手术中选择性肾动脉阻断法和肾门阻断法对术后肾功能的影响,发现选择性肾动脉阻断可以减少术后肾小球滤过率(GFR)的降低,进一步证实选择性肾动脉阻断是保护术后肾功能的有效方法。然而,Gill等[7]所提出的分支动脉阻断法也存在局限性。由于肾门部血管分支较多,动脉与静脉常有伴行,在分离分支动脉时易出现周围静脉的损伤。另外,该方法对术者及整个手术团队的技术要求较高,难以得到广泛开展。
2013年,殷长军等[13, 14]提出了选择性肾段动脉阻断技术,该方法能将组织缺血较精确地局限在肿瘤区域,保证肿瘤完整切除的基础上最大限度保留有功能的肾单位,进而推动了该方法在保留肾单位手术中的应用。该方法首先在术前行双源CT血管造影术(DSCTA)并进行三维肾动脉重建,系统地分析评估肿瘤的放射学特点,包括肿瘤大小、位置、生长类型、肾动脉分支与肿瘤的解剖学关系等,进而寻找出供应肿瘤的肾段动脉。该手术采用腹膜后路径,不常规分离肾动脉主干。术中若采用肾门后入路,则在距离肾门1.0~2.0 cm处直接寻找和分离肾段动脉,若采用肾门前入路,则在距离肾门0.5~1.0 cm处分离肾段动脉,最后给予阻断并行肿瘤切除及创面缝合。然而,该方法也存在一定的局限性。首先,该方法在术前需要对影像学资料进行重新加工,需要精尖的影像学技术和后期制作辅助完成,一般单位难以完成;其次,该方法对术者的操作技能要求极高。该方法在距离肾门0.5~2.0 cm处直接寻找分离分支动脉,不分离肾动脉主干,在无法保证目标血管能完全覆盖肿瘤区域的情况下,术中可能存在阻断不完全、出血过多、手术视野模糊等情况,进而手术存在一定的风险;另外,在肾门后1.0~2.0 cm及肾门前0.5~1.0 cm的范围内分离肾动脉分支,定位不够精确,初学者不易掌握。
由于肾门处血管密集,动静脉交错,直接打开血管鞘分离分支动脉仍存在较高的风险性,若采用从主到次的顺序依次分离,操作不当也极易损伤伴行的分支静脉,风险较大,尤其针对手术能力欠佳的术者。所以,进一步简化选择性分支动脉阻断的技术方法是本课题的研究核心。结合解剖学基础[15, 16]、尸体肾脏和肾切除术后肾脏的肾门血管解剖及CT三维重建影像,我们发现多数肾段动脉于肾门的“门框”处进入肾脏,为“蛙跳式”选择性肾动脉阻断法奠定了理论基础。
“蛙跳式”选择性肾动脉阻断法在术前仅需行传统的双肾CTA检查,结合横断面及肾动脉三维重建影像,明确肿瘤位置,并在肿瘤附近寻找支配肿瘤且贴近肾脏实质旁进入肾脏的分支动脉。术中常规方法分离肾动脉主干,随后打开肾周脂肪,显露肿瘤,贴着肾实质表面,向肾窦分离,凭借动脉搏动,找到目标血管,并用小型阻断夹给予阻断。阻断分支动脉后,观察肿瘤周围肾实质的颜色变化,如果缺血范围覆盖整个瘤体,则直接行肿瘤切除及创面缝合。若不能完全覆盖,或者术中创面出血较多,手术视野较差,则需阻断肾动脉主干,保证视野清楚,利于手术顺利进行。经临床初步应用发现,与顺行寻找分支动脉相比,本课题组通过“蛙跳”的方式,缩短了游离肾脏肿瘤后至阻断分支动脉的时间(分别为10~18 min和6~11 min),使手术更加快捷。
与殷长军等[13, 14]的肾段动脉阻断法相比,“蛙跳式”选择性分支动脉阻断法具有以下几个优势:(1)术前不需精尖的影像学技术支持,仅需给予传统的双肾CTA检查辅助寻找肿瘤靶向动脉;(2)该方法避开了操作危险区即肾门分支动脉静脉伴行区,操作难度及危险程度均有所降低,对术者操作技能要求降低,一定程度上可增加操作的安全性和可重复性;(3)在采用“蛙跳式”选择性分支动脉阻断法时,首先需分离肾动脉主干,以备在分支动脉阻断不理想、无法寻找特异支配的分支动脉或者在寻找分支动脉时出现损伤等情况下可及时地阻断肾动脉主干,进而保证手术的顺利进行,安全系数高。总而言之,该方法尤其适用于刚开始开展该类手术,手术技能不足够熟练的术者。
然而,“蛙跳式”选择性分支动脉阻断法和传统的选择性分支动脉阻断法一样也存在局限性。并非所有类型的肿瘤均能采用该方法准确找出分支动脉并完成保留肾单位手术。对于肾门部、中央型肾肿瘤及瘤体较多位于肾实质内的肾肿瘤,只有阻断上一级的动脉才能获得有效的“无血”视野,从而利于肿瘤的切除及创面的缝合。对于大体积的肿瘤,若存在非单支动脉支配,也需阻断更上一级的动脉才能达到理想的阻断效果。
总之,“蛙跳式”选择性分支动脉阻断法一方面具有可减少损伤肾功能的优点,另一方面较传统的选择性分支动脉阻断法操作更简单、更具可重复性,危险性更低,对术者的操作技术要求较传统的分支动脉阻断法更低,更利于推广。本研究收集病例数较少,后期将进一步扩大样本量,开展该项技术。
| [1] | Kane C J, Mallin K, Ritchey J, Cooperberg M R, Carroll P R. Renal cell cancer stage migration: analysis of the National Cancer Data Base[J]. Cancer,2008,113:78-83. |
| [2] | Campbell S C, Novick A C, Belldegrun A, Blute M L, Chow G K, Derweesh I H, et al. Guideline for management of the clinical T1 renal mass[J]. J Urol,2009,182:1271-1279. |
| [3] | Scosyrev E, Messing E M, Sylvester R, Campbell S, Van Poppel H. Renal function after nephron-sparing surgery versus radical nephrectomy: results from EORTC randomized trial 30904[J]. Eur Urol,2014,65:372-377. |
| [4] | Lane B R, Babineau D C, Poggio E D, Weight C J, Larson B T, Gill I S, et al. Factors predicting renal functional outcome after partial nephrectomy[J]. J Urol,2008,180:2363-2369. |
| [5] | Mir M C, Campbell R A, Sharma N, Remer E M, Simmons M N, Li J, et al. Parenchymal volume preservation and ischemia during partial nephrectomy: functional and volumetric analysys[J]. Urology,2013,82:236-238. |
| [6] | Gill I S, Matin S F, Desai M M, Kaouk J H, Steinberg A, Mascha E, et al. Comparative analysis of laparoscopic versus open partial nephrectomy for renal tumors in 200 patients[J]. J Urol,2003,170:64-68. |
| [7] | Gill I S, Eisenberg M S, Aron M, Berger A, Ukimura O, Patil M B, et al. "Zero ischemia" partial nephrectomy: novel laparoscopic and robotic technique[J]. Eur Urol,2011,59:128-134. |
| [8] | Khoder W Y, Zilinberg K, Waidelich R, Stief C G, Becker A J, Pangratz T, et al. Ex vivo comparison of the tissue effects of six laser wavelengths for potential use in laser supported partial nephrectomy[J]. J Biomed Opt, 2012,17:068005. |
| [9] | Thompson R H, Lane B R, Lohse C M, Leibovich B C, Fergany A, Frank I, et al. Renal function after partial nephrectomy: effect of warm ischemia relative to quantity and quality of preserved kidney[J]. Urology,2012,79:356-360. |
| [10] | Nohara T, Fujita H, Yamamoto K, Kitagawa Y, Gabata T, Namiki M. Modified anatrophic partial nephrectomy with selective renal segmental artery clamping to preserve renal function: a preliminary report[J]. Int J Urol, 2008,15:961-966. |
| [11] | Benway B M, Baca G, Bhayani S B, Das N A, Katz M D, Diaz D L, et al. Selective versus nonselective arterial clamping during laparoscopic partial nephrectomy: impact upon renal function in the setting of a solitary kidney in a porcine model[J]. J Endourol,2009,23:1127-1133. |
| [12] | Desai M M, de Castro Abreu A L, Leslie S, Cai J, Huang E Y, Lewandowski P M, et al. Robotic partial nephrectomy with superselective versus main artery clamping: a retrospective comparison[J]. Eur Urol, 2014,66:713-719. |
| [13] | Shao P, Tang L, Li P, Xu Y, Qin C, Cao Q,et al. Application of a vasculature model and standardization of the renal hilar approach in laparoscopic partial nephrectomy for precise segmental artery clamping[J]. Eur Urol,2013,63:1072-1081. |
| [14] | 殷长军,邵鹏飞,秦 超. 肾段动脉阻断技术在腹腔镜肾部分切除手术中的应用与技术要点分析(附光盘)[J]. 现代泌尿外科杂志,2013,18:532-534. |
| [15] | Graves F T. The anatomy of the intrarenal arteries and its application to segmental resection of the kidney[J]. Br J Surg,1954,42:132-139. |
| [16] | Rocco F, Cozzi G. Renal anatomy, physiology and its clinical relevance to partial nephrectomy[M]//Patel V R, ed. Robotic urologic surgery. London: Springer, 2012:277-286. |
 2016, Vol. 37
2016, Vol. 37


