羟基磷灰石(hydroxyapatite,HA)与人骨磷灰石成分组成、结构相似,因其良好的生物相容性、生物活性已广泛应用于硬组织缺损修复、植入体表面涂层和骨缺损充填。然而其结晶度、结构稳定性比骨磷灰石高,植入后不易降解,作为残留于骨组织中的异质,容易成为植入部位感染源和种植障碍物,不利于骨缺损修复及种植体的骨性结合[1]。HA在人自然骨中的形态是缺钙羟基磷灰石,其准确的表述式为(Ca,M)10(PO4,Y)6(OH,X)2,其中M为取代的阳离子,X为取代的阴离子。天然骨组织中存在的无机离子如Na+、Mg2+、K+、Sr2+、Zn2+、Ba2+、Cu2+等在骨生物学、机械性能等方面起着重要作用,无机离子替代能引起HA晶体大小、结晶度、溶解性和表面形貌等结构变化,并最终提高材料的生物学性能[2]。基于仿生的理念,离子掺杂成为近年来HA改性的研究热点,而锶(strontium,Sr)因其在人体骨组织中的浓缩存在,正备受关注。
有研究发现,Sr掺杂导致HA晶格改变,改善了结晶度、溶解度和材料的生物降解性[3],体外细胞实验结果也显示Sr能促进成骨细胞的增殖和成骨性胶原合成、抑制破骨细胞分化[4, 5];并且Sr掺杂可以促进体内骨形成,抑制骨吸收,改善骨的微细结构[6, 7, 8],使其更好地与自然骨匹配和融合。但是,对于任何一种元素在体内都存在最佳生物学浓度范围,超过这一范围就会存在潜在的毒性风险。低含量Sr可以促进骨形成、抑制骨的吸收,而高含量Sr会造成体内骨钙代谢异常[9, 10]。Braux等[1]就不同Sr离子浓度对成骨细胞分化进行研究,发现Sr离子浓度为5×10-5 mol/L的时候,成骨细胞标记物表达最高;当浓度上升至10-3 mol/L时则抑制成骨细胞的增殖。本研究对不同含量Sr掺杂的HA(Sr-HA)生物相容性及生物学活性进行比较分析,探讨Sr离子掺杂HA的安全剂量及最佳生物学效应。
1 材料和方法 1.1 主要试剂和仪器YJ-875超净工作台(苏州净化设备厂);CO2细胞培养箱(Forma Scientific,美国);DMEM培养液(Gibco,美国);新生牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶(Sigma,德国);碱性磷酸酶(ALP)检测试剂盒(碧云天生物技术有限公司);MTT、DMSO(上海化学试剂厂); ELX800酶联免疫检测仪(Bio-TEK,美国);X射线衍射仪(XRD-7000;岛津制作所;日本);相差显微镜(Olympus,日本);电感耦合等离子体发射光谱仪(Profile Spec,美国)。
1.2 Sr-HA试样制备及分组不同含量Sr掺杂的HA来源于上海中国科学院硅酸盐研究所课题组。根据Sr含量不同(0%、1%、5%、10%、20%)将Sr-HA分为5组。每组均有粉体及10 mm×10 mm×1 mm片状2种。
1.3 材料晶相结构测试应用X射线衍射仪分析Sr-HA试样表面晶相结构,衍射起始角、终止角分别为10°和60°,步宽为0.02°,波长为1.540 56 nm。
1.4 Sr-HA试样浸提液中Ca2+、Sr2+离子浓度测定浸提递质为DMEM培养液(含体积分数为10%的胎牛血清),按照Sr-HA试样粉末∶浸提递质为2 g∶10 mL的比例配制,37℃下在无菌、化学惰性的密封容器中浸提24 h。浸提液用过滤器除菌。采用电感耦合等离子体发射光谱仪测量5组Sr-HA试样浸提液中的Ca2+、Sr2+浓度。
1.5 Sr-HA试样溶血作用检测按国家标准《医疗器械生物学评价.第4部分:与血液相互作用试验选择》[11]规定的医疗器械及其成分的溶血性能评价方法执行。试样组预备:分别称取5组Sr-HA试样粉末各0.2 g,加入含生理盐水10 mL的离心管中;阳性对照:含10 mL蒸馏水的试管;阴性对照:含10 mL生理盐水的试管。各试管37℃保温30 min后,加入稀释为2%的兔血0.2 mL,轻摇,再次放入37℃水浴箱,保温60 min。室温下2 500 r/min离心5 min,取上清液在酶标仪上测定540 nm处的光密度(D)。按公式计算相应的溶血率:溶血率(%)=(D试样-D阴性对照)/(D阳性对照-D阴性对照)×100%。溶血评价标准:溶血率≤5%,符合医用材料溶血实验要求;溶血率>5%,提示材料具有溶血作用。
1.6 Sr-HA试样体外细胞毒性检测按1.4项方法制备浸提液,分别加入不同比例DMEM培养液稀释,得50%、20%、10% Sr-HA浸提液。采用MTT法检测细胞毒性。设定阴性对照为DMEM培养液,阳性对照为6.4 g/L苯酚溶液。将L929小鼠成纤维细胞(由上海中国科学院硅酸盐研究所提供)以1×107/L接种于24孔板,贴壁良好,24 h后弃原液,PBS清洗2次,按实验分组分别加入浸提液或培养液。将培养2、7 d的L929细胞用MTT比色法检测。实验观察期,弃培养板内浸提液或培养液,加入5 g/L的 MTT (20 μL/孔),继续培养6 h,弃原液加入DMSO (150 μL/孔),振荡培养板10 min,用酶标仪在500 nm波长处测定各孔D值,计算细胞相对增殖率。细胞相对增殖率(%)=(D试样/D阴性对照)×100%。根据细胞相对增殖率进行细胞毒性的结果评价:≥100%,毒性0级,合格;75%~99%,毒性1级,合格;50%~74%,毒性2级,结合细胞形态综合分析;25%~49%,毒性3级,不合格;1%~24%,毒性4级,不合格;0,毒性5级,不合格。细胞形态毒性分析:通过倒置相差显微镜观察5组试样不同浸提液浓度培养下的细胞形态。
1.7 Sr-HA试样对MG63细胞黏附的影响5组片状试样各6个放在24孔培养板内,将生长良好的第3代MG63成骨细胞(上海中国科学院硅酸盐研究所)以6×104/孔的密度接种,加DMEM培养液1 mL,于37℃、5% CO2、饱和湿度的条件下培养,分别于培养1、4、12 h后弃培养液,PBS漂洗2次,每孔加入5 g/L MTT 200 μL,37℃继续孵育4 h,弃上清,加入1 mL DMSO,结晶充分溶解后,取200 μL/孔移至96孔培养板,震荡10 min,用酶联免疫检测仪测定570 nm处的D值。每组重复3次实验,结果取平均值。
1.8 Sr-HA试样对MG63细胞增殖的影响以2×104/孔的密度将生长良好的第3代MG63成骨细胞接种于5组试样各6个的24孔培养板内,分别于1、4、7 d种植培养。培养条件和MTT检测方法同1.7项。
1.9 Sr-HA试样对MG63成骨细胞ALP活性的影响以2×104个/cm2密度将MG63成骨细胞接种于含有5组试样的24孔培养板中,分别于1、3、5 d终止培养,弃去培养液,PBS清洗3次,加入细胞裂解液0.25% Triton X-100,12 000 r/min离心15 min,取上清液收集后置于-80℃冷藏,待所有试样收集完毕后按照ALP试剂盒说明测定405 nm处的D值,用空白管调零。
1.10 统计学处理采用SPSS 16.0软件进行统计学分析,定量数据以 x±s表示,应用独立样本t检验分析组间差异。检验水准(α)为0.05。
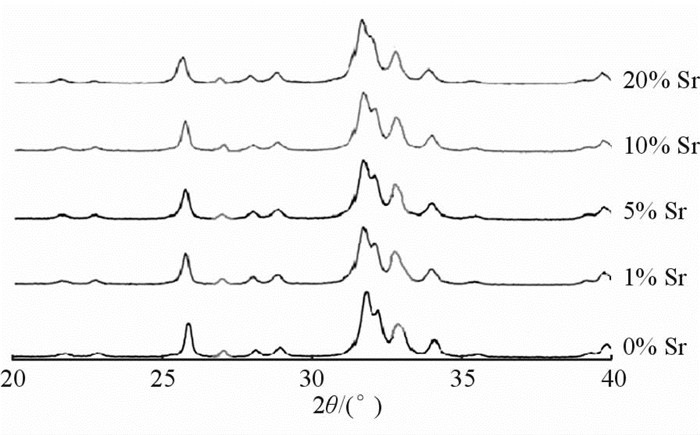
2 结 果 2.1 Sr-HA试样表面晶相结构及浸提液中Ca2+、Sr2+浓度如图 1,Sr掺杂HA X射线衍射图谱显示:r(Sr2+)>r(Ca2+),Sr2+ 取代Ca2+,使HA的晶格发生畸变,从而引起晶面间距扩大,结晶度改变。掺Sr后,X射线衍射峰位左移,Sr2+含量愈多,偏移量愈大。不同Sr含量的Sr-HA浸提液中Ca2+、Sr2+浓度研究结果发现,在5组试样中,Ca2+浓度以Sr掺杂量为5%组最高,Sr掺杂量为1%组最低;Sr2+浓度随着Sr掺杂量增加而增加,Sr掺杂量为20%组最高,Sr掺杂量为0%组最低(表 1)。
|
图 1 不同含量Sr掺杂Sr-HA试样表面晶相结构X射线衍射图谱 Fig 1 X-ray diffraction of Sr-HA surface crystal phase structure of the five Sr-HA groups Sr-HA: Strontium doped hydroxyapatite |
|
|
表 1 不同含量Sr掺杂Sr-HA试样浸提液中Ca2+、Sr2+浓度 Tab 1 Concentrations of Ca2+and Sr2+ in the leaching liquor of the five Sr-HA groups ρB/(μg·mL-1) |
不同Sr含量(0%、1%、5%、10%、20%)试样的溶血率分别为0.813%、0.922%、0.125%、0.147%、2.451%。试管中红细胞下沉,上层液变清无红色,吸取少量含红细胞的下层液在显微镜下观察,未发现红细胞破裂现象,表明材料在此浓度范围内符合医用材料的溶血实验要求。
2.3 Sr-HA试样体外细胞毒性实验结果由表 2可见,细胞培养2、7 d,各组细胞生长呈明显增长趋势,不同Sr含量(0%、1%、5%、10%、20%)试样总体毒性评级为0级、1级,说明不同Sr含量Sr-HA合格,体外培养对L929细胞无毒性,符合《医疗器械生物学评价》中关于实验材料细胞毒性的要求(国家标准GB/T16886.5-2003)。
|
|
表 2 不同含量Sr掺杂Sr-HA试样浸提液浓度作用L929成纤维细胞2 d和7 d相对增殖率和毒性分级 Tab 2 Relative growth rate(RGT)and toxicity grade of L929 fibroblasts cultured for 2 and 7 days in the five Sr-HA groups |
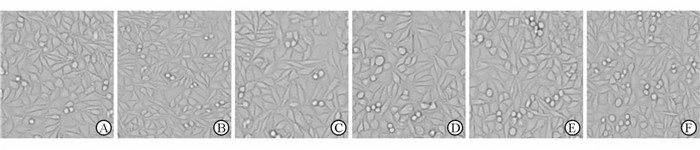
通过倒置相差显微镜观察,不同Sr含量(0%、1%、5%、10%、20%)试样浸提液(未稀释)培养的L929细胞与阴性对照组比较细胞形态无明显差异,细胞均贴壁生长,形态呈梭形或多角形,细胞突充分伸展,并见圆形的分裂状态细胞,胞质内有离散颗粒,细胞无溶解(图 2)。
|
图 2 不同含量Sr掺杂Sr-HA试样作用L929成纤维细胞7 d细胞形态观察 Fig 2 Morphology of L929 fibroblasts on day 7 of culture in the five Sr-HA groups and control groups A: Negative control; B: 0% Sr; C: 1% Sr; D: 5% Sr; E: 10% Sr; F: 20% Sr. Sr-HA: Strontium doped hydroxyapatite. Original magnification: ×200 |
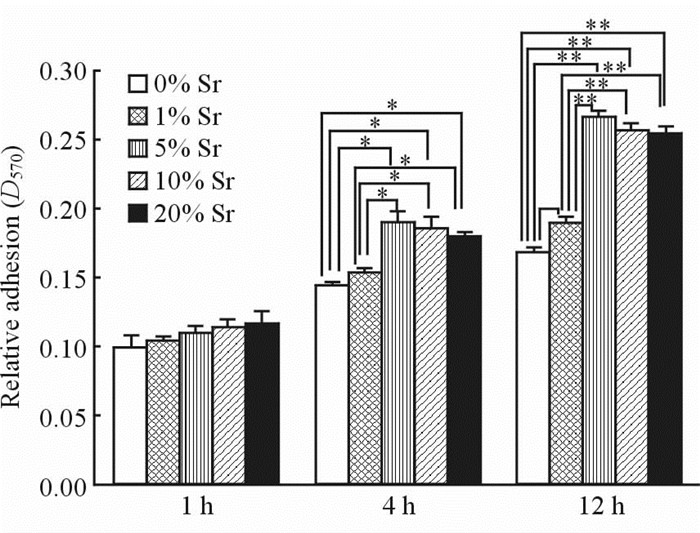
由图 3可见,细胞在不同Sr含量(0%、1%、5%、10%、20%)试样表面黏附量随培养时间延长而增加。培养1 h时,5组试样随着Sr含量的增加,MG63细胞黏附量增加,但差异无统计学意义(P>0.05);4 h时,5% Sr含量、10%Sr含量、20%Sr含量3组表面细胞黏附量明显上升,与0% Sr含量、1% Sr含量2组比较差异有统计学意义(P<0.05);12 h时,5% Sr含量、10% Sr含量、20% Sr含量3组与0% Sr含量、1% Sr含量2组表面细胞黏附量差异有统计学意义 (P<0.01),1% Sr含量组与0% Sr含量组差异亦有统计学意义(P<0.05)。说明与纯HA相比,随着Sr掺杂量的增加,促进了MG63细胞的黏附,但高于5%的Sr掺杂量促进作用无进一步增强,5% Sr掺杂量取得了更有效的作用。
|
图 3 MG63成骨细胞在不同含量Sr掺杂Sr-HA试样表面培养1、4、12 h的黏附情况 Fig 3 Adhesion of MG63 osteoblasts after 1, 4, and 12 h culture on the surface of Sr-HA material in the five Sr-HA groups Sr-HA: Strontium doped hydroxyapatite.* P<0.05,** P<0.01. n=6, x±s |
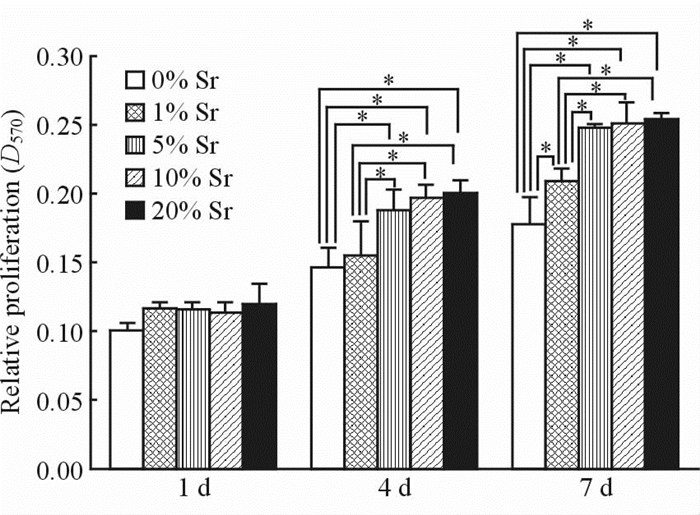
由图 4可见,不同Sr含量(0%、1%、5%、10%、20%)试样表面细胞增殖数量随培养时间增加而增加。第1天各组间细胞增殖数量随Sr含量呈递增趋势但差异无统计学意义(P>0.05);第4天5% Sr含量、10% Sr含量、20% Sr含量3组与0% Sr含量、1% Sr含量2组相比细胞增殖数量明显增加且差异有统计学意义(P<0.05);第7天5% Sr含量、10% Sr含量、20% Sr含量3组与0% Sr含量、1% Sr含量2组比较明显增加且差异有统计学意义(P<0.05),1% Sr含量组与0% Sr含量组比较差异亦有统计学意义(P<0.05)。说明Sr的掺杂能够促进MG63细胞的增殖,但Sr含量的增加与促进细胞增殖作用非线性关系,Sr掺杂量10%以上时促增强作用不再加强,5% Sr含量、10% Sr含量2组表现出良好的促进成骨细胞增殖作用。
|
图 4 MG63成骨细胞在不同含量Sr掺杂Sr-HA试样表面培养1、4、7 d增殖情况 Fig 4 Proliferation of MG63 osteoblasts after 1, 4, and 7 d of culture on the surface of Sr-HA material in the five Sr-HA groups Sr-HA: Strontium doped hydroxyapatite.*P<0.05. n=6, x±s |
由图 5可见,MG63成骨细胞在不同Sr含量(0%、1%、5%、10%、20%)试样表面ALP活性随培养时间的增加而增加。第1天ALP在各组试样表面表达差异无统计学意义(P>0.05);第3天,5% Sr含量、10% Sr含量2组试样表面ALP的活性明显高于0% Sr含量、1% Sr含量2组(P<0.05);第5天,5% Sr含量、10% Sr含量、20% Sr含量3组 ALP的表达明显高于0% Sr含量、1% Sr含量2组 (P<0.05),1% Sr含量组明显高于0% Sr含量组(P<0.05)。说明Sr掺杂HA能够促进成骨细胞ALP的活性,但当掺杂量到一定比例后再增加Sr量不能进一步提高其促进作用。
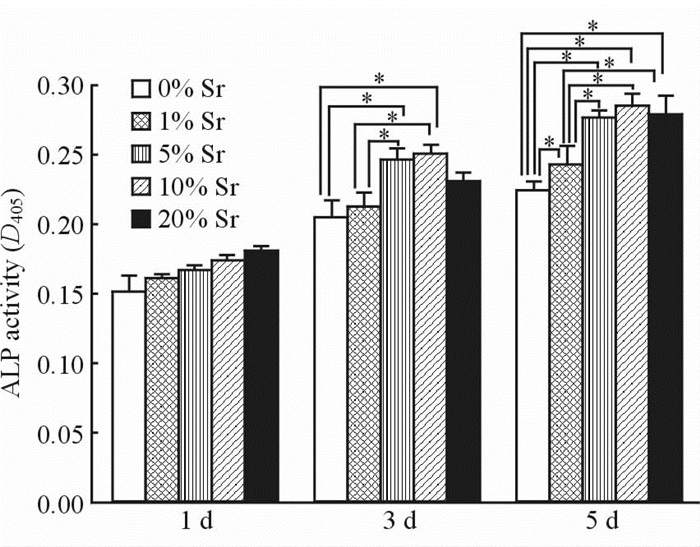
|
图 5 MG63成骨细胞在不同含量Sr掺杂Sr-HA试样表面培养1、3、5 d时ALP表达 Fig 5 ALP expression in MG63 osteoblasts after 1, 3, and 5 d of culture on the surface of Sr-HA material in the five Sr-HA groups Sr-HA: Strontium doped hydroxyapatite; ALP: Alkaline phosphatase.*P<0.05. n=6, x±s |
HA作为一种骨修复植入生物材料,良好的生物相容性是其得以应用的重要前提。我们采用溶血实验、体外细胞毒性实验等方法考察了不同Sr含量(0%、1%、5%、10%、20%)Sr-HA材料的生物相容性。溶血实验是常用的急性毒性实验中的初筛实验方法之一,通过检测材料对红细胞溶解的作用来评价材料的毒性[12]。本研究结果显示,各组Sr-HA的溶血率均小于5%,同时显微镜观察血细胞未见细胞破裂。提示制备的不同Sr含量的Sr-HA不引起溶血反应,符合相关溶血实验要求。体外细胞培养法具有简便、快速、灵敏、重复性好的优点,MTT法是常用的检测材料体外细胞毒性的方法[13]。我们选用L-929小鼠成纤维细胞对试样材料进行细胞毒性分析,结果发现制备的不同Sr含量的5组Sr-HA试样材料细胞毒性评级均为0或1级,各组材料表面细胞形态良好,未见明显毒性反应。实验结果与陈德敏等[14]关于Sr掺杂HA的细胞毒性研究结论相似,说明Sr掺杂HA材料具有较好的生物安全性。
成骨细胞属于锚合依赖性细胞,其在材料表面的黏附是材料骨界面锚合的第一步,是由一系列动态的蛋白质、生长因子介导的细胞活动[15]。当细胞黏附、铺展后,经过滞留期,开始增殖。既往实验结果表明,掺入Sr的Sr-HA能有效地促进成骨细胞的增殖[16, 17]。我们通过MTT法研究了不同Sr含量掺杂的HA对MG63细胞黏附、增殖的影响,结果发现,各组材料表面细胞黏附、增殖数量随培养时间增加而增加,Sr掺杂量为5%时促进细胞黏附作用最为显著。在细胞增殖实验中,培养第1天,各组材料表面细胞增殖数量并无明显差异,这可能与作用时间短有关,研究认为Sr2+促进成骨细胞显著增殖的作用时间始于48 h[18, 19];培养4、7 d时,Sr掺杂量为5%和10% 2组表现出良好的促进成骨细胞增殖的作用。Sr2+通过钙离子感受器作用,启动相关联的信号受体,促进生长因子的释放、细胞的黏附及增殖[20, 21]。Sr掺杂量较高(20%)时对促进细胞黏附、增殖作用并无明显优势,表明Sr的掺入量与材料的离解度并非成简单的正比关系,不是随Sr2+代替Ca2+比例增加Sr-HA的生物降解度也直线增加[22],当Sr掺杂量在10%以上时,虽然Sr2+浓度较高,但其对成骨细胞的黏附、增殖作用不会显著增强。Choudhary等[23]研究动物体内骨种植的实验结果也证实了这一现象。
ALP是成骨细胞分化、矿化过程中必需的酶之一,分析检测ALP活性是评价成骨细胞分化的重要指标。有研究证实Sr2+具有促进成骨细胞分化作用[24, 25],能增加ALP的表达。本研究结果发现,Sr掺杂量的增加可以促进ALP的表达,但Sr掺杂量在5%、10%和20%时,3组间差异无统计学意义。同时Sr2+促进ALP的表达具有一定的延迟性,在培养第3天后出现了明显促进作用。Chung等[18]研究认为,Sr2+、Ca2+都是Ca受体激活剂,但亲和力有一定差异,Ca2+强而Sr2+弱,它们在介导的钙敏受体传导通道中的活性作用存在差异。我们认为,Sr-HA作用早期,降解的Ca2+浓度明显高于Sr2+,在高Ca/Sr摩尔比下,Sr2+并不能竞争Ca2+,Sr2+生物活性较Ca2+弱[26]。此时,Ca2+因高浓度、高活性成为促进ALP表达的主要因素。随着作用时间延长,Sr2+浓度进一步增加,其对ALP表达的作用逐渐增强,在Sr2+及Ca2+双重作用下共同促进了ALP的表达。因此,Sr2+促进ALP显著增强表达具有延迟性,始于48 h后[19]。我们推测,Sr2+作用于成骨细胞分化存在可能的负反馈调节,即Sr2+存在最佳体液-细胞平衡浓度范围,此时,细胞膜表面与Sr2+相关作用受体饱和,当高于这一浓度范围时,Sr2+促进成骨细胞分化作用无进一步增强或可能减弱,但还需要进一步在细胞水平和分子水平上阐明其促进成骨细胞ALP表达的作用机制。
综上,本研究发现,不同Sr掺杂量的Sr-HA具有良好的生物相容性,Sr掺杂能够促进成骨细胞的黏附、增殖和分化。在提高HA生物学活性方面,Sr掺杂量存在一个适合范围,掺杂量为5%和10%时Sr-HA具有良好的生物学性能。
| [1] | Braux J, Velard F, Guillaume C, Bouthors S, Jallot E, Nedelec J M, et al. A new insight into the dissociating effect of strontium on bone resorption and formation[J]. Acta Bbmater,2011,7:2593-2603. |
| [2] | Shi D L. Introduction to biomaterials[M]. Beijing: Tsinghua University Press, 2006:16-28. |
| [3] | Christoffersen J, Christoffersen M R, Kolthoff N, Bärenholdt O. Effects of strontium ions on growth and dissolution of hydroxyapatite and on bone mineral detection[J]. Bone,1997,20:47-54. |
| [4] | Zhou J, Han Y, Lu S. Direct role of interrod spacing in mediating cell adhesion on Sr-HA nanorod-patterned coatings[J]. Int J Nanomedicine,2014,9:1243-1260. |
| [5] | Boanini E, Torricelli P, Fini M, Bigi A. Osteopenic bone cell response to strontium-substituted hydroxyapatite[J]. J Mater Sci Mater Med,2011,22:2079-2088. |
| [6] | Li Y, Li Q, Zhu S, Luo E, Li J, Feng G, et al. The effect of strontium-substituted hydroxyapatite coating on implant fixation in ovariectomized rats[J]. Biomaterials,2010,31:9006-9014. |
| [7] | 闫 钧,张玉梅,憨 勇,赵彦涛,孙继锋,闫 昊.锶磷灰石涂层钛种植体骨结合的动物实验[J].中华口腔医学杂志,2010,45:89-93. |
| [8] | Yang G L, Song L N, Jiang Q H, Wang X X, Zhao S F, He F M. Effect of strontium-substituted nanohydroxyapatite coating of porous implant surfaces on implant osseointegration in a rabbit model[J].Int J Oral Maxillofac Implants, 2012, 27:1332-1339. |
| [9] | Zhang W, Shen Y, Pan H, Lin K, Liu X, Darvell B W, et al. Effects of strontium in modified biomaterials[J]. Acta Biomater,2011,7:800-808. |
| [10] | Naveau B. Strontium: a new treatment for osteoporosis[J]. Joint Bone Spine,2004,71:261-263. |
| [11] | 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 医疗器械生物学评价.第4部分:与血液相互作用试验选择: GB/T 16886.4-2003[S].北京:中国标准出版社,2003. |
| [12] | Piattelli A, Cosci F, Scarano A, Trisi P. Localized chronic suppurative bone infection as a sequel of peri-implantitis in a hydroxyapatite-coated dental implant[J]. Biomaterials,1995,16:917-920. |
| [13] | Li Q, Ionut I, Jeff L, Wei L, Michael S, Jules K. Numerical simulation of crack formation in all ceramic dental bridge[J]. Key Eng Mater,2006,312:293-298. |
| [14] | 陈德敏,傅远飞.不同含锶量的掺锶羟磷灰石陶瓷细胞毒性评价[J].现代口腔医学杂志,2003,17:501-503. |
| [15] | Anselme K. Osteoblast adhesion on biomaterials[J].Biomaterials,2000,21:667-681. |
| [16] | Ni G X,Yao Z P,Huang G T,Liu W G, Lu W W. The effect of strontium incorporation in hydroxyapatite on osteoblasts in vitro[J].J Mater Sci Mater Med,2011,22:961-967. |
| [17] | Ni G X, Shu B, Huang G, Lu W W, Pan H B. The effect of strontium incorporation into hydroxyapatites on their physical and biological properties[J].J Biomed Mater Res B Appl Biomater,2012,100:562-568. |
| [18] | Chung C J, Long H Y.Systematic strontium substitution in hydroxyapatite coatings on titanium via micro-arc treatment and their osteoblast/osteoclast responses[J].Acta Biomater,2011,7:4081-4087. |
| [19] | Capuccini C, Torricelli P, Sima F, Boanini E, Ristoscu C, Bracci B, et al.Strontium-substituted hydroxyapatite coatings synthesized by pulsed-laser deposition: in vitro osteoblast and osteoclast response[J]. Acta Biomater,2008,4:1885-1893. |
| [20] | Saidak Z, Marie P J. Strontium signaling: molecular mechanisms and therapeutic implications in osteoporosis[J]. Pharmacol Ther,2012,136:216-226. |
| [21] | Caverzasio J. Strontium ranelate promotes osteoblastic cell replication through at least two different mechanisms[J].Bone,2008,42:1131-1136. |
| [22] | Wu C, Ramaswamy Y, Kwik D, Zreiqat H. The effect of trontium incorporation into CaSiO3 ceramics on their physical and biological properties[J].Biomaterials,2007,28:3171-3181. |
| [23] | Choudhary S, Halbout P, Alander C, Raisz L, Pilbeam C. Strontium ranelate promotes osteoblastic differentiation and mineralization of murine bone marrow stromal cells: involvement of prostaglandins[J].J Bone Miner Res,2007,22:1002-1010. |
| [24] | Querido W, Rossi A L, Farina M. The effects of strontium on bone mineral: a review on current knowledge and microanalytical approaches[J]. Micron,2016,80:122-134. |
| [25] | Yang L, Perez-Amodio S, Barrère-de Groot F Y, Everts V, van Blitterswijk C A, Habibovic P. The effects of inorganic additives to calcium phosphate on in vitro behavior of osteoblasts and osteoclasts[J]. Biomaterials, 2010,31:2976-2989. |
| [26] | Boanini E, Torricelli P, Gazzano M, Della Bella E, Fini M, Bigi A. Combined effect of strontium and zoledronate on hydroxyapatite structure and bone cell responses[J].Biomaterials,2014,35:5619-5626. |
 2016, Vol. 37
2016, Vol. 37


