糖是最基本的生命物质之一,在生命过程中发挥提供能量以及组成细胞结构的作用。除了以游离形式存在以外,寡糖常与蛋白质和脂类以共价键结合形成糖缀合物,广泛分布于生物的细胞壁和细胞膜,参与诸如细胞识别、信号传递、细胞的增殖和分化、肿瘤细胞的转移、病毒和细菌感染等生物过程。进一步研究表明,糖缀合物中的寡糖残基往往起决定作用[1],如红细胞表面的不同糖缀合物的糖链决定了不同的血型并主导了凝血过程、甲状腺素的糖链决定了其生物学特性等。因此,结构确定的寡糖及其缀合物的分离以及人工合成,对于生物化学等方面的研究及糖类药物的研发具有重大意义,也是当前研究的热点。
炭疽杆菌是炭疽病的病原体,属于革兰阳性菌。其孢子具有高杀伤力且容易生产、储存和传播,故该病原体已被视为一种潜在的生物武器[2]。炭疽杆菌表面包含多个高度保守的特异性寡糖抗原结构,可以作为潜在的糖缀合物疫苗候选结构。已有多篇研究报道存在于炭疽孢子上的特异性四糖及其类似物的不同合成方案[3, 4, 5],大部分方案以价格昂贵的岩藻糖为原料,合成成本高[4];而基于非糖原料的四糖合成路线非常烦琐[5]。Choudhury等[6]研究发现,炭疽荚膜上存在另一个新的寡糖重复片段,该片段被证明具有潜在的抗原性。基于此,我们合成了上述寡糖片段的关键中间体,即2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-(2,3,4,6-四-O-乙酰基-β-D-半乳吡喃糖基)(β1→3)-2-脱氧-2-乙酰氨基-β-D-葡萄糖对甲氧基苯酚苷。本研究以半乳糖和氨基葡萄糖盐酸盐为原料,采用线性合成的策略依次进行硫苷和Schmidt苷糖基化,合成路线简洁,反应产率高,立体选择性好。反应目标化合物在还原性末端上的对甲氧基苯基可在其他保护基不受影响的情况下选择性离去,进而偶联氨基酸、蛋白质、脂质等生物大分子,可用于具有相应生物活性的糖缀合物的合成。
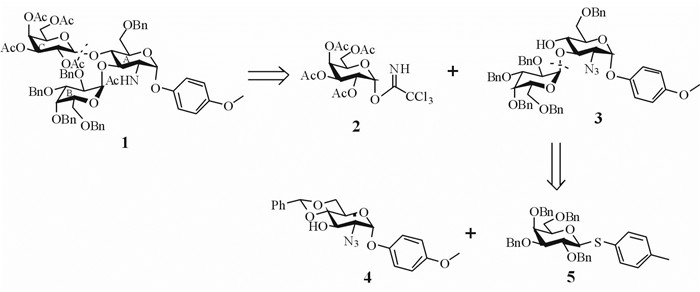
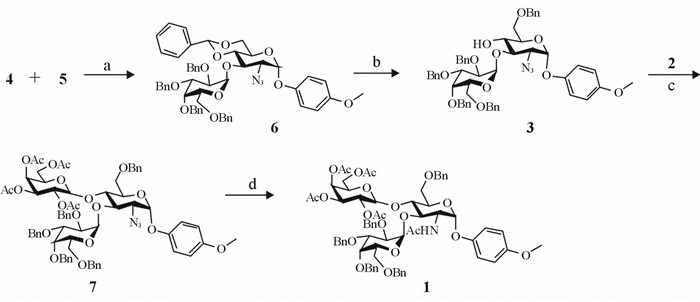
1 材料和方法 1.1 合成路线基于Choudhury等[6]发现的炭疽荚膜寡糖重复片段(图 1),合成该寡糖片段的关键中间体2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-(2,3,4,6-四-O-乙酰基-β-D-半乳吡喃糖基)(β1→3)-2-脱氧-2-乙酰氨基-β-D-葡萄糖对甲氧基苯酚苷(1)(图 2)。如图 3合成路线所示,葡萄糖盐酸盐先转化为2位是2,2,2-三氯乙氧基甲酰氨基的乙酰葡萄糖8[7]后,与对甲氧基苯酚成糖苷9[8]。单糖化合物9去乙酰化且2位转变为叠氮保护[7],得到单糖化合物11。单糖化合物11采用4,6-O-苯亚甲基缩醛保护[9]即得单糖受体4。将市售半乳糖乙酰化成单糖化合物12后,选择性脱去端位乙酰基得到1-羟基未取代化合物13。单糖中间体13与三氯乙腈在碱性条件下制得单糖供体2[10]。半乳糖供体5[11]是由单糖化合物12与对甲苯硫酚成硫苷且脱去2,3,4,6-O-乙酰基后全苄基化所得。单糖受体4与半乳糖供体5 在低温条件下由N-碘代丁二酰亚胺和三氟甲磺酸银[12]共同催化,进行糖基化反应生成二糖化合物6。二糖受体3为二糖化合物6选择性开苄叉[8]得到的4-羟基未取代的产物。在三氟甲磺酸三甲基硅酯催化下[10],半乳糖供体2与二糖受体3结合生成三糖化合物7。三糖化合物7在硫代乙酸作用下2位叠氮转化为乙酰氨基[13]即为目标化合物1(图 4)。

|
图 1 炭疽荚膜寡糖重复片段的结构 Fig 1 Structure of the repeating unit from Bacillus anthracis vegetative cell walls |
|
图 2 目标化合物1及其逆合成分析 Fig 2 The chemical structure of target compound 1 and retrosynthetic analysis |

|
图 3 单糖化合物的合成路线 Fig 3 Synthesis route of monosaccharide building blocks a: Troc-Cl (2,2,2-trichloroethyl chloroformate), H2O, NaHCO3, then pyridine acetic anhydride, rt (room temperature), overnight; b: p-Methoxyphenol, BF3·Et2O, DCM (dichloromethane), rt, overnight; c: Zn dust, CH3COOH/DCM/CH3OH, rt, 1 h; d: CH3ONa, CH3OH/DCM, rt, 2 h, and K2CO3/ZnCl2, TfN3 (trifluoromethanesulfonic-N3), DCM/CH3OH/H2O, rt, overnight; e: PhCH(OCH3)2, CSA (camphorsulfonic acid), CH3CN, rt, 2 h; f: Acetic anhydride, sodium acetate, reflux, 4 h; g: Hydrazine acetate, DMF (N,N-dimethyl formamide); h: Trichloroacetonitrile, DBU (1,8-diazabicyclo[5.4.0]undec-7-ene), DCM; i: p-Thiocresol, DCM, BF3 . Et2O, 2 h; j: CH3ONa, CH3OH, then BnBr, NaH, DMF |
|
图 4 目标化合物1的合成路线 Fig 4 Synthesis route of the target compound 1 a: -40℃, 4Å-MS (molecular sieve), DCM, NIS (N-iodosuccinimide), AgOTf (silver trifluoromethanesulfonate); b: 0℃, 4Å-MS, NaBH3CN, 2 mol/L HCl/Et2O, THF (tetrahydrofuran); c: 0℃, TMSOTf (trimethylsilyl trifluoromethanesulfonate), 4Å-MS, DCM; d: Pyridine, thioacetic acid |
Agilent 6538 UHD Accurate Mass Q-TOF LC/MS型质谱仪;Varian Inova-300,600型核磁共振仪(TMS为内标,溶剂:CDCl3);恒温磁力搅拌器(上海志威电器有限公司); 旋转蒸发仪(LOOYEZX98-1),水浴锅(LOOYEZX98-12),ZX-4型旋片真空泵低温冷却循环泵、循环水式多用真空泵SHB-Ⅲ A(上海欲康科教仪器设备有限公司);ZF7B三用紫外分析仪(上海康化生化仪器制造厂)。实验中所用的试剂和溶剂均为市售分析纯或化学纯。
1.3 化合物的合成 1.3.1 2-脱氧-2-(2,2,2-三氯乙氧基甲酰氨基)-1,3,4,6-四-O-乙酰基-β-D-葡萄糖(8)将市售氨基葡萄糖盐酸盐(40.0 g,186 mmol)和碳酸氢钠(46.8 g,558 mmol)溶于360 mL蒸馏水。并在室温下搅拌反应30 min后,缓慢加入氯甲酸-2,2,2-三氯乙酯(Troc-Cl,30.0 mL,233 mmol),继续搅拌反应4 h。过滤除去溶剂,干燥得浅黄色滤渣(54.0 g,150 mmol)。重新溶于200 mL吡啶,冰浴条件下缓慢滴加醋酐(88.0 mL,900 mmol)。反应液室温条件下搅拌过夜。待薄层色谱(TLC)检测反应完全,加入100 mL甲醇淬灭反应。挥干溶剂,加入500 mL乙酸乙酯萃取,然后依次使用饱和碳酸氢钠溶液、1 mol/L盐酸溶液和饱和氯化钠溶液洗涤。有机层用无水硫酸钠干燥后,真空固化,得白色固体产物8(69.9 g,产率72%两步)。
1.3.2 2-脱氧-2-(2,2,2-三氯乙氧基甲酰氨基)-3,4,6-三-O-乙酰基-β-D-葡萄糖对甲氧基苯酚苷(9)将化合物8(22.0 g,42.1 mmol)和对甲氧基苯酚(6.00 g,48.4 mmol)溶于200 mL二氯甲烷。冰浴条件下缓慢滴加三氟化硼乙醚(15.9 mL,126 mmol),混合液恢复室温搅拌反应过夜。待反应完全,加入200 mL二氯甲烷后,依次使用饱和碳酸氢钠溶液和饱和食盐水洗涤,二氯甲烷层用无水硫酸钠干燥。过滤、浓缩滤液,经硅胶柱层析纯化,得白色产物9(22.5 g,产率91.3%)。
1.3.3 2-脱氧-2-氨基-3,4,6-三-O-乙酰基-β-D-葡萄糖对甲氧基苯酚苷(10)将化合物9(12.0 g,20.5 mmol)溶于45.0 mL甲醇、24.0 mL醋酸和24.0 mL二氯甲烷混合液中。冰浴条件下缓慢加入锌粉(24.1 g,369 mmol),反应液恢复室温在氮气保护下继续搅拌反应1 h。过滤除去不溶物,收集滤液浓缩真空干燥得粗产物。将粗产物溶于300 mL二氯甲烷,用饱和碳酸氢钠洗涤至溶液pH为7,有机层用无水硫酸钠干燥。过滤、浓缩滤液,快速硅胶柱层析纯化,得白色产物10(7.23 g ,产率89%)。
1.3.4 2-脱氧-2-叠氮-β-D-葡萄糖对甲氧基苯酚苷(11)将化合物10(7.20 g,17.5 mmol)溶于35.0 mL甲醇和35.0 mL二氯甲烷混合液后,加入甲醇钠(94.5 mg,1.75 mmol),反应液于室温条件下搅拌反应2 h。滴加1 mol/L 盐酸溶液使混合液pH为7,真空固化得中间产物。将中间产物、碳酸钾(4.80 g,35 mmol)及催化量氯化锌(120 mg,0.900 mmol)溶于40.0 mL甲醇和10.0 mL水的混合液后,加入新制TfN3溶液(50.0 mL,52.5 mmol)室温搅拌反应过夜。反应结束后蒸干溶剂,加入200 mL乙酸乙酯萃取,滴加1 mol/L 盐酸溶液使混合液pH为6~7,有机层用无水硫酸钠干燥。过滤、浓缩滤液,快速硅胶柱层析纯化,得白色产物11(3.96 g,产率73%两步)。
TfN3溶液制法:取叠氮钠(3.40 g,52.5 mmol)溶于50.0 mL水和50.0 mL二氯甲烷混合液后,缓慢滴加三氟甲烷磺酸酐(8.90 mL,52.5 mmol)搅拌反应2 h。用饱和碳酸氢钠溶液洗涤3遍,分取二氯甲烷层留用。
1.3.5 4,6-O-苄叉基-2-脱氧-2-叠氮-β-D-葡萄糖对甲氧基苯酚苷(4)将化合物11(2.50 g,8.05 mmol)、苯甲醛二甲基缩醛(1.45 mL,9.65 mmol)和樟脑磺酸(CSA,0.567 g,2.42 mmol)溶于50.0 mL无水乙腈,混合液于室温下搅拌反应2 h。待TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.7)监测反应完全,加入100 mL乙酸乙酯。混合液依次使用饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤,有机层用无水硫酸钠干燥。过滤、浓缩滤液,快速硅胶柱层析纯化,得白色产物4(2.56 g,产率79%)。1HNMR (600 MHz,CDCl3):7.55~7.52 (m,2H,Ar),7.43~7.42 (m,3H,Ar),7.08 (d,J=7.8 Hz,2H,Ar),6.90 (d,J=7.7 Hz,2H,Ar),5.61 [s,1H,PhCH(O)2],4.92 (d,J=7.8 Hz,1H,H-1),4.43~4.41 (m,1H,H-4),3.87 (t,J=10.3 Hz,1H,H-3),3.83 (s,3H,CH3),3.79~3.76 (m,1H,OH),3.72~3.70 (m,1H,H-5),3.69~3.66 (m,1H,H-2)。 13CNMR (151 MHz,CDCl3):155.95,150.83,136.72,134.49,129.77,129.46,129.02,128.43,126.28,118.68,118.18,114.73,102.09,80.43,72.03,68.51,66.37,55.69。
1.3.6 β-D-半乳糖五乙酸酯(12)将市售D-半乳糖(20.0 g,111 mmol)、乙酸钠(5.00 g,367 mmol)溶于醋酐(200 mL)。加热回流4 h后,TLC(石油醚∶乙酸乙酯=1∶1,Rf=0.6)监测至反应完全。加冰水,乙酸乙酯萃取,依次用饱和碳酸氢钠溶液和饱和食盐水洗涤3遍。有机层用无水硫酸钠干燥,浓缩。粗产物用甲醇重结晶,得白色固体产物12(36.8 g,产率85%)。
1.3.7 2,3,4,6-四-O-乙酰基-β-D-半乳糖(13)取化合物12(5.00 g,12.8 mmol)、醋酸肼(1.47 g,16.0 mmol)和N,N-二甲基甲酰胺(50.0 mL)置于250 mL茄形瓶中,室温下搅拌反应1 h。待TLC(石油醚∶乙酸乙酯=1∶1,Rf=0.4)监测反应完全,加入乙酸乙酯(340 mL)稀释后,依次使用冰水(120 mL)、冰盐水(120 mL)、饱和碳酸氢钠溶液(120 mL)和冰水(120 mL)洗涤,乙酸乙酯层用无水硫酸钠干燥,浓缩,真空固化得白色固体产物13(3.82 g,产率86%)。
1.3.8 2,3,4,6-四-O-乙酰基-β-D-半乳糖三氯亚胺乙酸酯(2)取化合物13(2.37 g,6.81 mmol)、三氯乙腈(14.2 mL,136 mmol)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU,0.052 0 mL,3.40 mmol)和二氯甲烷(30.0 mL),置于100 mL茄形瓶中。氩气保护下室温搅拌反应1 h。待TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.5)监测反应完全,浓缩除去溶剂,快速硅胶柱层析(石油醚∶乙酸乙酯∶三乙胺=3∶1∶0.05),得黄色粗产物,乙醚-正己烷重结晶纯化得白色晶体产物2(2.41 g,产率72%)。1HNMR (300 MHz,CDCl3):8.67 (s,1H),6.59 (s,1H),5.56 (d,J=1.9 Hz,1H),5.44~5.33 (m,2H),4.43 (t,J=6.6 Hz,1H),4.19~4.05 (m,2H),2.17 (s,3H,Ac),2.03~2.00 (m,9H,Ac)。
1.3.9 对甲基苯基-1-硫代-2,3,4,6-四-O-乙酰基-β-D-半乳糖苷(14)取化合物12(20.0 g,51.2 mmol)和对甲苯硫酚(9.54 g,76.8 mmol)溶于二氯甲烷(150 mL),冰浴条件下缓慢滴加三氟化硼乙醚溶液(6.46 mL,512 mmol)搅拌反应2 h。待TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.6)监测反应完全,依次使用饱和碳酸氢钠溶液、饱和氯化钠溶液洗涤,有机层用无水硫酸钠干燥。蒸干溶剂得粗产物,用乙醚清洗抽滤后得纯净白色固体产物14(22.1 g,产率95%)。
1.3.10 对甲基苯基-1-硫代-2,3,4,6-四-O-苄基-β-D-半乳糖苷(5)取化合物14(10.0 g,22.0 mmol)和甲醇钠(108 mg,2.00 mmol)溶于甲醇(100 mL)中,室温下搅拌反应2 h。TLC检测至反应完全。加酸性树脂调节溶液pH至6~7,过滤除去树脂,滤渣用甲醇洗涤,合并滤液,真空浓缩,所得干燥中间产物溶于N,N-二甲基甲酰胺(100 mL),加入溴化苄(13.7 mL,110 mmol)和四丁基碘化铵(74 mg,0.200 mmol),冰浴条件下缓慢加入氢化钠(4.40 g,183 mmol)搅拌反应过夜。待TLC(石油醚∶乙酸乙酯=2∶1,Rf=30.5)监测反应完全,减压蒸馏除去N,N-二甲基甲酰胺,用氯化铵淬灭反应。加乙酸乙酯(200 mL)萃取,然后依次用饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤。有机层用无水硫酸钠干燥,浓缩。硅胶柱层析(石油醚∶乙酸乙酯=5∶1),得白色固体5(11.8 g,产率83%)。1HNMR (600 MHz,CDCl3): 7.46 (d,J=8.1 Hz,2H),7.38 (d,J=7.2 Hz,3H),7.35~7.24 (m,18H),7.00~6.97 (m,2H),4.95 (d,J=11.5 Hz,1H),4.80 (d,J=10.3 Hz,1H),4.78~4.68 (m,3H),5.65~4.55 (m,2H),4.51~4.37 (m,2H),3.96 (d,J=2.5 Hz,1H),3.91 (t,J=9.4 Hz,1H),3.65 (d,J=6.4 Hz,2H),3.61~3.54 (m,2H),2.27 (s,3H)。13CNMR (125 MHz,CDCl3): 135.06,134.69,134.54,134.19,133.34,128.38,126.51,125.73,124.59,124.49,124.35,124.08,124.02,123.94,123.84,123.76, 123.60,84.29,80.50,73.63,73.53,71.77,70.65,69.96,69.77,68.97,65.06。
1.3.11 2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-4,6-O-苄叉基-2-脱氧-2-叠氮-β-D-葡萄糖对甲氧基苯酚苷(6)取化合物5(3.29 g,5.11 mmol)和4(1.36 g,3.41 mmol)溶于无水二氯甲烷(40.0 mL)后加入分子筛(8.00 g),在氩气保护下室温搅拌1 h。降温至-30℃,迅速加入N-碘代丁二酰亚胺(1.15 g,5.11 mmol)和三氟甲磺酸银(87.3 mg,0.339 mmol)继续搅拌1 h。TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.6)监测至反应完全。加三乙胺淬灭反应后,过滤除去分子筛,滤渣用二氯甲烷洗涤,合并滤液。依次用饱和硫代硫酸钠溶液、饱和碳酸氢钠溶液和饱和氯化钠溶液洗两遍。有机层用无水硫酸钠干燥后浓缩,硅胶柱层析(石油醚∶乙酸乙酯=6∶1)得白色固体6(2.49 g,产率79%)。1HNMR (600 MHz,CDCl3):7.44~7.40 (m,4H,Ar),7.34~7.28 (m,19H,Ar),7.20 (d,J=8.1 Hz,2H,Ar),7.05 (s,2H,Ar),6.86 (d,J=9.1 Hz,2H,Ar),5.52 [s,1H,PhCH(O)2],5.03 (d,J=10.7 Hz,1H),4.94 (d,J=6.0 Hz,1H),4.87~4.83 (m,2H),4.73 (d,J=7.8 Hz,1H),4.70 (d,J=2.7 Hz,2H),4.63~4.60 (m,1H),4.54~4.46 (m,1H),4.34~4.32 (m,1H),4.29~4.23 (m,2H),3.90~3.86 (m,4H),3.79 (s,3H,CH3),3.69~3.56 (m,1H),3.51~3.49 (m,1H),3.47~3.44 (m,1H),3.42~3.39 (m,1H),3.37~3.31 (m,1H)。HR-Q-TOF-MS: 计算值C54H55N3O11 [M+NH4+] m/z 939.383 7,测得值为939.417 5。
1.3.12 2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-6-O-苄基-2-脱氧-2-叠氮-β-D-葡萄糖对甲氧基苯酚苷(3)取化合物6(2.30 g,2.50 mmol)和氰基硼氢化钠(1.57 g,25.0 mmol)溶于无水四氢呋喃(20.0 mL)后加入分子筛(4.00 g),氩气保护下室温搅拌1 h。冰浴条件下缓慢滴加2 mol/L HCl/Et2O(12.0 mL),继续搅拌反应30 min。TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.5)监测反应完全。加三乙胺淬灭反应后,过滤除去分子筛,滤渣用二氯甲烷洗涤,合并滤液。依次用饱和碳酸氢钠溶液和饱和氯化钠溶液洗2遍。有机层用无水硫酸钠干燥后浓缩,硅胶柱层析(石油醚∶乙酸乙酯=3∶1)得白色固体3(2.04 g,产率88%)。1HNMR (600 MHz,CDCl3):7.43 (d,J=6.9 Hz,2H,Ar),7.36~7.27 (m,23H,Ar),7.08 (d,J=9.1 Hz,2H,Ar),6.80 (d,J=9.1 Hz,2H,Ar),5.07 (d,J=5.5 Hz,1H,HA-1),4.95 (d,J=6.0 Hz,1H,HB-1),4.85~4.77 (m,3H),4.71 (d,J=11.8 Hz,1H),4.61~4.57 (m,3H),4.50 (d,J=7.8 Hz,1H),4.44 (d,J=11.7 Hz,1H),4.38 (d,J=11.7 Hz,1H),3.93~3.89 (m,2H),3.77 (s,3H,CH3),3.72~3.67 (m,2H),3.64~3.59 (m,3H),3.57~3.54 (m,2H),3.39~3.32 (m,2H)。13CNMR (151 MHz,CDCl3):155.68,151.33,138.58,138.38,138.31,37.56,128.56,128.48,128.45,128.22,128.11,128.06,127.95,127.86,127.79,127.71, 127.62,118.50,114.73,104.66,102.00,85.77,82.26,79.28,75.88,75.52,74.71,74.00,73.83,73.67,73.61,73.50,69.73,69.22,69.16,64.73, 55.78。HR-Q-TOF-MS:计算值C54H57N3O11 [M+NH4+] m/z 941.399 3,测得值为941.435 3。
1.3.13 2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-(2,3,4,6-四-O-乙酰基-β-D-半乳吡喃糖基)(β1→3)-2-脱氧-2-叠氮-β-D-葡萄糖对甲氧基苯酚苷(7)取化合物3(100 mg,0.108 mmol)和2(79.5 mg,0.162 mmol)溶于无水二氯甲烷(10.0 mL)后加入分子筛(100 mg),在氩气保护下室温搅拌1 h。降温至0℃,迅速加入催化量三氟甲磺酸三甲基硅酯(1.80 μL,0.01 mmol)继续搅拌反应30 min。TLC(石油醚∶乙酸乙酯=2∶1,Rf=0.6)监测至反应完全。加三乙胺淬灭反应后,过滤除去分子筛,滤渣用二氯甲烷洗涤,合并滤液。依次用饱和碳酸氢钠溶液和饱和氯化钠溶液洗2遍。有机层用无水硫酸钠干燥后浓缩,硅胶柱层析(石油醚∶乙酸乙酯=3∶1)得白色固体7(105 mg,产率78%)。1HNMR (600 MHz,CDCl3):7.41 (d,J=7.1 Hz,2H,Ar),7.38~7.27 (m,21H,Ar),7.02 (d,J=9.1 Hz,2H,Ar),6.79 (d,J=9.1 Hz,2H,Ar),5.10 (d,J=4.2 Hz,1H,HC-1),5.07~5.05 (m,1H),5.05 (d,J=3.6 Hz,1H,HA-1),5.02 (d,J=3.0 Hz,1H,HB-1),4.97~4.95 (m,1H),4.92 (d,J=3.2 Hz,1H),4.90 (d,J=3.3 Hz,1H),4.85 (d,J=11.3 Hz,1H),4.81~4.74 (m,2H),4.66 (d,J=8.1 Hz,1H),4.62 (d,J=12.2 Hz,1H),4.59~4.50 (m,4H),3.94~3.81 (m,7H),3.77 (s,3H,CH3),3.75~3.71 (m,2H),3.69~3.63 (m,2H),3.63~3.58 (m,3H),3.54 (t,J=6.5 Hz,1H),2.02 (s,3H,Ac),2.00 (s,3H,Ac),1.88 (s,3H,Ac),1.78 (s,3H,Ac)。13CNMR (151 MHz,CDCl3):170.44,170.29,170.16,170.06,155.70,151.34,138.94,138.75,138.61,138.45,138.17,128.57,128.52,128.48,128.36,128.29, 128.11,128.06,127.97,127.71,127.68,118.44,114.70,102.25,101.72,97.00,82.44,79.68,75.35,75.32,74.98,74.68,74.56, 73.85,73.67,73.49,73.37,73.31,70.93,70.43,69.57,69.36,69.00,67.35,66.75,61.86,55.78,29.83,20.71。HR-Q-TOF-MS: 计算值C68H75N3O20 [M+Na+] m/z 1 276.494 4,测得值为1 276.486 1。
1.3.14 2,3,4,6-四-O-苄基-β-D-半乳糖基(α1→4)-(2,3,4,6-四-O-乙酰基-β-D-半乳吡喃糖基)(β1→3)-2-脱氧-2-乙酰氨基-β-D-葡萄糖对甲氧基苯酚苷(1)将化合物7(75.0 mg,0.059 8 mmol)溶于8.00 mL硫代乙酸和2.00 mL吡啶,室温下搅拌反应24 h。待反应完毕,蒸干溶剂,快速硅胶柱层析(石油醚∶乙酸乙酯=2∶1)得白色固体1(64.5 mg,产率85%)。1HNMR (600 MHz,CDCl3):7.39~7.27 (m,2H,Ar),7.35~7.26 (m,11H,Ar),7.25~7.21 (m,10H,Ar),7.18~7.15 (m,2H,Ar),6.86 (d,J=9.1 Hz,2H,Ar),6.72 (d,J=9.1 Hz,2H,Ar),5.30 (d,J=4.1 Hz,1H,HA-1),5.13~5.10 (m,1H),5.08 (d,J=10.7 Hz,1H,HC-1),5.06 (d,J=3.1 Hz,1H,HB-1),4.98~4.91 (m,2H),4.78 (d,J=11.8 Hz,1H),4.72~4.66 (m,3H),4.60~4.56 (m,2H),4.41~4.38 (m,2H),4.36~4.35 (m,3H),4.32~4.30 (m,2H),4.13~4.09 (m 2H),4.00~3.96(m,3H),3.90 (d,J=2.8 Hz,1H),3.83~3.80 (m,1H),3.73(s,3H,CH3),3.60~3.54(m,5H),2.12(s,3H,NHAc),2.04(s,3H,Ac),2.01(s,3H,Ac),2.00(s,3H,Ac),1.99 (s,3H,Ac)。13CNMR (151 MHz,CDCl3):171.13,170.26,170.00,167.86,154.94,151.44,138.78,138.71,138.67,138.33,138.17,132.48,131.05,128.99,128.65,128.60128.46, 128.38,128.31,128.12,127.99,127.94,127.76,127.73,127.68,127.62,117.70,114.60,103.62,99.26,99.05,82.09,79.65,75.39, 75.30,75.18,74.93,74.02,73.54,73.48,73.20,70.91,70.49,70.20,69.18,68.83,66.86,65.71,60.79,55.78,49.28,30.72,29.84, 29.47,29.38,23.17,22.83,21.07,20.81,20.77,20.68,19.33,14.25,13.86。HR-Q-TOF-MS: 计算值C70H79NO21 [M+Na+] m/z 1 292.514 5,测得值为1 292.504 9。
1.4 化合物的确证所有新化合物都由1HNMR、13CNMR和质谱确证。
2 结果和讨论 2.1 糖基供体的选择原始路线中我们设计的是全乙酰化的硫苷供体14,与二糖受体化合物3糖基化得到化合物7。但是实际反应中基本上看不到产物。相关文献报道糖基受体4位的活性非常弱,远低于3位和6位[14]。因此本实验改用了更活泼的乙酰亚胺酯类供体2,以三氟甲磺酸三甲基硅酯为催化剂,成功制得三糖化合物7,产率达78%。
2.2 糖基化的立体选择性半乳糖供体5的C-2位本实验选用的是苄基保护,无邻基参与效应,从而保证主要生成α-异构体的化合物6。TLC显示α/β-异构体极性相同,不易分离。在下一步开苄叉后,α/β-异构体极性出现明显差别,硅胶柱层析得α-异构体。糖类化合物的端基碳信号一般在化学位移95~110左右,α-型为98~102,β-型为103~106[15]。化合物3 B环端基碳的化学位移为102.00。此外,温度条件对硫苷糖基化产物构型有很大影响,温度越低越有利于α-异构体生成(表 1)。半乳糖供体2的C-2位的乙酰基是糖化学保护方案中最经典最有效的邻基参与基团[16],确保主要生成β-型糖基化产物。化合物7 C环端基碳的化学位移为103.62,端基氢化学位移为5.08,耦合常数 J=10.7 Hz。而同类α-糖化合物端基氢的耦合常数J一般小于6 Hz[15]。
|
|
表 1 温度对硫苷糖基化产物构型的影响 Tab 1 Effect of temperature variation on thioglycosides product configuration |
本研究采用最简单易得的单糖原料,合成了全保护的半乳吡喃糖基(α1→4)-(半乳吡喃糖基)(β1→3)-2-脱氧-2-氨基-葡萄吡喃糖对甲氧基苯酚苷。化合物6和7的对甲苯氧基团可选择性离去,便于合成具有相近结构的多糖化合物,以及偶联具有相应生物活性的寡糖缀合物,在合成糖化学以及生物化学相关研究领域具有广泛应用价值。
| [1] | Anish C, Schumann B, Pereira C L, Seeberger P H. Chemical biology approaches to designing defined carbohydrate vaccines[J].Chem Biol, 2014, 16: 38-50. |
| [2] | Jończyk-Matysiak E, Klak M, Weber-Dabrowska B, Borysowski J, Górski A. Possible use of bacteriophages active against Bacillus anthracis and other B. cereus group members in the face of a bioterrorism threat[J]. Biomed Res Int, 2014, 2014:735413. |
| [3] | Wang H Y, Guo H, O'Doherty G A. De novo asymmetric synthesis of oligo-rhamno di-and tri-saccharides related to the anthrax tetrasaccharide[J]. Tetrahedron, 2013, 69: 3432-3436. |
| [4] | Wang Y, Liang X, Wang P F. Concise synthesis of Bacillus anthracis exosporium tetrasaccharide via two-stage activation of allylglycosyl donor strategy[J]. Tetrahedr Lett, 2011, 52: 3912-3915. |
| [5] | Guo H, O'Doherty G A. De novo asymmetric synthesis of the anthrax tetrasaccharide by a palladium-catalyzed glycosylation reaction[J]. Angew Chem Int Edit, 2007, 46: 5206-5208. |
| [6] | Choudhury B, Leoff C, Saile E, Patricia W, Quinn C P, Kannenberg E L, et al. The structure of the major cell wall polysaccharide of Bacillus anthracis is species-specific[J]. J Bio Chem, 2006, 281: 27932-27941. |
| [7] | Wang Z, Chinoy Z S, Ambre S G, Peng W, McBride R, de Vries R P, et al. A general strategy for the chemoenzymatic synthesis of asymmetrically branched N-glycans[J]. Science, 2013, 341: 379-383. |
| [8] | 蔡孟深.保护基[M]//蔡孟深,李忠军. 糖化学——基础、反应、合成、分离及结构.北京:化学工业出版社,2006: 34-64. |
| [9] | 张军良, 郭燕文. 糖化学中的保护基团[M]//张军良, 郭燕文.基础糖化学.北京:中国医药科技出版社,2008:63-89. |
| [10] | Qiao Y, Gu G F, Guo Z W. A facile synthesis of the tetrasaccharide repeating unit of the O-antigen from cronobacter turicensis[J]. J Carbohydr Chem,2015,34: 121-132. |
| [11] | 李 翔,郭俊香,张春梅,吴秋业,胡宏岗. N-(9-芴甲氧羰基)-O-(2,3,4,6-四苄基-α-D-半乳糖基)-L-丝氨酸的合成[J].第二军医大学学报, 2011, 32: 1227-1230. LI X, GUO J X, ZHANG C M, WU Q Y, HU H G. Synthesis of N-(9-fluorenylmethoxycarbonyl)-O-(2,3,4,6-tetra-O-benyl-α-D-galactopyranosyl)-L-serine[J]. Acad J Sec Mil Med Univ, 2011, 32: 1227-1230. |
| [12] | Gouin S G, Pilgrim W, Porter R K, Murphy P V. Synthesis of a glycolipid for studying mechanisms of mitochondrial uncoupling proteins[J]. Carbohydr Res, 2005, 340: 1547-1552. |
| [13] | Liu L, Zha J, DiGiandomenico A, Mc Allister D, Stover C K, Wang Q, et al. Synthetic enterobacterial common antigen (ECA) for the development of a universal immunotherapy for drug-resistant enterobacteriaceae[J]. Angew Chem, 2015, 54: 1-6. |
| [14] | Qu H, Liu J M, Wdzieczak-Bakala J, Lu D, He X, Sun W, et al. Synthesis and cytotoxicity assay of four ganglioside GM3 analogues[J]. Eur J Med Chem, 2014, 75: 247-257. |
| [15] | 章由林,文 翰.糖的结构鉴定[M]//蔡孟深,李忠军. 糖化学——基础、反应、合成、分离及结构.北京:化学工业出版社, 2006: 370-410. |
| [16] | Zhu X, Schmidt R R. New principles for glycoside-bond formation[J]. Angew Chem, 2009, 48: 1900-1934. |
 2016, Vol. 37
2016, Vol. 37


