2. 中山大学孙逸仙纪念医院, 广州 510000
2. Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510000, Guangdong, China
膀胱非尿路上皮癌临床上较为少见,占膀胱恶性肿瘤的不到5%[1],其病理类型复杂多样,术前难以明确诊断,与膀胱尿路上皮癌相比恶性程度较高,预后较差。第二军医大学长海医院自2009年至2015年共收治膀胱非尿路上皮癌患者31例,现总结报告如下。
1 材料和方法 1.1 患者基本资料本组31例,男26例、女5例,年龄31~84岁,平均年龄(61.0±12.7)岁。主要临床表现为肉眼血尿24例(77.4%),其他初诊症状还包括下尿路症状(LUTS) 3例,镜下血尿2例,腰痛1例;体检发现1例。术前主要的辅助检查包括B超、盆腔CT、膀胱镜检+活检。膀胱多发病灶14个,单发17个。肿瘤发生部位位于左右侧壁12例,顶壁7例,三角区4例,底部2例,范围巨大布满膀胱的3例,两侧输尿管口2例,后壁1例。肿瘤直径0.5~14 cm,其中≥3 cm者20例(64.5%),<3 cm者11例。
1.2 治疗方法31例患者中行膀胱全切术18例,病理类型包括鳞癌6例、腺癌6例、肉瘤样癌3例、腺鳞癌2例、小细胞癌1例。膀胱部分切除术4例(4例患者肿瘤均为局限于顶壁、前壁或侧壁的单发肿瘤),病理类型包括腺癌2例、鳞癌1例、小细胞癌1例,其中2例术后行全身化疗。经尿道膀胱肿瘤电切术(TURBT)6例,病理类型均为腺癌,其中2例术后定期行吡柔比星膀胱灌注化疗。放弃手术治疗3例,其中1例腺癌肺转移行化疗,1例鳞癌行化疗加放疗,1例透明细胞腺癌未治疗。根据术后TNM分期,T1期1例,T2期23例(74.2%),T3期1例,T4期6例。有转移者7例(22.6%),其中局部淋巴结转移者6例(19.4%),肺转移1例。
1.3 随访时间和方法术后3、6个月门诊复查泌尿系B超及盆腔CT,之后每半年门诊复查。定期进行电话随访。
2 结 果 2.1 总体无复发和生存情况术后2例失访,均为腺癌患者;余29例随访2~62个月。其中15例无复发,总体无复发率为48.4%;随访期间20例患者生存,总体生存率为64.5%(图 1)。
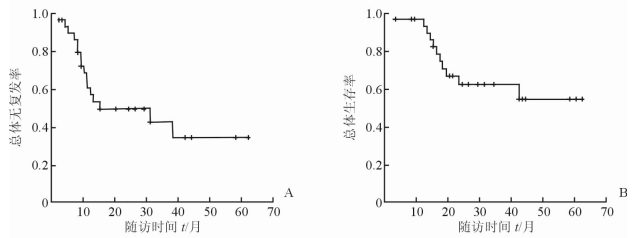
|
图 1 31例患者总体无复发率(A)和总体生存率(B) |
20例患者术前有膀胱镜检或电切术病理结果,其中7例术前病理结果与术后病理结果不一致。16例腺癌直径1~14 cm,平均(3.6±3.0) cm;其中多发10例,占腺癌的62.5%;腺癌患者中10例复发,中位复发时间为11个月(四分位间距7~24个月);6例死亡,中位生存时间为23个月(四分位间距16~42个月)。8例鳞癌直径2.5~7 cm,平均4.1 cm;多发和单发各占一半;鳞癌患者中3例复发,中位复发时间9个月(四分位间距5~15个月);3例死亡,中位生存时间15个月(四分位间距9~18个月)。其他病理类型患者中3例复发,中位复发时间为15个月(四分位间距11~31个月);2例死亡,中位生存时间为26个月(四分位间距15~42个月)。
2.3 不同治疗方式患者复发和生存情况行全膀胱切除手术者中位复发时间15个月(四分位间距9~34个月),中位生存时间24个月(四分位间距15~42个月);行膀胱部分切除手术者中位复发时间是9个月(四分位间距6~32个月),中位生存时间为18个月(四分位间距12.5~34个月);行TURBT者中位复发时间为10个月(四分位间距6.5~23个月),中位生存时间22个月(四分位间距19~29个月)。
3 讨 论膀胱非尿路上皮癌发病率低,临床表现、影像学检查包括膀胱镜检查等均无特异性表现,膀胱镜常规活检的阳性率也不高,常需要根据术后病理明确诊断。非尿路上皮癌一般恶性程度高,大部分呈浸润性生长,常需尽快手术治疗,预后较差。根据WHO 2004年的分类标准,膀胱非尿路上皮癌包括鳞癌、腺癌、混合性癌、未分化癌、肉瘤、巨细胞癌、透明细胞癌等病理类型[2]。本组病例包括腺癌、鳞癌、肉瘤、未分化癌(小细胞癌)和混合性癌(腺鳞癌)5个病理类型。
3.1 膀胱腺癌膀胱腺癌占膀胱恶性肿瘤的0.5%~2%[3]。根据原发部位不同可分为非脐尿管腺癌和脐尿管腺癌。根据组织类型不同又可分为肠型、印戒细胞型、黏液型、透明细胞型、肝型、混合型和未另外特别分类的腺癌,其中以未特别分类和黏液型这两种类型占多数。本组16例腺癌患者中,仅有1例为脐尿管腺癌,5例黏液腺癌,1例印戒细胞癌,1例透明细胞腺癌,其余8例为未另外特殊分类。腺癌多见于60岁以上男性[4];原发的膀胱腺癌侵袭性高,发现时大部分(60%~70%)已浸润肌层[5],总体的生存期较差[6]。有报道认为在分期较晚的腺癌行根治性切除对于生存期的改善不明显,早期手术切除是建议的治疗方式[7]。非脐尿管腺癌建议行膀胱根治性切除术,经尿道或膀胱部分切除的疗效差,术后放疗有助于提高无复发生存率[8],对于有转移的腺癌可以考虑使用化疗[9];脐尿管腺癌手术主要有扩大膀胱部分切除和根治性膀胱切除两种,放疗和化疗效果不明显,手术切缘和淋巴结阳性与否与预后相关[10]。本组病例中,16例腺癌患者中6例行全膀胱根治性切除(平均复发时间为24个月,平均生存时间36个月),2例行膀胱部分切除手术(分别于13个月和43个月后死亡),6例行TURBT(平均复发时间为14个月,平均生存时间24个月,其中2例行膀胱灌注者分别生存16个月和21个月),2例放弃手术治疗(1例肺转移行化疗生存19个月,1例未治疗生存8个月),初步比较可见行全膀胱切除手术患者预后好于其他治疗方式,手术患者预后好于未手术患者,化疗对于患者预后的影响不明显。
3.2 膀胱鳞癌膀胱鳞癌在膀胱恶性肿瘤中发病率排名第2位,约占2%~5%[11],好发于侧壁及三角区[12]。长期膀胱黏膜的刺激和反复的炎症与鳞癌的发生有关[13],鳞癌出现临床症状较晚,明确诊断时往往局部已有进展,预后明显较尿路上皮来源肿瘤差,文献报道的5年生存率为20%~50%[11]。手术切除是最有效的治疗方法,有报道认为对局限于膀胱壁的鳞癌进行根治切除可使生存期与尿路上皮癌相近[14],术后局部复发是影响预后的主要因素[12]。由于目前关于接受放疗和化疗后能否改善预后的报道较少,没有足够明确的证据证明放疗和化疗的疗效,一般认为对放疗、化疗反应不敏感[15]。本组研究中,8例鳞癌患者复发率为37.5%(3/8),生存率62.5%(5/8);其中6例行全膀胱根治性切除术治疗(平均生存22个月),1例行膀胱部分切除术(生存18个月),1例放弃手术行吉西他滨联合顺铂(GP)方案化疗加放疗(生存12个月)。
3.3 肉瘤膀胱肉瘤较罕见,好发于中老年人,多位于膀胱顶壁及侧壁,肿瘤较大,侵袭性高,一经确诊需行根治性全膀胱切除术,术后复发率较高,手术切缘的情况是影响预后的重要因素,化疗的作用仍需进一步研究明确,5年生存率约50%~80%[16]。肉瘤中最常见的类型是平滑肌肉瘤,约占到膀胱肉瘤的一半,其次为横纹肌肉瘤、血管肉瘤、纤维肉瘤和未分类的肉瘤等。肉瘤样癌和癌肉瘤是两种罕见的类型,预后极差,70%的患者在2年内死亡[17]。本组3例肉瘤患者均行全膀胱切除术治疗,2例在术后1年内出现复发,其中1例1年内死亡,3例术后生存时间分别为11、31和42个月。
3.4 未分化癌(小细胞癌)小细胞癌在膀胱癌中极其罕见,约占0.35%~0.70%,好发于男性,肉眼血尿是最常见的症状,与尿路上皮癌相比肿瘤更大,侵袭性更高,转移途径与尿路上皮癌相似,如淋巴结、肝脏、骨转移等,肺部转移一般在晚期转移中出现,预后极差,中位生存期为19.6个月,5年生存率为8.1%[18]。除有转移的患者考虑全身化疗外,其余患者均建议行根治性全膀胱切除术,新辅助化疗配合手术治疗或放疗对小细胞癌的治疗最为有效[19]。本组2例小细胞癌患者,其中1例行膀胱部分切除术配合化疗,术后随访26个月未复发;1例行全膀胱切除术,未化疗,术后13个月出现复发,术后生存17个月。
3.5 混合性癌混合性癌是指同一肿瘤中混合有不同的组织类型,膀胱混合性癌中常见有鳞癌、腺癌、小细胞癌、尿路上皮癌之间的混合。混合性癌更容易出现进展和转移[20],预后极差,建议行根治性全膀胱切除术,配合进行有针对性的新辅助化疗[21]。本组2例患者均行全膀胱切除术,术后分别随访15个月和44个月未见复发。
总之,膀胱非尿路上皮癌较为少见,肿瘤的侵袭性高,临床上缺乏特异性的表现,膀胱镜活检可能与术后病理有差异,首诊时往往已有转移,预后较差。大部分非尿路上皮癌的治疗还需要进一步明确,主要以根治性全膀胱切除术为主,早期手术对于改善预后有积极的作用;根据类型和分期不同,配合放疗和化疗。
| [1] | Khan M S, Thornhill J A, Gaffney E, Loftus B, Butler M R. Keratinising squamous metaplasia of the bladder: natural history and rationalization of management based on review of 54 years experience[J]. Eur Urol,2002,42:469-474. |
| [2] | Lopez-Beltran A. Bladder cancer: clinical and pathological profile[J]. Scand J Urol Nephrol Suppl,2008(218):95-109. |
| [3] | Pons F, Orsola A, Morote J, Bellmunt J. Variant forms of bladder cancer: basic considerations on treatment approaches[J]. Curr Oncol Rep, 2011,13:216-221. |
| [4] | Roy S, Smith M A, Cieply K M, Acquafondata M B, Parwani A V. Primary bladder adenocarcinoma versus metastatic colorectal adenocarcinoma: a persisting diagnostic challenge[J]. Diagn Pathol, 2012,7:151. |
| [5] | Arslan B, Bozkurt I H, Yonguc T, Vardar E, Degirmenci T, Kozacioglu Z, et al. Clinical features and outcomes of nontransitional cell carcinomas of the urinary bladder: analysis of 125 cases[J]. Urol Ann, 2015,7:177-182. |
| [6] | Thomas A A, Stephenson A J, Campbell S C, Jones J S, Hansel D E. Clinicopathologic features and utility of immunohistochemical markers in signet-ring cell adenocarcinoma of the bladder[J]. Hum Pathol,2009,40:108-116. |
| [7] | Lughezzani G, Sun M, Jeldres C, Alasker A, Budaus L, Shariat S F, et al. Adenocarcinoma versus urothelial carcinoma of the urinary bladder: comparison between pathologic stage at radical cystectomy and cancer-specific mortality[J]. Urology, 2010,75:376-381. |
| [8] | Zaghloul M S, Nouh A, Nazmy M, Ramzy S, Zaghloul A S, Sedira M A, et al. Long-term results of primary adenocarcinoma of the urinary bladder: a report on 192 patients[J]. Urol Oncol, 2006,24:13-20. |
| [9] | Tran B, McKendrick J. Metastatic urachal cancer responding to FOLFOX chemotherapy[J]. Can J Urol, 2010, 17:5120-5123. |
| [10] | Siefker-Radtke A O, Gee J, Shen Y, Wen S, Daliani D, Millikan R E, et al. Multimodality management of urachal carcinoma: the M. D. Anderson Cancer Center experience[J]. J Urol, 2003,169:1295-1298. |
| [11] | Rausch S, Lotan Y, Youssef R F. Squamous cell carcinogenesis and squamous cell carcinoma of the urinary bladder: a contemporary review with focus on nonbilharzial squamous cell carcinoma[J]. Urol Oncol,2014, 32: 32.e11-e16. |
| [12] | Kassouf W, Spiess P E, Siefker-Radtke A, Swanson D, Grossman H B, Kamat A M, et al. Outcome and patterns of recurrence of nonbilharzial pure squamous cell carcinoma of the bladder: a contemporary review of The University of Texas M D Anderson Cancer Center experience[J]. Cancer, 2007,110:764-769. |
| [13] | El-Sebaie M, Zaghloul M S, Howard G, Mokhtar A. Squamous cell carcinoma of the bilharzial and non-bilharzial urinary bladder: a review of etiological features, natural history, and management[J]. Int J Clin Oncol, 2005,10:20-25. |
| [14] | Scosyrev E, Yao J, Messing E. Urothelial carcinoma versus squamous cell carcinoma of bladder: is survival different with stage adjustment[J]. Urology, 2009,73:822-827. |
| [15] | Gluck G, Hortopan M, Stǎnculeanu D, Chiriǎ M, Stoica R, Sinescu I. Comparative study of conventional urothelial carcinoma, squamous differentiation carcinoma and pure squamous carcinoma in patients with invasive bladder tumors[J]. J Med Life, 2014,7:211-214. |
| [16] | Spiess P E, Kassouf W, Steinberg J R, Tuziak T, Hernandez M, Tibbs R F, et al. Review of the MD Anderson experience in the treatment of bladder sarcoma[J]. Urol Oncol,2007,25:38-45. |
| [17] | Wright J L, Black P C, Brown G A, Porter M P, Kamat A M, Dinney C P, et al. Differences in survival among patients with sarcomatoid carcinoma, carcinosarcoma and urothelial carcinoma of the bladder[J]. J Urol, 2007, 178:2302-2306. |
| [18] | Choong N W, Quevedo J F, Kaur J S. Small cell carcinoma of the urinary bladder. The Mayo Clinic experience[J]. Cancer, 2005,103:1172-1178. |
| [19] | Ismaili N. A rare bladder cancer-small cell carcinoma: review and update[J]. Orphanet J Rare Dis, 2011,6:75. |
| [20] | Wasco M J, Daignault S, Zhang Y, Kunju L P, Kinnaman M, Braun T, et al. Urothelial carcinoma with divergent histologic differentiation (Mixed histologic features) predicts the presence of locally advanced bladder cancer when detected at transurethral resection[J]. Urology, 2007,70:69-74. |
| [21] | Blacks P C, Brown G A, Dinney C P. The impact of variant histology on the outcome of bladder cancer treated with curative intent[J]. Urol Oncol, 2009, 27:3-7. |
 2016, Vol. 37
2016, Vol. 37


