2. 陕西省人民医院药剂科, 西安 710068
2. Department of Pharmacy, Shaanxi Provincial People's Hospital, Xi'an 710068, Shaanxi, China
广枣为漆树科南酸枣属植物南酸枣[Choerospondias axillaris(Roxb.)Burtt et Hill]的干燥成熟果实,性味甘、酸、平,有行气活血、养心安神之功[1]。广枣具有抗心肌缺血和心律失常、抑制血小板聚集、抗缺氧、清除自由基、抗氧化以及诱导细胞凋亡等多种药理作用,临床上常用于治疗气滞血瘀、胸痹作痛、心悸气短、心神不安等心血管疾病[2, 3, 4, 5, 6]。而广枣的化学成分及药效作用的物质基础尚不明确,因此对其化学成分的研究工作十分重要。高效液相色谱-四级杆-飞行时间串联质谱法(HPLC-Q-TOF-MS/MS)是一种将色谱的高效在线分离与质谱的高灵敏度、高选择性完美结合的联用技术,能够准确快速地对药材化学成分进行定性分析。当前对广枣化学成分的研究基本按分离、提纯、鉴定的方式进行,很少采用液相色谱-质谱分析法[7]。本研究采用HPLC-Q-TOF-MS/MS法对广枣醇提物进行定性分析,用电喷雾电离源正离子模式和负离子模式对色谱流出物进行检测,通过高分辨质谱分析结合对照品数据、数据库及相关文献共鉴定了42个化合物,其主要成分为氨基酸类、有机酸类、黄酮类等物质,旨在为广枣的药效物质基础研究提供有力依据。
1 材料和方法 1.1 仪器安捷伦科技公司1200 Series 型高效液相色谱系统,包括在线脱气机、二元梯度泵、自动进样器、柱温箱和二极管阵列检测器;6520 Accurate-Mass Q-TOF LC/MS/MS,配有采集与数据处理软件(mass hunter workstation software version B.04.00)。XS105Dual Range万分之一天平(瑞士METTLER-TOLEDO)。
1.2 试剂没食子酸(批号110831-201204)、原儿茶酸(批号110809-201205)、原儿茶醛(批号110810-201007)、槲皮素(批号100081-200907)、熊果酸(批号110742-201220)、5-羟甲基糠醛(批号111626-201308)、儿茶素(批号110877-201203)等对照品均购于中国食品药品检定研究院;柠檬酸、对羟基苯甲酸、间羟基苯甲酸、水杨酸、鞣花酸等对照品均购于国药集团化学试剂有限公司;色谱纯甲醇及甲酸购于美国Fisher公司;实验用水为超纯水;其他试剂均为分析纯。
广枣药材购于西安市万寿路药材市场,并由西北大学生命科学学院房敏峰副教授鉴定为漆树科植物南酸枣Choerospondias axillaris(Roxb.)的干燥成熟果实。
1.3 样品制备 1.3.1 混合对照品溶液的制备分别精密称取没食子酸、原儿茶酸、原儿茶醛、槲皮素、熊果酸、5-羟甲基糠醛和儿茶素、柠檬酸、对羟基苯甲酸、间羟基苯甲酸、水杨酸、鞣花酸对照品各20 mg,置于5 mL避光容量瓶,用甲醇定容,制成质量浓度为4 mg/mL的混合对照品溶液,连续2次4倍稀释至质量浓度为0.25 mg/mL,于4℃冷藏保存。
1.3.2 广枣醇提物的制备将干燥至恒质量的广枣药材去核,将果肉粉碎,过40目筛。称取50 g样品4~6倍70%乙醇回流提取2次[8],每次时间均为1 h,滤过,合并滤液,减压浓缩至约20 mL,转移至25 mL容量瓶,加水定容,制得含生药质量浓度为2 g/mL的广枣乙醇提取液。将广枣醇取液稀释10倍,0.45 μm有机微孔滤膜过滤,取续滤液进行HPLC-Q-TOF-MS/MS分析。
1.4 HPLC-Q-TOF-MS/MS条件 1.4.1 液相色谱条件色谱柱:Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相:0.2%甲酸水(A)-甲醇(B),梯度洗脱,0~15 min 10% B,15~60 min 10%~85% B,60~70 min 100% B;流速:0.7 mL/min;柱温:30℃;进样量:25 μL;柱后3∶1分流,1/4导入质谱进行定性分析。
1.4.2 质谱条件电喷雾离子源(ESI);毛细管电压:4.0 kV;干燥气温度:350℃;干燥气流速:10 L/min;雾化气压力:35 psi(1 psi=6 894.8 Pa);碎裂电压:135 V;正负离子模式下扫描检测,一级质谱扫描范围:100~1 000 m/z,二级质谱扫描范围:50~1 000 m/z;正离子模式下参比离子设置为m/z 121.050 9和922.009 8,负离子模式下参比离子设置为m/z 112.985 5和966.000 7。
2 结 果在拟定的分析条件下,广枣醇提物和混合对照品在正负离子模式下的总离子流图如图 1 和图 2所示。通过对正负离子模式下的一级、二级质谱图(图 3)进行分析,并根据保留行为结合数据库METLIN、Massbank和Human Metabolome Database (HMDB)及相关文献报道进行结构鉴定,共确定了42种成分(表 1),其中已有报道的有25种成分,首次在广枣中发现的成分有17种。
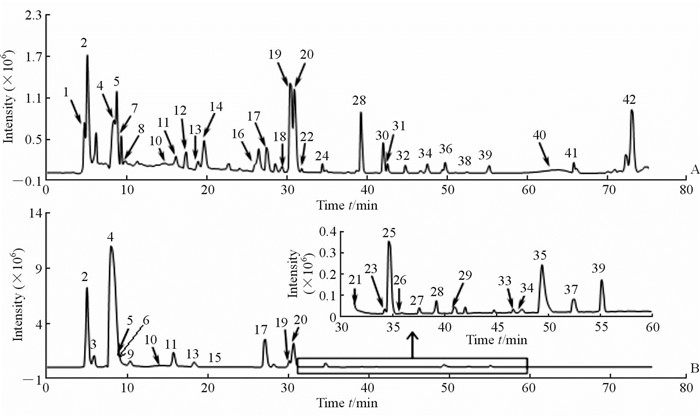
|
图 1 广枣醇提物总离子流图 Fig 1 The total ion chromatogram of ethanol extract of Choerospondiatis fructus A: Positive mode; B: Negative mode. 1: Proline; 2: Quininic acid; 3: Malic acid; 4: Citric acid; 5: Isoleucine; 6: Succinic acid; 7: Leucine; 8: Tyrosine; 9: Monoglyceride citrate; 10: Chebulic acid; 11: Gallic acid; 12: Phenylalanie; 13: Methylcitrate; 14: 5-Hydroxymethylfurfural; 15: Methylcitrate; 16: Pantothenic acid; 17: Protocatechuic acid; 18: Comenic acid; 19: Triethyl citrate; 20: Triethyl citrate; 21: Protocratechualdehyde; 22: Dimeric catechin; 23: p-Hydroxybenzoic acid; 24: Catechinic acid; 25: 2-Isopropyl malic acid; 26: m-Hydroxybezoic acid; 27: Salicylic acid; 28: 6-Hydroxy indole lactic acid; 29: Ethyl gallate; 30: Scopoletin; 31: Quercetin-3-O-arab sugar-glucoid; 32: Methyl ellagic acid glucoside; 33: Dimethoxy ellagic acid glycosidase; 34: Hyperin; 35: Gallogen; 36: Quercetin-3’-O-rhamnoside; 37: Methylellagic acid; 38: Quercetin; 39: 3,3’-Dimethyl ellagic acid; 40: Stearic acid; 41: Dibutyl phthalate; 42: Ursolic acid |
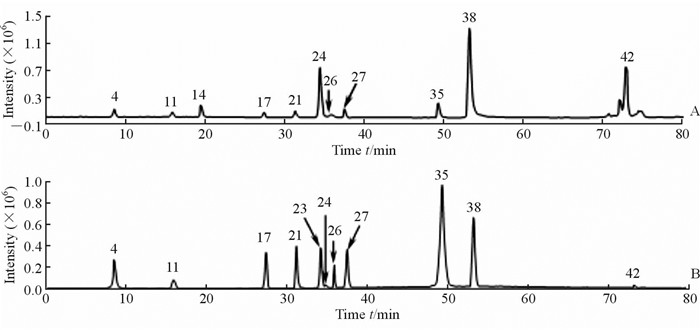
|
图 2 混合对照品总离子流图 Fig 2 The total ion chromatogram of the mixed reference solution A: Positive mode; B:Negative mode. 4: Citric acid; 11: Gallic acid; 14: 5-Hydroxymethylfurfural; 17: Protocatechuic acid; 21: Protocratechualdehyde; 23: p-Hydroxybenzoic acid; 24: Catechinic acid; 26: m-Hydroxybezoic acid; 27: Salicylic acid; 35: Gallogen; 38: Quercetin; 42: Ursolic acid |
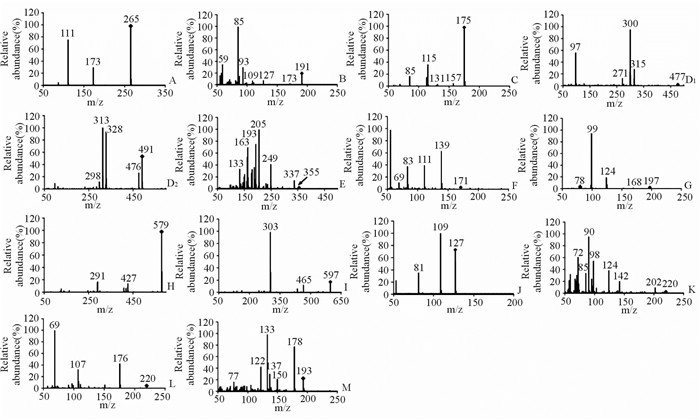
|
图 3 广枣化学成分二级质谱图 Fig 3 MS2 spectrum of chemical constituents in Choerospondiatis fructus A: Monoglyceride citrate; B: Quininic acid; C: 2-Isopropyl malic acid; D1: Methyl ellagic acid glucoside; D2: Dimethoxy ellagic acid; E: Chebulic acid; F: Comenic acid; G: Ethyl gallate; H: Dimeric catechin; I: Quercetin-3-O-arab sugar-glucoid; J: 5-Hydroxymethylfurfural; K: Pantothenic acid; L: 6-Hydroxy indole lactic acid; M: Scopoletin |
|
|
表 1 广枣醇提物的HPLC-Q-TOF-MS/MS分析结果 Tab 1 HPLC-Q-TOF-MS/MS analysis results of ethanol extracts from Choerospondiatis fructus |
在正离子模式下,从广枣中鉴定出5种氨基酸,m/z分别为116.069 8、132.102 1、132.102 0、182.081 2、166.085 9,保留时间为4.7、8.7、9.3、9.8、17.4 min,在裂解过程中均易产生HCOOH (46)和NH3 (17)质谱二级特征碎片离子,是α-氨基酸特有的中性碎片丢失[9]。通过EIC扫描与METLIN数据库中的二级碎片离子峰对比,结合文献报道[4],鉴定化合物1、8和12为脯氨酸、酪氨酸和苯丙氨酸。提取m/z 132.102 1色谱图有2个色谱峰,它们的二级碎片均为m/z 86 [M+H-46]+和m/z 69[M+H-46-17]+,保留时间为8.7和9.3 min,即说明化合物5和7是同分异构体,而化合物5裂解产生m/z 69的离子丰度远大于化合物7,并通过保留时间可判断化合物6的极性比化合物8大,同时根据文献报道[4],可鉴定化合物5为异亮氨酸,7为亮氨酸。
2.2 有机酸类成分 2.2.1 脂肪酸及其衍生物在负离子模式下,鉴定了12个脂肪酸及其衍生物。其中已报道的成分包括苹果酸(3)、柠檬酸(4)、琥珀酸(6)、柠檬酸甲酯(13,15)、柠檬酸乙酯(19,20)、硬脂酸(40)和熊果酸(42)。首次在广枣果肉中发现奎宁酸(2)、柠檬酸单甘油酯(9)和2-异丙基苹果酸(25)。通过对照品的保留时间、一级质谱和二级碎片信息结合文献报道[10],确定化合物4为柠檬酸(m/z 191.019 8,保留时间8.4 min)。化合物13、15、20、9与柠檬酸有相同的离子碎片m/z 173和111,如图 3A,推测它们是柠檬酸衍生物。其中化合物13和15为柠檬酸甲酯的同分异构体,化合物19和20为柠檬酸乙酯的同分异构体。通过HMDB数据库比对推测化合物9为柠檬酸单甘油酯,化合物2、25分别为奎宁酸和2-异丙基苹果酸,见图 3B和图 3C,奎宁酸具体裂解途径如图 4。由图 3C和相关文献[10],推测化合物3为苹果酸。按同样方法鉴定化合物6、40、42分别为琥珀酸、硬脂酸和熊果酸,其一级质谱和二级质谱信息均与数据库中的相应化合物一致。
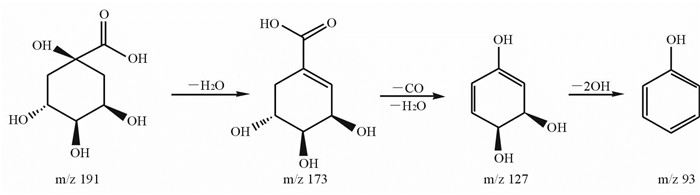
|
图 4 奎宁酸裂解途径 Fig 4 Fragment pathway of quininic acid |
在负离子模式下分析并鉴定了广枣中的15种芳香酸及其衍生物,其中已报道的芳香酸及其酯类包括没食子酸(11)、原儿茶酸(17)、对羟基苯甲酸(23)、水杨酸(27)、鞣花酸(35)、3,3-二甲基鞣花酸(39)、邻苯二甲酸二丁酯(41)。首次在广枣果皮中发现的芳香酸及衍生物分别为诃子次酸(10)、comenic acid(18)、原儿茶醛(21)、间羟基苯甲酸(26)、没食子酸乙酯(29)、甲基鞣花酸-葡萄糖苷(32)、二甲基鞣花酸-葡萄糖苷(33)、甲基鞣花酸(37)。与对照品比对,确定化合物11、17、21、23、26、27、35分别为没食子酸、原儿茶酸、原儿茶醛、对羟基苯甲酸、间羟基苯甲酸、水杨酸、鞣花酸,见图 2。化合物11裂解途径如图 5。提取离子m/z 137.024 5出现保留时间为31.2、34.2、35.9和37.5 min,理论分子式均为C7H6O3的4个色谱峰,即是同分异构体。根据METLIN数据库二级碎片信息、反相色谱出峰特点及相应对照品可知化合物21、23、26、27分别为原儿茶醛、对羟基苯甲酸、间羟基苯甲酸、水杨酸(图 2)。鞣花酸的质荷比m/z为300.999 6,从二级质谱图中可观察到含有特征离子m/z 299.997 3的3个色谱峰,分别标记为化合物35、37和39,其中35已证明为鞣花酸,推测化合物37和39是鞣花酸衍生物。根据二级碎片离子峰(图 3D1、3D2),以及文献报道[11, 12]鉴定化合物37、39分别为甲基鞣花酸、3,3’-二甲基鞣花酸,裂解途径如图 6。化合物32和33分子离子峰分别为m/z 477.068 8、491.083 1,并且均中性丢失162的碎片峰m/z 315[M-H-glucoside]-和m/z 328[M-H-glucoside]-,可知是化合物37和39的葡萄糖苷类,即3-甲基鞣花酸-葡萄糖苷和3,3’-二甲基鞣花酸-葡萄糖苷,糖苷的结合位置需进一步研究确认(图 3D1、3D2)。化合物10根据m/z 355.031 6、分子式C14H12O11以及主要碎片离子m/z 337、249、205、193、163和133(图 3E),推测为诃子次酸,与文献报道[12]一致。化合物18 [M+H]+为m/z 171.028 5,与没食子酸为同分异构体,其二级质谱图中的碎片离子与comenic acid的结构相符(图 3F),根据文献报道[13],推测化合物18为comenic acid。化合物29 [M-H]-197.046 2、分子式C9H10O5以及主要碎片离子m/z 169[M-H-28]-,124,99,推测为没食子酸的衍生物,分子式比没食子酸的多C2H4(28),即为没食子酸乙酯(图 3G)。
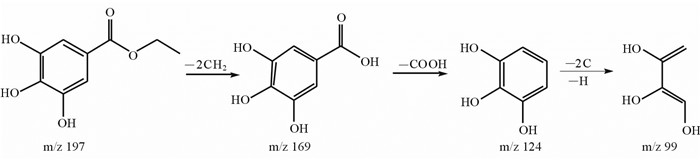
|
图 5 没食子酸乙酯裂解途径 Fig 5 Fragment pathway of ethyl gallate |
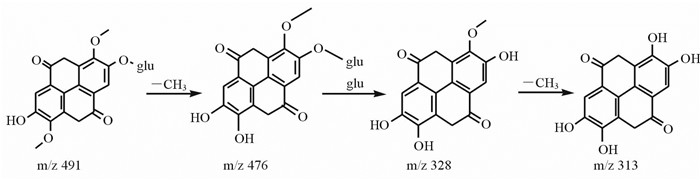
|
图 6 二甲氧基鞣花酸-葡萄糖苷裂解途径 Fig 6 Fragment pathway of dimethoxy ellagic acid-glycosidase |
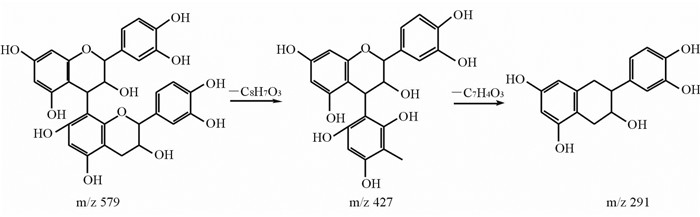
|
图 7 二聚儿茶素裂解途径 Fig 7 Fragment pathway of dimeric catechin |
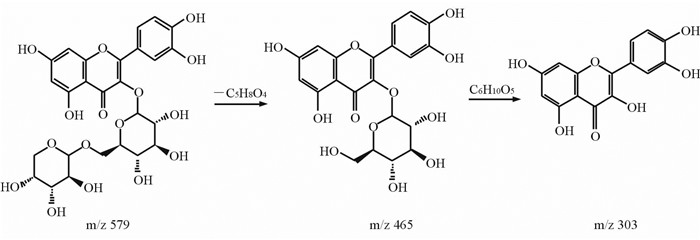
|
图 8 槲皮素-3-O-(阿拉伯糖苷-葡萄糖苷)裂解途径 Fig 8 Fragment pathway of quercetin-3-O-(arabinoside-glucoside) |
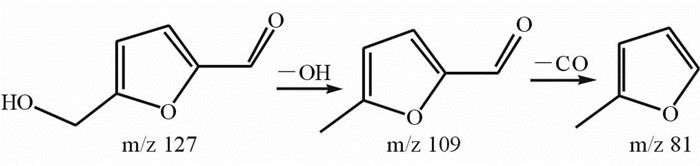
利用HPLC-ESI-TOF-MS 所提供的保留时间、分子式和质谱碎片信息,参考文献研究结果,本实验还首次从广枣的醇提物中鉴定出5-羟甲基糠醛(14)、泛酸(16)、6-羟基吲哚乳酸(28)和东莨菪内酯(30)4个化合物。具体解析和归属过程如下:化合物14的分子离子峰、计算分子式、二级质谱碎片峰与文献报道中5-羟甲基糠醛的质谱信息[20]一致;最后通过与对照品比较后确认化合物14为5-羟甲基糠醛(图 3J),其裂解途径如图 9。在正离子模式下可检测到化合物16和化合物30,通过在METLIN数据库检索并进行二级质谱图比对,最后初步推测化合物16为泛酸(图 3K),化合物28为6-羟基吲哚乳酸(图 3L),化合物30为东莨菪内酯(图 3M)。它们的确切结构还需采用其他分析手段进行验证。
|
图 9 5-羟甲基糠醛裂解途径 Fig 9 Fragment pathway of 5-hydroxymethylfurfural |
参考2015年版《中华人民共和国药典》[1]中广枣主要指标成分没食子酸的分析条件,本实验选用了适用性广的C18色谱柱(Aglient TC-C18,4.5 mm×250 mm,5 μm)。通过考察不同浓度的甲酸比例及纯水比较得知,向水相中加入体积分数为0.2%的甲酸,改善了峰形并保证较高的离子化效率和质谱响应。广枣药材成分复杂,各类成分的极性相差较大,因此选择了大范围、长时间的梯度洗脱,使尽可能多的成分在色谱柱上实现较好分离。采用正、负离子两种模式下同时扫描样品,能最大程度地获取质谱信息。根据各个色谱峰在质谱中的精确相对分子质量、碎片信息、质谱裂解规律和色谱保留规律,并结合标准品的质谱信息和参考文献,最终鉴定出广枣药材果肉提取物中42个化学成分,其中占绝大多数的是有机酸类成分。在已鉴定的42个成分之中,首次在广枣中发现的成分有17个,包括奎宁酸、柠檬酸单甘油酯、诃子次酸、5-羟甲基糠醛、泛酸、comenic acid、原儿茶醛、二聚儿茶素、2-异丙基苹果酸、间羟基苯甲酸、6-羟基吲哚乳酸、没食子酸乙酯、东莨菪内酯、槲皮素-3-阿拉伯糖-7-葡萄糖苷、甲基鞣花酸-葡萄糖苷、二甲基鞣花酸-葡萄糖苷、甲基鞣花酸,这些化合物的结构确证还需进行LC/MS/SPE/NMR分析。从样品总离子流图可以看出,有一些响应较好的色谱峰其质量数未能在已有数据库中找到,表明广枣中还有一些未知成分,有待进一步研究开发。
| [1] | 国家药典委员会. 中华人民共和国药典[S]. 一部. 北京:中国医药科技出版社, 2015: 64. |
| [2] | 王 晓琴, 王力伟, 赵 岩, 马超美. 广枣的化学成分和药理活性研究进展[J]. 食品科学, 2014, 35: 281-285. |
| [3] | 李胜华, 伍贤进, 郑 尧,蒋崇亮. 南酸枣树皮化学成分研究[J]. 中药材, 2009, 32: 1542-1544. |
| [4] | 柳克铃, 温俊达, 金幼蓝. 广枣的氨基酸和无机元素分析[J]. 湖南中医杂志, 1992, 8: 48. |
| [5] | 汤喜兰, 刘建勋, 李 磊, 李 澎, 马彦雷, 史 跃, 等. 广枣模拟总有机酸对心肌缺血再灌注损伤的保护作用[J]. 中国实验方剂学杂志, 2013, 19: 168-172. |
| [6] | 包俊萍, 金 明, 杨雨民, 高晓慧, 舒 亮, 邢慧慧, 等. 广枣总黄酮对体外培养大鼠心脏成纤维细胞Ⅰ, Ⅲ型胶原 mRNA 及蛋白表达的影响[J]. 药学学报, 2014,49:136-141. |
| [7] | Zhao X F, Zhang W J, Kong S S, Zheng X H, Zheng J B, Shi R J. A valid assay for the pharmacokinetic study of Gallic acid from Choerospondiatis fructus in rabbit plasma by LC/MS/MS[J]. J Liq Chromatogr R T, 2007, 30: 235-244. |
| [8] | 唐 丽, 李国玉, 杨柄友, 匡海学.广枣化学成分的研究[J].中草药,2009,40: 541-543. |
| [9] | 陈惜贞. 高效毛细管电泳法快速测定血清中游离氨基酸[J]. 检验医学与临床, 2007,4: 516-517. |
| [10] | 刘晓庚, 陈优生. 南酸枣果实的成分分析[J]. 中国野生植物资源, 2000, 19: 35-40. |
| [11] | 王乃利, 倪 艳, 陈英杰, 姚新生. 广枣活血有效成分的研究1[J]. 沈阳药学院学报, 1987, 4: 203. |
| [12] | Pfundstein B, El Desouky S K, Hull W E, Haubner R, Erben G, Owen R W. Polyphenolic compounds in the fruits of egyptian medicinal plants (Terminalia bellerica, Terminalia chebula and Terminalia horrida): characterization, quantitation and determination of antioxidant capacities[J]. Phytochemistry, 2010, 71: 1132-1148. |
| [13] | Volynkin V A, Pachuev A V, Pirogova A N, Panyushkin V T, Shurygin A Y. An NMR study of comenic acid and its salts with Li+ and Na+ in aqueous solution and solid state[J]. J Struct Chem, 2011, 52: 892-896. |
| [14] | 王玉兰, 吕永镇, 楼朱雄, 祖景余, 梁华清, 周卓伦. 南酸枣树皮中橘柑素和南酸枣苷的分离鉴定[J]. 药学学报, 1983,18: 199-202. |
| [15] | 连 珠, 张承忠, 李 冲, 周亚伟. 蒙药广枣化学成分的研究[J]. 中药材, 2003, 26: 23-24. |
| [16] | Sun W, Miller J M. Tandem mass spectrometry of the B-type procyanidins in wine and B-type dehydrodicatechins in an autoxidation mixture of (+)-catechin and (-)-epicatechin[J]. J Mass Spectrom, 2003, 38: 438-446. |
| [17] | Khabir M, Khatoon F, Ansari W H. Kaempferol-5-O-arabinoside-a new flavonol glycoside from the leaves of choerospondias-axillaris[J]. Indian J Chem B, 1987, 26: 85. |
| [18] | 唐 丽. 广枣和洋金花化学成分的研究[D]. 北京: 北京中医药大学, 2003. |
| [19] | Slimestad R, Torskangerpoll K, Nateland H S, Johannessen T,Giske N H. Flavonoids from black chokeberries, Aronia melanocarpa[J]. J Food Compos Anal, 2005, 18: 61-68. |
| [20] | Teixidó E, Moyano E, Santos F J, Galceran M T. Liquid chromatography multi-stage mass spectrometry for the analysis of 5-hydroxymethylfurfural in foods[J]. J Chromatogr A, 2008, 1185: 102-108. |
 2016, Vol. 37
2016, Vol. 37


