黑棘皮病(acanthosis nigricans,AN)主要表现为颈后、腋窝、腹股沟等部位的皮肤色素沉着,且呈天鹅绒样突起[1, 2],严重者可延及全身。我们先前研究发现,AN患者的胰岛素水平和胰岛素抵抗指数明显升高,且胰岛素抵抗及瘦素抵抗严重,但其糖代谢异常与肥胖患者相比却相对较轻[3],推测AN患者可能存在着一定程度的自我保护机制。
成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是肝脏和脂肪组织分泌的具有调节糖脂代谢能力的细胞因子,研究发现其对白色和棕色脂肪细胞、骨骼肌等靶组织具有内分泌调节功能[4],可以促进脂肪和葡萄糖的氧化分解[5]。 在糖尿病小鼠及猴模型中,给予FGF21类似物治疗能显著增强胰岛素敏感性、降低血浆葡萄糖和三酰甘油(triglyceride,TG)水平、减轻体质量[6, 7, 8, 9]。在人体,FGF21具有调节肝脏和脂肪组织的脂质代谢、糖代谢等效果[10]。肥胖、胰岛素抵抗、高脂血症患者人群中,血清FGF21水平显著升高[11, 12, 13]。上述研究表明FGF21在糖脂代谢和胰岛素抵抗等病理生理过程中具有重要作用。本研究拟探讨肥胖合并AN患者中FGF21的表达及其与胰岛素分泌特征的关系,尝试发现FGF21在AN和肥胖发生中的作用。
1 对象和方法 1.1 研究对象入组标准:(1)2013年12月至2014年12月初次来我院门诊就诊的患者;(2)年龄20~45岁;(3)符合中国人群肥胖诊断标准,体质量指数(body mass index,BMI)>28 kg/m2;(4)AN患者评分以颈部为标准,均在2分以上[14];(5)自愿签署知情同意书者。正常对照组选取就读于我院的医学研究生,年龄为24~30岁,无任何疾病史,身心健康,BMI为20~24 kg/m2。
排除标准:(1)年龄>45岁或<20岁;(2)AN患者评分≤2分;(3)心肺肾等重要脏器基础疾病;(4)既往已有明确的高血压及糖尿病、高胰岛素血症、糖耐量及空腹血糖受损等病史;(5)长期使用精神活性药物;(6)无法配合完成检查及不愿签署知情同意书者。
1.2 研究方法本研究通过中国临床试验注册中心注册(注册号:ChiCTR-OCS-12002381)。对照组(BMI<25 kg/m2)共20例;73例肥胖患者(BMI>28 kg/m2)分为单纯性肥胖组(OB组,n=35)和肥胖合并AN组(AN 组,n=38)。测量受试对象体质量(kg)、身高(cm)、BMI。采用简易体脂测量仪(HBF-358,日本欧姆龙公司)测定体脂率、内脏脂肪指数、基础代谢率和身体年龄。采集晨空腹静脉血检测血生化指标,包括总胆固醇(total cholesterol,TC)、TG、游离脂肪酸(free fat acid,FFA)、尿酸(uric acid,UA)、C-反应蛋白(C-reactive protein,CRP)等。进行75 g葡萄糖口服试验,测定胰岛素、血糖。血清FGF21采用ELISA试剂盒测定(Biovendor),批内差异<4.1%,批间差异<3.9%。 胰岛素抵抗评估指标包括:(1)空腹胰岛素水平(mU/L);(2)稳态模型评估的胰岛素抵抗指数(homeostasis model of assessment for insulin resistance,HOMA-IR),计算公式:HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5;(3)胰岛素作用指数(insulin activity index,IAI),计算公式:IAI=1/[空腹血糖(mmol/L)×空腹胰岛素(mU/L)][15]。
1.3 统计学处理应用SPSS 18.0软件包进行统计学分析。计量资料用x±s表示,计数资料用n(%)表示。采用独立样本t检验比较计量资料差异,采用χ2检验比较计数资料差异。采用Spearman相关性分析研究与FGF21相关的因素。采用单因素分析研究肥胖患者合并AN的危险因素,将P≤0.1的因素进一步纳入多因素logistic回归分析研究肥胖患者合并AN的危险因素。检验水准(α)为0.05。
2 结 果 2.1 各组一般资料及脂代谢指标的比较由表 1可见,3组在性别、年龄、身高方面差异无统计学意义;AN组和OB组患者颈围、腰围、臀围、腰臀比、体脂率、内脏脂肪指数、基础代谢、BMI、身体年龄高于对照组,差异具有统计学意义(P<0.05),但AN与OB两组间差异无统计学意义;AN组和OB组CRP、UA、TC、TG水平高于对照组(P<0.05),AN组FFA水平高于OB组及对照组(P<0.05)。
|
|
表 1 3组患者一般资料及脂代谢指标的比较 Tab 1 General data and lipid metabolism data of patients in the 3 groups |
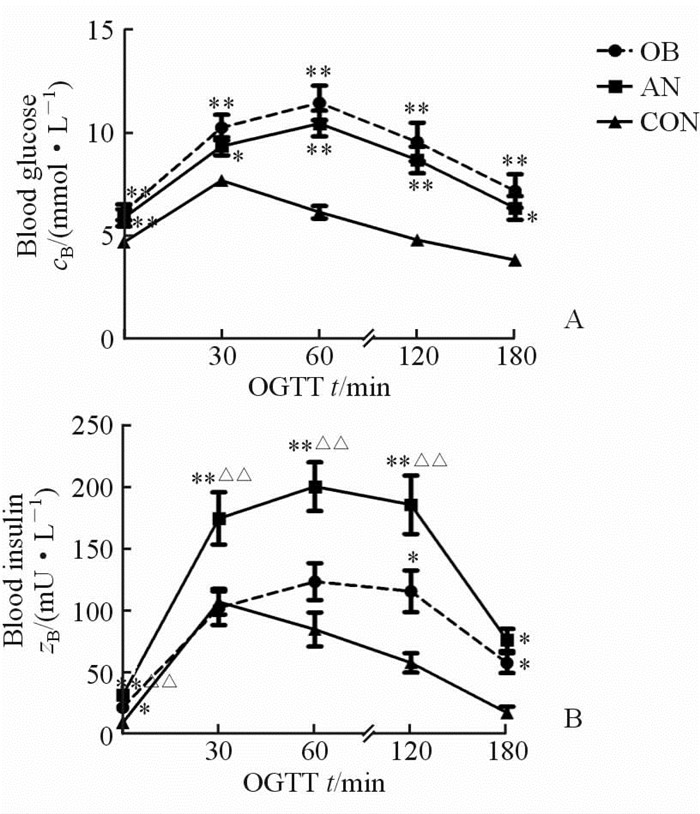
由葡萄糖-时间曲线(图 1A)可见,AN组与OB组葡萄糖水平明显高于对照组,同时伴有葡萄糖高峰延迟;而OB组血糖水平高于AN组。由胰岛素-时间曲线(图 1B)可见,葡萄糖负荷后,与对照组相比,AN组各点胰岛素水平均升高(P<0.05,P<0.01),OB组在0、120、180 min胰岛素水平升高(P<0.05);与OB组相比,AN组0、30、60、120 min胰岛素升高(P<0.01)。AN组及OB组胰岛素水平高于对照组,AN组表现为高胰岛素血症,OB组表现为胰岛素分泌高峰延迟。此外,AN组HOMA-IR(8.22±4.11)高于 OB组(5.82±3.59)和对照组(2.03±0.74),差异有统计学意义(P=0.002,P<0.001);AN组IAI(0.006 8±0.003 2)低于OB组(0.010 8±0.007 1)和对照组(0.025 3±0.010 9),差异有统计学意义(P<0.001)。
|
图 1 各组血糖(A)和胰岛素(B)水平变化 Fig 1 Change of blood glucose (A) and insulin (B) among 3 groups OB: Simple obese group (n=35); AN: Obese group with acanthosis nigricans (n=38); CON: Control group (n=20). OGTT: Oral glucose tolerance test. *P<0.05, **P<0.01 vs CON; △△P<0.01 vs OB. x±s |
AN组FGF21水平[(303.46±247.99)pg/mL]高于OB组[(147.41±104.59)pg/mL]及对照组[(62.20±63.15)pg/mL] ,差异有统计学意义(P<0.05)。
相关分析发现,在纳入了对照组后,FGF21与BMI、TC、血糖(0、30、60、120 min)、胰岛素(0、60、120、180 min)、HOMA-IR等多种因素相关(P<0.05,表 2);在排除了对照组之后,FGF21与空腹胰岛素(P=0.009)、HOMA-IR(P=0.027)正相关,与IAI和体脂率呈负相关(P<0.001,表 2)。
|
|
表 2 全体受试者及肥胖患者FGF21与其他指标的相关性分析 Tab 2 Correlation analysis of FGF21 with other variables in all participants and obesity patients |
对73例肥胖患者伴发AN的危险因素进行单因素分析,FGF21临界值采用±2s,其余指标采用我院检验科标准,结果提示FGF21升高、UA升高、CRP升高与AN发生相关(表 3)。对以上3种因素进行logistic回归分析,结果提示FGF21水平升高与UA水平升高是肥胖患者发生AN的独立危险因素(OR=13.601,95% CI: 1.507~122.763,P=0.020; OR=4.723,95% CI: 1.487~15.002,P=0.008)。
|
|
表 3 肥胖患者并发AN的危险因素(单因素分析) Tab 3 Univariate analysis of risk factor for acanthosis nigricans (AN) in obesity patients |
研究表明,FGF21能激活肝脏糖异生、促进肥胖动物的能量消耗、脂肪细胞分解、增加脂肪利用以及脂质代谢、促使FFA转化为酮体,通过减少肥胖动物模型的脂肪含量从而减轻体质量[16, 17]。FGF21通过抑制SREBP1(sterol regulatory element binding protein 1)和其他与TG合成有关基因的表达,逆转肥胖动物的肝脂肪变性,显著降低肝脏TG水平[9]。此外,FGF21还能通过激活AMPK和SIRT1上调与线粒体合成及脂肪酸氧化相关的基因[18],具有促进肝内脂肪酸氧化的作用[19]。本研究发现,AN组FGF21呈现高水平表达,与之相应的是该组FFA水平显著高于其他两组;而TG、TC水平虽然相较OB组差异无统计学意义,但是均有升高的趋势。此外相关性分析发现,FGF21水平与TC水平呈正相关。由此可推测AN患者血清FGF21水平的升高是机体内脂质水平升高的一种代偿性保护机制。
AN的发生与体内胰岛素抵抗密切相关[20, 21],是严重肥胖及代谢紊乱的皮肤标志。肥胖会加重机体各个脏器负担,尤其是胰腺组织,肥胖患者进食较正常人多,胰腺必须分泌较多的胰岛素才能维持血糖的平衡。全身脂肪组织尤其是腹部脂肪的增加会降低机体各个组织对胰岛素的敏感性,而机体作为代偿,必须更大量地分泌胰岛素来维持血糖的平衡,二者之间恶性循环,过多的血清胰岛素可通过直接及间接途径促进皮肤内成纤维细胞及角化蛋白细胞的生长与增殖,从而促进AN的发生[22]。而皮肤局部组织内升高的胰岛素能与角化蛋白细胞上的胰岛素样生长因子1(insulin-like factor-1,IGF-1)受体相互作用,直接激活细胞内的IGF-1信号通路,促进AN的发生[3]。因此,在肥胖相关的AN发生、发展中,肥胖是导致继发性胰岛素抵抗的重要始动因素,胰岛素抵抗是中间起病环节,使正常水平的血浆胰岛素不能被外周组织充分利用,继而导致AN的发生和发展,同时可以伴有脂代谢、尿酸代谢等紊乱。本研究采用空腹胰岛素、HOMA-IR和IAI来评价胰岛素抵抗程度,结果发现,AN组空腹胰岛素和HOMA-IR显著高于OB组,而IAI显著低于OB组。OB组胰岛素抵抗表现为节律改变,而AN组表现为高胰岛素血症。AN组血清胰岛素的效应低于OB组。
FGF21的升高与胰岛素抵抗关系密切[23, 24, 25]。因此,胰岛素抵抗是血清FGF21升高和AN的共同点。FGF21可以被认为是机体对胰岛素敏感性减退的一个代偿机制[11],FGF21能够保护胰岛β细胞、促进葡萄糖摄取、上调脂肪细胞中葡萄糖转运蛋白1(GLUT1)的表达,进而促进葡萄糖摄取[26]。本研究发现,AN组的FGF21与胰岛素水平最高,但平均血糖反而比OB组低,说明OB组患者胰岛素抵抗较AN组患者轻。推测在这个过程中,FGF21起到了至关重要的作用。本研究还通过相关性分析发现在肥胖患者中,血清FGF21水平与空腹胰岛素、HOMA-IR呈正相关,与IAI和体脂率呈负相关。表明OB患者更多的脂肪集中在体表,而AN患者则更多集中于内脏。单因素分析显示肥胖患者合并AN与CRP、UA、FGF21有关,进一步采用logistic回归分析AN的危险因素显示UA升高和FGF21升高是AN发生的独立危险因素。
综上所述,本研究证实FGF21水平在肥胖合并AN患者中显著升高,且与AN的发生密切相关,是AN的独立危险因素。然而本研究具有一定的局限性,样本量较小,仍有待进一步大样本研究证实本试验结论,并进一步深入研究其中可能涉及的机制。
| [1] | Jones L H, Ficca M. Is acanthosis nigricans a reliable indicator for risk of type 2 diabetes?[J]. J Sch Nurs, 2007, 23:247-251. |
| [2] | Sinha S, Schwartz R A. Juvenile acanthosis nigricans[J]. J Am Acad Dermatol, 2007, 57:502-508. |
| [3] | 张志佳, 盛春君, 杨 篷, 郑宪玲, 赵邦凤, 蒋小婉,等. 青少年肥胖合并黑棘皮病患者中胰岛素抵抗及脂肪因子水平的探讨[J]. 中华内分泌代谢杂志,2013, 29:664-668. |
| [4] | Adams A C, Kharitonenkov A. FGF21: the center of a transcriptional nexus in metabolic regulation[J]. Curr Diabetes Rev, 2012, 8:285-293. |
| [5] | Dushay J, Chui P C, Gopalakrishnan G S, Varela-Rey M, Crawley M, Fisher F M, et al. Increased fibroblast growth factor 21 in obesity and nonalcoholic fatty liver disease[J]. Gastroenterology, 2010, 139:456-463. |
| [6] | Gao M, Ma Y, Cui R, Liu D. Hydrodynamic delivery of FGF21 gene alleviates obesity and fatty liver in mice fed a high-fat diet[J]. J Control Release, 2014, 185:1-11. |
| [7] | Kharitonenkov A, Shiyanova T L, Koester A, Ford A M, Micanovic R, Galbreath E J, et al. FGF-21 as a novel metabolic regulator[J]. J Clin Invest, 2005, 115:1627-1635. |
| [8] | Kharitonenkov A, Wroblewski V J, Koester A, Chen Y F, Clutinger C K, Tigno X T, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology,2007,148:774-781. |
| [9] | Xu J, Lloyd D J, Hale C, Stanislaus S, Chen M, Sivits G, et al. Fibroblast growth factor 21 reverses hepatic steatosis, increases energy expenditure, and improves insulin sensitivity in diet-induced obese mice[J]. Diabetes,2009, 58:250-259. |
| [10] | Chow W S, Xu A, Woo Y C, Tso A W, Cheung S C, Fong C H, et al. Serum fibroblast growth factor-21 levels are associated with carotid atherosclerosis independent of established cardiovascular risk factors[J]. Arterioscler Thromb Vasc Biol, 2013, 33:2454-2459. |
| [11] | Chen W W, Li L, Yang G Y, Li K, Qi X Y, Zhu W, et al. Circulating FGF-21 levels in normal subjects and in newly diagnose patients with type 2 diabetes mellitus[J]. Exp Clin Endocrinol Diabetes, 2008, 116:65-68. |
| [12] | Zhang X, Yeung D C, Karpisek M, Stejskal D, Zhou Z G, Liu F, et al. Serum FGF21 levels are increased in obesity and are independently associated with the metabolic syndrome in humans[J]. Diabetes, 2008, 57:1246-1253. |
| [13] | Chavez A O, Molina-Carrion M, Abdul-Ghani M A, Folli F, Defronzo R A, Tripathy D. Circulating fibroblast growth factor-21 is elevated in impaired glucose tolerance and type 2 diabetes and correlates with muscle and hepatic insulin resistance[J]. Diabetes Care, 2009, 32:1542-1546. |
| [14] | Burke J P, Hale D E, Hazuda H P, Stern M P. A quantitative scale of acanthosis nigricans[J]. Diabetes Care, 1999, 22:1655-1659. |
| [15] | 周 健,贾伟平. 应用口服葡萄糖耐量试验评估胰岛B 细胞功能及胰岛素敏感性的研究进展[J]. 上海医学,2008, 31:897-900. |
| [16] | Coskun T, Bina H A, Schneider M A, Dunbar J D, Hu C C, Chen Y, et al. Fibroblast growth factor 21 corrects obesity in mice[J]. Endocrinology, 2008, 149:6018-6027. |
| [17] | Badman M K, Pissios P, Kennedy A R, Koukos G, Flier J S, Maratos-Flier E. Hepatic fibroblast growth factor 21 is regulated by PPARα and is a key mediator of hepatic lipid metabolism in ketotic states[J]. Cell Metab, 2007, 5:426-437. |
| [18] | Chau M D, Gao J, Yang Q, Wu Z, Gromada J. Fibroblast growth factor 21 regulates energy metabolism by activating the AMPK-SIRT1-PGC-1α pathway[J]. Proc Natl Acad Sci U S A, 2010, 107:12553-12558 . |
| [19] | Lundåsen T, Hunt M C, Nilsson L M, Sanyal S, Angelin B, Alexson S E, et al. PPARα is a key regulator of hepatic FGF21[J]. Biochem Biophys Res Commun, 2007, 360:437-440. |
| [20] | Zaridoust A, Rabbani A, Sayarifard F, Thiel C T, Rezaei N. Acanthosis nigricans, abnormal facial appearance and dentition in an insulin resistance syndrome[J]. Iran J Pediatr, 2013, 23:363-365. |
| [21] | Kluczynik C E, Mariz L S, Souza L C, Solano G B, Albuquerque F C, Medeiros C C. Acanthosis nigricans and insulin resistance in overweight children and adolescents[J]. An Bras Dermatol, 2012, 87:531-537. |
| [22] | Buzási K, Sápi Z, Jermendy G. Acanthosis nigricans as a local cutaneous side effect of repeated human insulin injections[J]. Diabetes Res Clin Pract, 2011, 94:e34-e36. |
| [23] | Hale C, Chen M M, Stanislaus S, Chinookoswong N, Hager T, Wang M, et al. Lack of overt FGF21 resistance in two mouse models of obesity and insulin resistance[J]. Endocrinology, 2012, 153:69-80. |
| [24] | Alisi A, Panera N, Nobili V. Commentary: FGF21 holds promises for treating obesity-related insulin resistance and hepatosteatosis[J]. Endocrinology, 2014, 155:343-346. |
| [25] | Lin Z, Tian H, Lam K S, Lin S, Hoo R C, Konishi M, et al. Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice[J]. Cell Metab, 2013, 17:779-789. |
| [26] | Ogawa Y, Kurosu H, Yamamoto M, Nandi A, Rosenblatt K P, Goetz R, et al. BetaKlotho is required for metabolic activity of fibroblast growth factor 21[J]. Proc Natl Acad Sci U S A, 2007, 104:7432-7437. |
 2016, Vol. 37
2016, Vol. 37


