2. 第二军医大学东方肝胆外科医院胆道一科, 上海 200438;
3. 第二军医大学长海医院检验科, 上海 200433
2. Derpartment of Biliary Tract Surgery (Ⅰ), Eastern Hepatobiliary Surgery Hospital, Second Military Medical University, Shanghai 200438, China;
3. Department of Clinical Diagnosis, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
菊科艾属植物奇蒿(Artemisia anomala S. Moore)为多年生草本植物,有根和茎,全草呈现黄酮苷反应[1]。《中国植物志》记载奇蒿在我国有1个种,1个变种,主要分布在江苏、浙江、江西、福建等地,又称为南刘寄奴。目前作为刘寄奴用药的植物有9个科,32个种,经本草考证奇蒿为刘寄奴正品应用[2]。中药奇蒿具有解暑消食、活血散瘀、敛疮消肿等功效[3],可用于治疗跌打损伤、疮痈肿痛、淤积不化和血淋血痢等。现代药理研究表示奇蒿具有抗炎[4, 5]、抗缺氧[6]、保肝、抗大鼠血小板凝聚等[7]作用,临床上常采用奇蒿治疗痢疾[8]和泌尿系感染[9]等,且奇蒿对单纯疱疹病毒(HSV)也具有良好的治疗效果[10]。
鉴于奇蒿的临床应用,相关学者对奇蒿的有效抗菌活性成分展开了研究。荣远明等[11]采用奇蒿全草入药验证了奇蒿对急性细菌性痢疾的疗效。本研究前期对奇蒿进行了系统的提取分离,完成了各提取部位体外抗菌实验[12]。现拟进一步完成抗菌有效单体的分离与鉴定,为深入研究有效单体的整体药效学实验提供物质基础。
1 材 料 1.1 仪器多功能渗漉提取器(常州市新祥天然产物分离设备有限公司); Agilent 1100系列高效液相色谱仪(安捷伦科技公司);Agilent 6220 高分辨飞行时间质谱仪(安捷伦科技公司),配套有标准电喷雾离子源(ESI),分析软件分别为 MassHunter Data Acquisition workstation 和 Qualiative Analysis workstation;电热恒温培养箱DHP-9272型(上海益恒试验仪器有限公司);DJ-04 粉碎机(上海淀久公司)。
1.2 药品与试剂中药奇蒿道地药材采购自浙江临安(批号20140517)。80%乙醇、石油醚(PET)、氯仿、乙酸乙酯等试剂均为分析纯(上海市第一试剂厂);羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC-Na,上海赫里斯特化工有限公司)。标准型金黄色葡萄球菌(SSA-ATCC25923,SSA-ATCC29213),标准型大肠埃希氏菌(SEC-ATCC25922),标准型铜绿假单胞菌(SPA-ATCC27853),临床型无乳链球菌(CSA-03598276),临床型福氏志贺菌(CSF-03475491),临床型鼠伤寒沙门菌(CST-5002324172),水解络蛋白(mueller-hinton,M-H)琼脂培养基、M-H培养液(型号: CMO337,厂家:OXOID,英国),血平板(型号:CMO331,厂家:OXOID,英国)。细菌SSA-ATCC25923、SSA-ATCC29213、SEC-ATCC25922和SPA-ATCC27853均采购于温州市康泰生物科技有限公司。细菌CSA-03598276、CSF-03475491和CST-5002324172为第二军医大学长海医院检验科在不同时期从临床标本中分离获得的致病菌株。
2 方法和结果 2.1 奇蒿氯仿、乙酸乙酯部位分离参照文献[12]方法逐步提取分离得到奇蒿乙酸乙酯和氯仿部位提取物的各组分,如图 1。分离流分通过薄层层析(thin layer chromatography,TLC)点样,合并含相同成分的提取流分,氯仿极性部位和乙酸乙酯极性部位各得到26个合并样品,氯仿部位合并得到样品为A1~A26;乙酸乙酯部位合并得到样品为B1~B26。以上样品均经过旋转蒸发仪浓缩成浸膏状,再通过真空离心蒸发浓缩器制备成干粉状物(部分仍为浸膏状)。所得样品均保存于1.5 mL的EP管中,60Co灭菌待用。
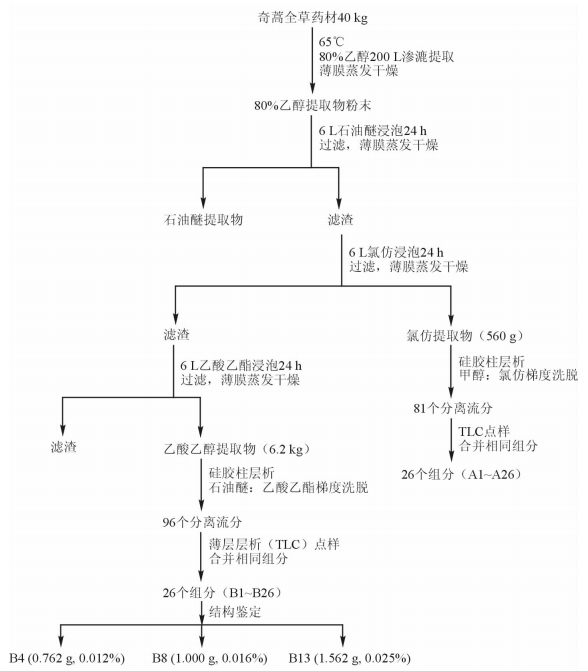
|
图 1 奇蒿的氯仿和乙酸乙酯部位提取流程 |
称取奇蒿的氯仿提取物及乙酸乙酯提取物各分离流分样本10 mg,分别加入助溶剂CMC-Na 1 mg,采用灭菌蒸馏水溶解并加至1 mL配制成质量浓度为10 mg/mL的药液。将加有50 μL药液的圆纸片放在含标准量细菌接种物的M-H琼脂板上,置于35℃培养箱中培养18 h,测量含药纸片周围的抑菌圈大小,以此判断抗菌作用的强弱。设置灭菌蒸馏水及助溶剂空白对照组(取助溶剂CMC-Na 1 mg,采用灭菌蒸馏水溶解并加至1 mL),筛选出纸片扩散法中抑菌圈≥9 mm(纸片直径6 mm)的抗菌流分样品,以待进一步测定样本的最小杀菌浓度(minimal bactericidal concentration,MBC)。
氯仿提取物和乙酸乙酯提取物分离得到的各样本与细菌配比均进行3次平行实验,取平均值,具有活性的样本抑菌结果见表 1,无明显抑菌活性的样本和阴性对照组均未列入表中。
|
|
表 1 奇蒿氯仿、乙酸乙酯提取物各分离样品的纸片扩散法抑菌结果 |
接种菌液制备:用接种环挑取3~5个形态相似的待检菌落,将菌落接种于4~5 mL的M-H肉汤中,于35℃培养箱中孵育2~6 h。取增菌后的对数生长期菌液用M-H肉汤校正浓度至0.5麦氏比浊标准,再将菌悬液用M-H肉汤进行1∶100稀释后备用。
不同浓度抗菌药物的制备和菌液接种:取无菌试管9支排列一排,第1管加入M-H肉汤1.6 mL,其余每管中加入M-H肉汤1 mL,在第1管中加入10 mg/mL的抗菌原药液0.4 mL混匀,然后从第1管中吸取1 mL溶液至第2管,混匀后再从第2管中吸取1 mL至第3管,如此依次连续倍比稀释至第7管,并从第7管中吸取1 mL弃之,第8管为不含药物的阳性对照管,第9管为无菌生长的阴性对照管。此时各管药物浓度依次为2、1、0.5、0.25、0.125、0.062 5、0.031 25 mg/mL。然后向各管中加入上述制备好的接种菌液各1 mL,使每管的最终菌液细菌形成单位为5×105 CFU/mL。第1管至第7管药物浓度分别为1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 62 mg/mL。将接种好的各个浓度药液的试管密封,置35℃孵箱中孵育16~20 h。将实验组样本、阳性对照组样本及阴性对照组样本均放入37℃培养箱中培养48 h,从每一个含有不同浓度药物的菌液试管中取100 μL菌悬液,分别加入琼脂平板上,放37℃培养箱中培养48 h,观察细菌生长的菌落数,以无菌落形成的药液最小浓度为MBC。纸片扩散法实验中抑菌圈直径≥9 mm的样品(A9、A12、B2、B4、B8、B13、B17、B18 )与敏感菌配对,测定各配对样本MBC,其中,A20、B1、B3、B6、B9因样品量过少,未进行进一步的MBC测试。结果见表 2。
|
|
表 2 奇蒿氯仿、乙酸乙酯提取物中活性抗菌分离样品的常量肉汤稀释法MBC结果 |
根据以上体外抗菌活性筛选,样品组分A9、A12、B2、B4、B8、B13、B17、B18均表现出一定的抗菌活性,通过HPLC-TOF-MS总离子流色谱图发现纯度较高的样品流分为B4、B8、B13,且根据总离子图中信号峰质谱数据判断可能的化合物并与之比较,如图 2。通过TLC法比较化合物B4、B8、B13与推测可能对照品的Rf值,见图 3,3个化合物与对照品的Rf 值基本一致。结合1HNMR、13CNMR数据,得到化合物B4、B8、B13分别为单体化合物芹菜素、异泽兰黄素、咖啡酸,其结构式见图 4。
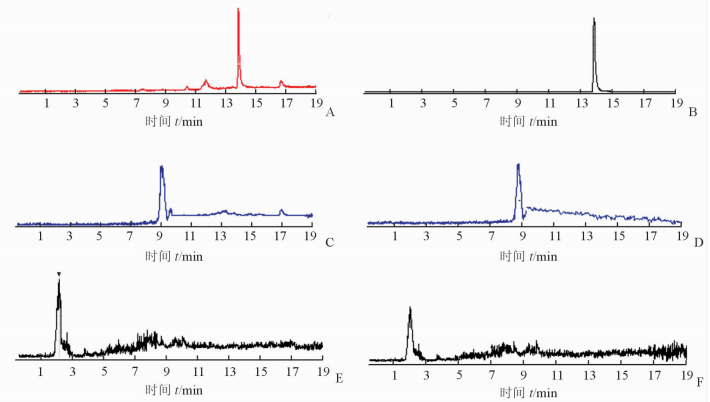
|
图 2 化合物B4(A)、B8(C)、B13(E)与对照品芹菜素(B)、异泽兰黄素(D)、咖啡酸(F)的总离子流图谱 |

|
图 3 化合物B4(A)、B8(B)、B13(C)与对照品芹菜素(A)、异泽兰黄素(B)、咖啡酸(C)的薄层层析(TLC)图 |
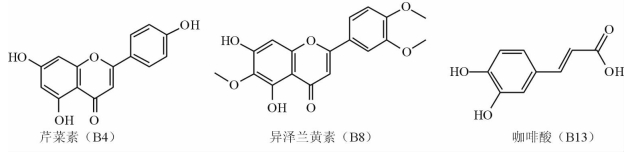
|
图 4 3个单体化合物的结构式 |
采用高效液相色谱法测定奇蒿乙酸乙酯提取部位中芹菜素、异泽兰黄素和咖啡酸的相对含量。色谱条件如下:美国Waters Atlantis dC18色谱柱(4.6 mm ×250 mm,5 μm),流动相为乙腈(A)和水(B),梯度洗脱;A相体积分数随时间的变化为15%~20%(0~10 min),20%~30%(10~15 min),30%~40%(15~30 min),40%~100%(30~40 min);流速1.0 mL/min;检测波长325 nm;柱温25℃;进样量5 μL。色谱图见图 5,其中,保留时间t=9.631 min的信号峰1为咖啡酸,t=29.317 min的信号峰2为芹菜素,t=36.161 min的信号峰3为异泽兰黄素。该3个化合物与其他化合物信号峰均基线分离。根据峰面积归一化法计算得到总吸收峰面积A=225 045.3,咖啡酸、芹菜素、异泽兰黄素的峰面积分别为3 152.5、540.9、35.6,因此3个化合物的相对含量分别为1.401%、0.24%、0.016%。
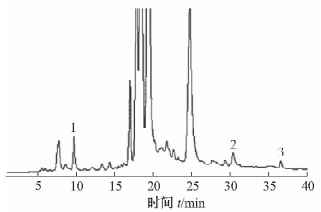
|
图 5 奇蒿乙酸乙酯提取部位的高效液相色谱图 1:咖啡酸; 2:芹菜素; 3:异泽兰黄素 |
基于前期奇蒿提取物体外抗菌活性的实验研究结果[12],本研究对奇蒿的抗菌有效部位展开进一步分析,结果显示组分A9、A12、B2、B4、B8、B13、B17、B18对临床致病菌均有显著活性,其中A9、A12为氯仿部位分离组分,其余均为乙酸乙酯部位分离组分。对以上活性组分进行纯度检查和结构鉴定,发现组分B4、B8、B13为单体化合物,分别为芹菜素、异泽兰黄素、咖啡酸;其余组分均含杂质,有待后续进一步分离纯化。本研究采用常规分离手段初步探索了奇蒿活性部位的抗菌单体化合物,研究结果表明抗菌活性成分多集中于乙酸乙酯提取部位,该研究结果为本次实验的重大突破,为深入研究奇蒿的抗菌药理机制指明方向。在后续的研究中可深入研究奇蒿乙酸乙酯部位的化学成分,以期得到更多单体化合物。
3.2 活性结果分析本研究采用纸片扩散法和肉汤稀释法对分离得到的全部组分进行了抗菌实验,此体外抗菌实验方法常规可靠,是目前体外抗菌活性筛选的常用方法。本次实验结果显示,奇蒿氯仿、乙酸乙酯部位的分离组分对标准型大肠埃希氏菌SEC-ATCC25922、标准型铜绿假单胞菌SPA-ATCC27853均未表现出明显的抗菌活性。前期研究[12]提示奇蒿氯仿提取物部位对SEC-ATCC25922的MBC为6.25 mg/mL,前期研究所采用的抗菌活性研究方法与本实验抗菌活性测试方法相同,表明本次试验未能分析获得奇蒿中抗大肠埃希氏菌的活性化合物,需要在后续研究中对奇蒿氯仿提取部位中含杂质的组分或氯仿提取部位进一步分离纯化,以寻找抗SEC-ATCC25922的活性成分。分离组分中A9、A12、B2、B17、B18对金黄色葡萄球菌、无乳链球菌、福氏志贺菌和鼠伤寒沙门菌具有不同程度的抗菌活性,但未能确定其中发挥作用的具体成分,需要进一步去除杂质,对得到的单体化合物通过化学方法和波谱解析确定其结构。
3.3 芹菜素和异泽兰黄素抗菌分析奇蒿氯仿、乙酸乙酯中多个分离组分对金黄色葡萄球菌均具有显著抗菌活性,以乙酸乙酯部位中黄酮类化合物异泽兰黄素(B8)的活性最强,其MBC为0.062 5 mg/mL,黄酮类化合物芹菜素(B4)对金黄色葡萄球菌也有显著杀菌活性。本课题组拟根据这一方向,进一步研究奇蒿中其他黄酮类化合物对金黄色葡萄球菌的杀菌作用,同时通过整体药效学研究,以期发现黄酮类化合物如异泽兰黄素、芹菜素对金黄色葡萄球菌的抗菌规律和杀菌机制。本研究首次报道了黄酮类化合物异泽兰黄素的抗菌活性,拟在下一步研究中对其进行体内药代动力学研究。
3.4 咖啡酸抗菌分析咖啡酸是目前研究较为广泛的化合物,文献[13]报道咖啡酸具有抗菌、抗病毒、降糖、降脂、调节免疫等功效,可用于治疗多种疾病。本次研究发现咖啡酸对临床常见的无乳链球菌、福氏志贺菌以及鼠伤寒沙门菌具有显著的抗菌活性,其MBC分别为0.25、0.125、0.125 mg/mL,为临床应用咖啡酸治疗相关细菌感染提供数据指导。咖啡酸也是目前药物化学合成的热门先导化合物之一,本研究为咖啡酸合成应用提供又一重要原料来源。
| [1] | 黄雅萍, 王鸿燕, 叶陈奎, 陈式挺, 李建法. 正交试验优化六月霜中总黄酮的提取工艺[J]. 天津药学, 2010, 22: 3-5. |
| [2] | 杜华洲, 罗集鹏. 刘寄奴的本草考证及紫外光谱法鉴别[J]. 中药材, 2004, 27: 638-640. |
| [3] | 吴巧凤. 六月霜中总黄酮和元素含量的分析[J]. 广东微量元素科学, 2000, 15: 63-65. |
| [4] | 潘一峰, 章丹丹, 凌 霜, 张洪平, 卞化石, 卞 卡. 南刘寄奴总黄酮体外抗血管炎症的机制分析[J]. 中国中药杂志, 2012, 37: 2597-2602. |
| [5] | Tan X, Wang Y L, Yang X L, Zhang D D. Ethyl acetate extract of artemisia anomala S. Moore displays potent anti-inflammatory effect[J]. Evid complement alternat med,2014, 2014: 681352. |
| [6] | 谭蔚锋, 郭家红, 邢 新, 年 华, 秦路平. 奇蒿80%乙醇提取物对大鼠深Ⅱ度烧伤创面愈合的影响[J]. 中医药学刊, 2004, 22: 840-842. |
| [7] | 张光霁. 六月霜 (奇蒿) 的研究进展[J]. 浙江中医学院学报, 2003, 27:83-86. |
| [8] | 修国珍, 何春招. 奇蒿乳兔汤治疗婴幼儿腹泻86例[J]. 福建中医药, 1997, 28: 7. |
| [9] | 李 华. 刘寄奴应用心得[J]. 浙江中医杂志, 1989, 6: 274-275. |
| [10] | 郑民实. 472种中草药抗单纯疱疹病毒的实验研究[J]. 中西医结合杂志, 1990, 10: 39-41. |
| [11] | 荣远明, 叶琦莉, 何善明. 用中药刘寄奴治疗急性细菌性痢疾34例[J]. 上海中医药杂志, 1983, 1:21. |
| [12] | 谭蔚锋,王 靖,邢 新, 秦路平.中药奇蒿提取物体外抗菌活性的实验研究[J]. 药学实践杂志,2010,28: 101-104. |
| [13] | 曾 方, 陈友宝, 夏春年,钟光祥. 咖啡酸衍生物的合成方法及其生物活性研究进展[J]. 浙江化工, 2012, 43:24-28. |
 2016, Vol. 37
2016, Vol. 37


