2. 北京军区卫生干部训练中心, 北京 102300
2. Health Cadre Training Center, PLA Beijing Military Area Command, Beijing 102300, China
黑素瘤(malignant melanoma,MM)是由黑素细胞产生的恶性肿瘤,具有恶性程度高、转移发生早、预后效果差、死亡率高等特点,目前临床上主要采用化疗、生物抗体治疗等手段,但这些治疗方法存在用药顺应性差、组织选择性差、毒性反应大及耐药性等问题[1]。因此近年来基因治疗逐渐成为恶性黑素瘤治疗领域的研究热点[2]。研究表明,黑素瘤的发生和发展与p53基因的缺陷有关[3]。miR-34a作为miR-34家族的一员,在p53 的调控通路中至关重要,miR-34a 的转录受p53 蛋白的调节并对p53的活性产生正反馈调节作用[4, 5, 6]。同时miR-34a能在转录水平抑制SIRT1基因的表达,从而抑制黑素瘤细胞的生长[7]。这提示我们,利用合理的基因载体将miR-34a递送至黑素瘤组织,有望为治疗恶性黑素瘤提供一种新的思路和方法。
聚酰胺-胺型大分子(PAMAM)作为当前研究较为广泛的非病毒载体材料,其表面带有大量正电荷,可以与带有负电荷的miRNA有效结合,在药物载体领域有着较为广泛的应用[8]。此外,与病毒载体相比,PAMAM具有的高稳定性、无免疫原性、靶向特异性、易被修饰等优点在基因转染载体方面也具有良好的应用前景。因此,本研究使用PAMAM包裹可以表达miR-34a的质粒sh-miR-34a,制备纳米复合物PAMAM/sh-miR-34a,体外考察其对人黑素瘤细胞A375增殖、凋亡、侵袭和转移能力的影响,探讨miR-34a用于治疗人黑素瘤的应用前景。
1 材料和方法 1.1 主要仪器和试剂Leica倒置荧光显微镜(Leica,德国);FACSCalibur流式细胞仪(BD,美国);sh-miR-34a和sh-miR-NC质粒(英为信公司,中国);ECM GEL(Sigma,美国);Cy3 Label IT® TrackerTM(Mirus Bio LLC,美国);G5 PAMAM甲醇溶液(体积分数5%),Hanging Cell Culture Inserts (Millipore,瑞士);Z90激光粒度测定仪(Malvern,英国)。
1.2 A375人黑素瘤细胞原代培养将A375人黑素瘤细胞株(中国科学院细胞库)置于含10%胎牛血清(FBS)的RPMI 1640培养基中,于37℃、5%CO2孵箱中培养,每2 d换液1次,当细胞生长至80%融合状态时用于实验。
1.3 PAMAM/sh-miR-34a复合物的制备及粒径和zeta电位测定PAMAM与sh-miR-34a溶液按照PAMAM与DNA的氮磷比(N/P) 1∶1、5∶1、10∶1、15∶1、20∶1、25∶1漩涡混合10 s,制得PAMAM/sh-miR-34a复合物。不同N/P值的PAMAM/sh-miR-34a复合物的粒径和zeta电位通过Z90激光粒度测定仪进行测定。
1.4 复合物凝胶电泳阻滞分析采用琼脂糖凝胶电泳实验检测N/P为0、0.5∶1、1∶1、5∶1、10∶1、15∶1、20∶1时,PAMAM对sh-miR-34a的包裹情况。条件为1%(质量体积分数)琼脂糖凝胶(含0.5%EB)、1×TAE缓冲液、电压100 V、电泳时间60 min,紫外投射仪(上海复日科技有限公司)观察、拍照。
1.5 荧光显微镜观察A375细胞对PAMAM/sh-miR-34a复合物的摄取A375人黑素瘤细胞以1×105/孔接种于48孔培养板中,培养24 h,待细胞融合度为70%时进行实验。每孔加入0.5 μg sh-miR-34a-Cy3,按照N/P为0、5∶1、10∶1、15∶1、20∶1、25∶1制备载基因复合物。实验前弃去原有培养基,更换为无血清的RPMI 1640培养基并加入制得的复合物,孵育3 h后采用荧光显微镜观察红色荧光并拍照,激发波长为548 nm,发射波长为562 nm。
1.6 流式细胞术检测A375细胞对PAMAM/sh-miR-34a复合物的摄取A375人黑素瘤细胞以4×105/孔接种于12孔培养板中,培养24 h,待细胞融合度为70%时进行实验。按照Cy3 Label IT®TrackerTM试剂盒的操作方法标记sh-miR-34a,以1.3 μg sh-miR-34a-Cy3/孔制备复合物。弃去原有培养基并加入新鲜无血清的 RPMI 1640培养基,加入制备的复合物,37℃、5%CO2条件下孵育3 h,弃去培养基,PBS洗3次,胰酶消化后离心并用PBS重悬收集细胞。以空白细胞为阴性对照。使用流式细胞仪检测Cy3的阳性率。
1.7 CCK8 法检测PAMAM/sh-miR-34a纳米复合物抗恶性黑素瘤细胞增殖效果以0.5 μg质粒/孔、N/P值为20制备PAMAM/sh-miR-34a纳米复合物。使用不表达任何miRNA序列的sh-miR-NC与PAMAM结合形成的纳米复合物作为对照。A375人黑素瘤细胞以1×104/孔接种于96孔培养板中,培养24 h。弃去原有培养基,取上述纳米复合物以100 μL/孔加至96孔培养板,37℃、5% CO2条件下培养3 h,吸去纳米复合物。每孔加入100 μL含10%FBS的RPMI 1640培养基,继续培养至24、48、72 h。取出培养板,每孔加入10 μL CCK8试剂,37℃、5% CO2继续培养3 h。结束后,取出培养板并震荡10 min,酶标仪测定各孔在450 nm处的光密度(D)值。以未经纳米复合物处理的细胞孔为对照孔,其细胞存活率设为100%,以未接种细胞的孔为空白孔。细胞存活率(%)=[1-(D实验组-D空白组)/(D对照组-D空白组)]×100%。
1.8 PAMAM/sh-miR-34a复合物抑制A375细胞迁移和侵袭能力考察采用Transwell小室检测。取生长状态良好的A375细胞,按照8×105/孔接种于6孔培养板中,培养24 h,待细胞融合度为70%时进行实验;利用不表达任何miRNA序列的sh-miR-NC与PAMAM结合形成的纳米复合物作为对照。实验时更换为无血清的培养基,按照4 μg质粒/孔、N/P值为20制备PAMAM/sh-miR-34a复合物并用PBS稀释至400 μL加至6孔板中。转染3 h后更换为含10%FBS的RPMI 1640培养基继续培养24 h。胰酶消化,使用无血清的RPMI 1640培养基调整细胞密度为5×104/孔。提前1 h从-20℃冰箱中取出基质胶并于4℃冰箱中解冻,按照基质胶∶无血清培养基=1∶7的比例稀释并铺于Transwell上室,每个上室加入100 μL 细胞悬液,下室加入600 μL含10%FBS的RPMI 1640培养基。培养24 h后用4%甲醇固定15 min,用棉签擦去上室细胞,再用0.1%结晶紫染色15 min后,置于显微镜下观察并拍照,随机选取4个视野(×100)进行细胞计数,计算平均值,实验重复3次。
1.9 蛋白质印迹法检测PAMAM/sh-miR-34a纳米复合物对A375细胞中相关蛋白的抑制恶性黑素瘤A375细胞同1.2项下培养,利用不表达任何miRNA序列的sh-miR-NC与PAMAM结合形成的纳米复合物作为对照。以每孔1.5 μg质粒,N/P值为20分别制备PAMAM/sh-miR-34a和PAMAM/sh-miR-NC纳米复合物并加至6孔培养板,加入含10% FBS的RPMI 1640培养基使终体积为2 000 μL,37℃、5% CO2培养3 h,吸去复合物。按照2 000 μL/孔更换含10% FBS的RPMI 1640培养基,继续培养至48 h。吸去培养基,用预冷的pH 7.4的PBS清洗2次,每孔加入200 μL RIPA裂解液于冰面上裂解15 min,2 600×g、4℃ 离心30 min,吸取上清液。采用BCA法进行蛋白定量,取等量蛋白 (20 μg) 进行SDS-PAGE电泳,恒压100 V 电泳约15 min,150 V 电泳1 h;然后在250 mA 的条件下电转膜1.5 h,将蛋白转移至PVDF膜上;用5%脱脂奶粉室温封闭1 h,分别加入相应的一抗(pAKt、pRb、pERK1/2抗体的稀释度均为1∶200;β-actin的稀释度为1∶5 000) 4℃孵育过夜;加入相对应的HRP 标记的二抗 (均为1∶1 000稀释)室温下孵育2 h;0.1%Triton X-100/PBS于室温摇床洗膜3 次,每次20 min。PVDF膜经ECL发光液处理后压片、曝光15 min、拍照。
1.10 统计学处理采用SPSS 18.0分析软件进行独立样本t检验,数据以x±s表示,检验水准(α)为0.05。
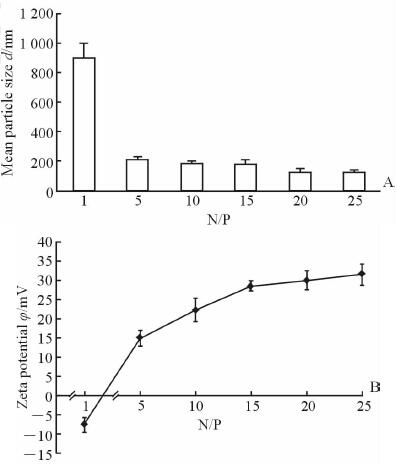
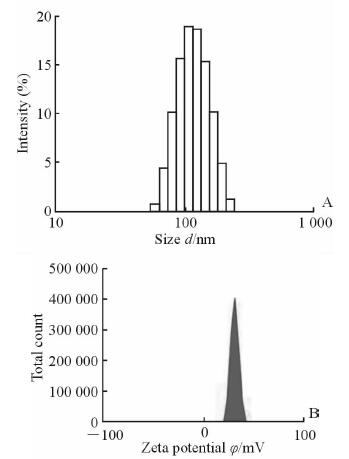
2 结 果 2.1 不同N/P值的PAMAM/sh-miR-34a复合物粒径和zeta电位考察PAMAM和sh-miR-34a形成的复合物粒径随着N/P值的增大而减小(图 1A),zeta电位随着N/P值的增大由带负电变为带正电(图 1B),说明随着N/P值的增大,载体所带电荷增加,形成的复合物更加紧密。N/P=20时形成的纳米复合物的粒径分布均匀(图 2A),电位适中(图 2B)。
|
图 1 不同N/P值时PAMAM/sh-miR-34a复合物粒径(A)和电位(B) Fig 1 Sizes (A) and zeta potentials (B) of AMAM/sh-miR-34a complexes at various N/P ratios PAMAM: Polyamidoamine dendrimers. n=3,x±s |
|
图 2 N/P值为20时PAMAM/sh-miR-34a复合物粒径(A)和电位(B) Fig 2 Sizes (A) and zeta potential (B) of PAMAM/sh-miR-34a complexes when N/P ratio was 20 PAMAM: Polyamidoamine dendrimers |
复合物的N/P值在0.5~1时,sh-miR-34a不能被PAMAM完全包裹,在紫外线照射下可以看到清晰的条带。随着N/P值的升高,sh-miR-34a可以完全被PAMAM包裹,不能随着电场迁移,在紫外灯下未见条带检出(图 3)。

|
图 3 不同N/P值时PAMAM/sh-miR-34a复合物琼脂糖凝胶电泳分析结果 Fig 3 Results of agarose gel electrophoresis of PAMAM/sh-miR-34a complexes at various N/P ratios PAMAM: Polyamidoamine dendrimers |
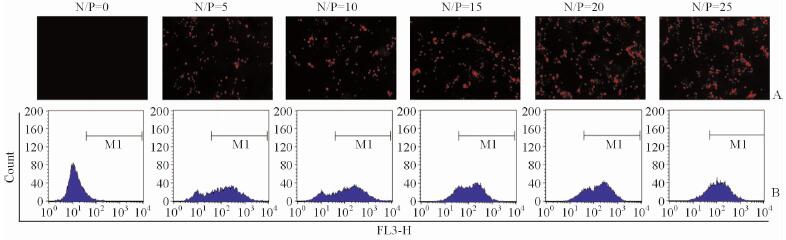
荧光显微镜和流式细胞仪的检测结果(图 4、5)均显示,随着N/P值的增加,A375对PAMAM/sh-miR-34a-Cy3的摄取也增加。在N/P=20时,细胞对PAMAM/sh-miR-34a-Cy3的摄取达最高。
|
图 4 荧光显微镜(A)和流式细胞仪(B)检测A375细胞对不同N/P值的PAMAM/sh-miR-34a-Cy3复合物摄取 Fig 4 Uptake of PAMAM/sh-miR-34a-Cy3 by A375 cells under fluorescence microscopy (A) and by flow cytometry (B) at various N/P ratios PAMAM: Polyamidoamine dendrimers. Original magnification: ×200 (A) |

|
图 5 不同N/P值时A375细胞对PAMAM/sh-miR-34a-Cy3复合物的摄取 Fig 5 Uptake of PAMAM/sh-miR-34a-Cy3 by A375 cells using flow cytometry at various N/P ratios PAMAM: Polyamidoamine dendrimers. *P<0.05. n=3,x±s |
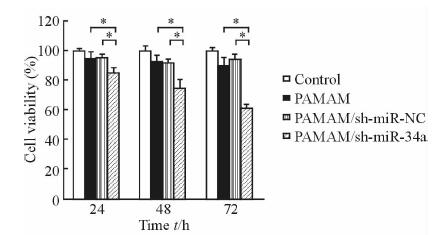
由图 6可以看出,转染72 h后,PAMAM/sh-miR-34a组A375细胞的增殖受到抑制,抑制率为38.8%,而PAMAM/sh-miR-NC组和PAMAM组A375的抑制率分别为6.2%和9.8%,这是由于PAMAM本身为阳离子聚合物,末端氨基带有的正电荷使其具有潜在毒性。PAMAM/sh-miR-34a组和PAMAM/sh-miR-NC组以及PAMAM组差异均有统计学意义(P<0.05)。
|
图 6 PAMAM/sh-miR-34a对A375细胞的抑制作用 Fig 6 Inhibitory effect of PAMAM/sh-miR-34a against A375 cells PAMAM: Polyamidoamine dendrimers. *P<0.05. n=3,x±s |
Transwell迁移实验显示,转染可以表达sh-miR-34a和sh-miR-NC的质粒后,PAMAM/sh-miR-34a组发生迁移的细胞数目为119.8±21.3,PAMAM/sh-miR-NC组为258.5±10.2,两组间差异有统计学意义(P<0.05)。
2.6 PAMAM/sh-miR-34a复合物抑制A375细胞侵袭Transwell侵袭实验显示,转染可以表达miR-34a的质粒和阴性对照后,PAMAM/sh-miR-34a组发生侵袭的A375细胞数目为72.2±5.7,PAMAM/sh-miR-NC组为164.9±15.2,两组间差异有统计学意义(P<0.05)。
2.7 PAMAM/sh-miR-34a复合物对A375细胞中pAkt、pRb、pERK1/2蛋白抑制效果PAMAM/sh-miR-34a复合物与A375细胞作用48 h后,A375细胞中pAkt、pRb、pERK1/2蛋白的表达较PAMAM/sh-miR-NC组降低。说明miR-34a起到了抑制恶性黑素瘤A375细胞中pAkt、pRb、pERK1/2蛋白表达的作用(图 7)。

|
图 7 PAMAM/sh-miR-34a对A375细胞中pAkt、pRb、pERK1/2蛋白的抑制效果 Fig 7 Inhibitory effect of PAMAM/sh-miR-34a and PAMAM/sh-miR-NC aginst expression of pAkt,pRb and pERK1/2 in A375 cells at 48 h post-transfection PAMAM: Polyamidoamine dendrimers |
黑素瘤是皮肤常见的恶性肿瘤,转移复发率较高。黑素瘤的发病原因尚不明确,目前认为与紫外线照射、化学致癌物以及病毒侵入等有关。但无论是化疗还是生物治疗都存在易产生耐药性以及适用范围窄等缺点,从基因水平进行治疗可以改善这些问题。目前miRNA在肿瘤发生和发展过程中所起的作用受到广泛关注。miRNA在黑素瘤发生和发展中的作用已有了一定的研究基础,Yang等[9]研究表明miR-21在B16细胞中表达显著升高,并抑制其靶基因PTEN的表达进而增强黑素瘤细胞的增殖和侵袭能力。Mazar等[10]研究发现在黑素瘤细胞中miR-34b的表达显著降低,高表达的miR-34b可以抑制黑素瘤细胞的侵袭和迁移能力。合适的电位粒径是纳米复合物发挥作用的条件[11]。本研究发现N/P值大于5时,PAMAM与sh-miR-34a形成较为稳定的纳米复合物,当N/P值为20时,纳米复合物电位粒径最为理想,这为纳米复合物进入黑素瘤细胞并发挥作用提供了前提。从摄取的结果也可以看出,当N/P值为20时,人黑素瘤A375细胞对PAMAM/sh-miR-34a的摄取达最高(P<0.05)。这可能是由于随着N/P值的升高PAMAM的正电性增强,对sh-miR-34a的包裹更加紧密。PAMAM末端的氨基在进入细胞后可以发挥类似“质子海绵效应”的作用,当溶酶体内的pH下降时,PAMAM能够大量捕获质子,引起Cl-内流,造成溶酶体渗透性肿胀,导致溶酶体破裂从而促进PAMAM/sh-miR-34a纳米复合物从溶酶体中逃逸[12],最终表达出miR-34a进而抑制A375细胞的增殖、侵袭和迁移,本实验的结果也证明了这一点。
Akt是一种信号转导蛋白,作为磷脂酰肌酶3(PI3K)通路的关键效应因子,在细胞存活和凋亡的平衡关系中起重要作用[13]。有研究发现磷酸化的Akt(pAkt)在黑素瘤组织中表达升高,可以作为药物靶点[14]。Rb基因属于抑癌基因,在控制细胞进入或脱离细胞周期的过程中起重要作用,Rb失活后成为pRb,释放多种转录因子,从而造成细胞增殖失控[15]。细胞外调节蛋白激酶(ERK)分为ERK1和ERK2,统称为ERK1/2。ERK1/2磷酸化后(pERK1/2)会导致细胞增殖加速进而形成肿瘤[16]。本研究发现,PAMAM/sh-miR-34a复合物与A375细胞作用48 h后,A375细胞中pAKt、pRb、pERK1/2蛋白的表达降低,从而起到抑制A375增殖、侵袭和迁移的作用。
综上所述,本研究以目前研究最为广泛和深入的非病毒载体材料PAMAM为载体,构建了基因递送系统,发现PAMAM/sh-miR-34a纳米复合物对人恶性黑素瘤A375细胞具有抑制作用,为miR-34临床治疗恶性黑素瘤提供了新的思路。
| [1] | Webster R M, Mentzer S E.The malignant melanoma landscape[J].Nat Rev Drug Discov, 2014,13:491-492. |
| [2] | Jochemsen A G.Reactivation of p53 as therapeutic intervention for malignant melanoma[J].Curr Opin Oncol, 2014,26:114-119. |
| [3] | Stretch J R, Gatter K C, Ralfkiaer E, Lane D P, Harris A L.Expression of mutant p53 in melanoma[J].Cancer Res, 1991,51:5976-5979. |
| [4] | Yamakuchi M, Ferlito M, Lowenstein C J.miR-34a repression of SIRT1 regulates apoptosis[J].Proc Natl Acad Sci U S A, 2008,105:13421-13426. |
| [5] | Zhang D G, Zheng J N, Pei D S.PP53/microRNA-34-induced metabolic regulation: new opportunities in anticancer therapy[J].Mol Cancer, 2014,13:115. |
| [6] | Bommer G T, Gerin I, Feng Y, Kaczorowski A J, Kuick R, Love R E,et al.p53-mediated activation of miRNA34 candidate tumor-suppressor genes[J].Curr Biol, 2007,17:1298-1307. |
| [7] | Bader A G.miR-34-a microRNA replacement therapy is headed to the clinic[J].Front Genet, 2012,3:120. |
| [8] | 沈 楠,朱 宏.药物载体PAMAM树状大分子的毒理[J].材料导报,2012,26:72-77,89. |
| [9] | Yang C H, Yue J, Pfeffer S R, Handorf C R, Pfeffer L M.MicroRNA miR-21 regulates the metastatic behavior of B16 melanoma cells[J]. J Biol Chem, 2011,286:39172-39178. |
| [10] | Mazar J, Khaitan D, DeBlasio D, Zhong C, Govindarajan S S, Kopanathi S, et al. Epigenetic regulation of microRNA genes and the role of miR-34b in cell invasion and motility in human melanoma[J].PLoS One, 2011,6:e24922. |
| [11] | Pack D W, Hoffman A S, Pun S, Stayton P S.Design and development of polymers for gene delivery[J].Nat Rev Drug Discov, 2005,4:581-593. |
| [12] | Wang X, Wu X, Fan W,Ding B,Wang X,Zhang W, et al. Surface modification with pluronic P123 enhances transfection efficiency of PAMAM dendrimer[J].Macromol Res, 2012, 20:162-167. |
| [13] | Maes H, Martin S, Verfaillie T, Agostinis P.Dynamic interplay between autophagic flux and Akt during melanoma progression in vitro[J].Exp Dermatol, 2014,23:101-108. |
| [14] | Gowda R, Madhunapantula S V, Kuzu O F, Sharma A, Robertson G P.Targeting multiple key signaling pathways in melanoma using leelamine[J].Mol Cancer Ther, 2014,13:1679-1689. |
| [15] | 欧阳学农,王文武,姜 浩.人乳腺癌细胞凋亡与去磷酸化RB蛋白的关系[J].中国癌症杂志,2004,14:306-308. |
| [16] | 陈办成,姚勇丰,杨媛慧,钟绮丽,邵 勇,张 杰,等.U0126 对黑素瘤细胞 A375 侵袭的抑制作用[J].中国麻风皮肤病杂志,2013,29:88-91. |
 2016, Vol. 37
2016, Vol. 37


