2. 安庆市第一人民医院肿瘤内科, 安庆 246004;
3. 安徽省立医院肿瘤放疗科, 合肥 230001
2. Department of Oncology, The First People's Hospital of Anqing, Anqing 246004, Anhui, China;
3. Department of Radiation Oncology, The Provincial Hospital of Anhui, Hefei 230001, Anhui, China
手术是胃癌的主要治疗方式。临床研究证实,在局部进展期胃癌接受D2根治术后辅助化疗,能改善生存[1, 2]。放疗最初仅限于胃癌的姑息对症治疗,随着三维放疗的开展,越来越多的研究者将放疗应用于胃癌术后的辅助治疗中。其中SWOG/INT0116是一项具有里程碑意义的临床研究[3]。该研究结果显示,术后放疗+化疗组较单纯化疗组有更好的3年总体生存率,但该方案中同步化疗方案为团注氟尿嘧啶,表现出了较高的血液毒性,且入组病例仅10%接受标准的D2淋巴结清扫,因此,不能准确评价D2术后同步放化疗能否带来生存获益。本研究收集2010年4月至2011年12月接受标准D2根治术的局部进展期胃癌患者,随机分为2组,分别采用三维适型调强放疗(IMRT)并同步给予卡培他滨单药化疗序贯奥沙利铂联合卡培他滨(XELOX)方案和单纯术后XELOX方案辅助化疗进行治疗,评价同步放化疗在局部进展期胃癌术后辅助治疗中的意义,为最大限度地减少正常组织放疗受量及化疗药物毒性提供依据。
1 对象和方法 1.1 研究对象2010年4月至2011年12月,安徽医科大学第一附属医院肿瘤内科及安徽省立医院放疗科就诊的未接受术前治疗的局部进展期胃癌患者,采用随机数字表法将患者随机分为试验组(同步放化疗)和对照组(单纯化疗)。入组标准:(1)经标准胃癌根治术(R0,D2)后,病理证实的局部进展期胃腺癌患者,按AJCC(第7版)分期为T3~4和(或)N+,且M0的患者;(2)未接受术前放疗或化疗;(3)ECOG行为状况评分0~2分;(4)无重要脏器功能损伤,无严重消化道出血及梗阻;(5)血红蛋白≥110 g/L,白细胞计数≥4.0×109/L,血小板≥100×109/L;(6)经伦理委员会审核通过,并签署知情同意书。排除标准:(1)妊娠或哺乳期妇女;(2)对化疗药物过敏者;(3)精神病患者;(4)合并其他实体肿瘤的患者;(5)预计生存期<6个月者。研究对象筛选流程如图 1所示。

|
图 1 研究对象筛选流程图 Fig 1 Flow diagram of patients screening |
两组患者均于术后第4周开始治疗。试验组:定位前禁食4 h,取仰卧位16排螺旋CT模拟定位,定位前10 min常规口服200 mL水加76%泛影葡胺20 mL,造影显示残胃和小肠。以层厚2.5 mm行CT扫描,图像传至Pinnacal三维计划系统(TPS)后,在扫描图像上逐层勾画靶区及危险器官。根据CT造影图像及术中银夹位置,勾画临床靶区(CTV),包括瘤床、吻合口或残端,以及相关淋巴结组。按原发肿瘤所在部位不同,临床靶区勾画范围相应调整:近端胃或胃食管结合部原发癌,照射野应该包括远端食管3~5 cm、邻近的胰体部和左半横膈膜,高危淋巴结区包括邻近的食管周围、胰腺上、胃周、脾门淋巴结和腹腔干淋巴结区;胃体癌应包括胰体部,高危淋巴结区包括邻近的胃周、胰腺上、脾门、腹腔干、肝门和胰十二指肠淋巴结;胃窦癌如果扩展到胃十二指肠结合部,放射野应包括胰头和十二指肠残端3~5 cm,高危淋巴结区包括胃周、胰腺上、腹腔干、肝门和胰十二指肠淋巴结。临床靶区头脚方向外放1.0 cm、左右胸腹方向外放0.5 cm为计划靶区(PTV),并根据毗邻情况适当调整。使用TPS,计划给予处方剂量为45 Gy(1.8 Gy/d)。正常组织的限量:肝脏,60%肝脏<30 Gy;肾脏,至少一侧肾脏的2/3<20 Gy;脊髓,<45 Gy;心脏,1/3心脏<40 Gy。每次放疗前10 min,均饮用等量的水,以尽量保证治疗时胃形态的一致性。初始3次治疗前予锥形束CT(cone beam CT,CBCT)采集治疗体位的CT图像与计划图像进行匹配比较,在线校正误差,以后每周进行1次CBCT扫描。放疗期间口服卡培他滨825 mg/m2,2次/d,每周监测血常规。同步放化疗治疗(5周)结束后,间歇2~3周,继续予以奥沙利铂联合卡培他滨(XELOX)方案治疗4周期,给药方法:奥沙利铂130 mg/m2,静脉滴注3 h,第1天;卡培他滨1 000 mg/m2,口服,2次/d,第1~14天,休息7 d;每3周重复。
对照组:术后仅予以XELOX方案化疗6周期,用药方法同试验组。
1.3 疗效及不良反应评估随访截止时间为2014年11月,观察两组患者的复发和死亡情况。计算局部复发率,1、2、3年无病生存率及总生存率。无疾病生存期定义为从随机化分组开始至疾病复发、转移或由于疾病进展导致死亡的时间。总生存期指从随机化分组至患者死亡的时间间隔。按照RTOG标准及WHO药物毒性分级标准评定放疗和化疗的不良反应[4, 5]。
1.4 统计学处理采用SPSS 17.0软件进行统计分析。计数资料的比较采用χ2检验,不良反应分级比较采用秩和检验。采用Kaplan-Meier方法进行生存分析,Log-rank法比较生存差异。与生存结局相关的单因素分析经Log-rank检验,有意义的指标引入Cox回归风险模型进行多因素分析。检验水准(α)为0.05。
2 结 果 2.1 两组患者基本资料对比共纳入未接受术前治疗的局部进展期胃癌患者79例,试验组40例,年龄36~76岁(中位年龄62岁),术后予以同步放化疗序贯化疗;对照组39例,年龄38~79岁(中位年龄59岁),术后仅予以化疗。两组患者年龄、性别、ECOG评分、肿瘤分期、淋巴结转移率、肿瘤细胞分化程度及肿瘤发生部位比较,差异均无统计学意义,具有可比性(表 1)。
|
|
表 1 试验组与对照组临床资料对比 Tab 1 Comparison of clinical characteristics between the two groups |
患者随访8~52个月,中位随访时间34个月。试验组、对照组各失访1例。随访截止时,试验组11例存活,对照组8例存活。局部复发范围包括吻合口、十二指肠残端、瘤床、残胃和照射野内的淋巴结区。远处转移范围包括照射野外的淋巴结区、腹膜种植、肝、肺等其他部位。随访截止时,试验组与对照组局部复发率分别为40.0%(16/40)和64.1%(25/39),两组差异有统计学意义(P=0.032)。试验组与对照组3年无病生存率分别为42.5%和28.2%,中位无病生存期分别为31个月和29个月,3年总生存率分别为52.5%和38.5%,试验组高于对照组,但差异均无统计学意义(表 2、图 2)。
|
|
表 2 试验组与对照组患者局部复发率及生存状况比较 Tab 2 Comparison of local recurrence and survival between the two groups |
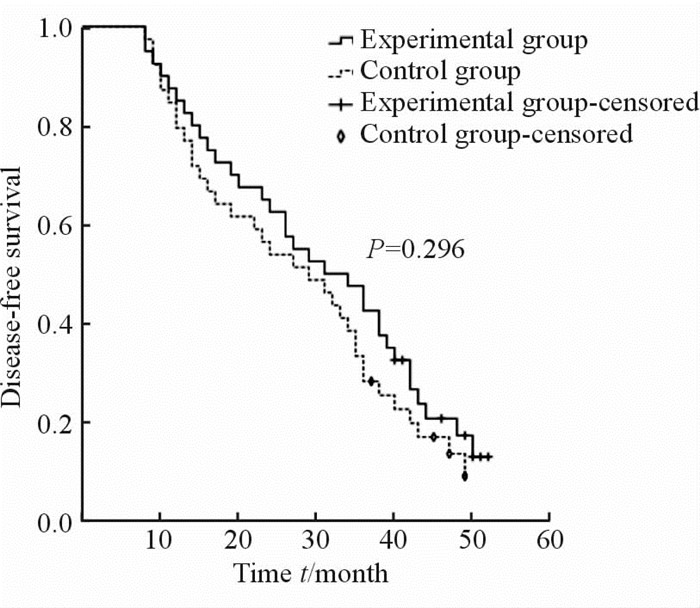
|
图 2 试验组与对照组无病生存期比较 Fig 2 Comparison of disease-free survival between the two groups |
术后病理淋巴结阳性患者58例,其中试验组31例,对照组27例。试验组3年后存活14例(45.2%),对照组仅存活5例(18.5%),3年生存率比较差异有统计学意义(P=0.049);试验组与对照组中位无病生存期分别为26个月和19个月,差异有统计学意义(P=0.024,图 3)。

|
图 3 试验组与对照组淋巴结阳性患者无病生存期比较 Fig 3 Comparison of disease-free survival between the lymph node-positive patients in the two groups |
根据表 1的资料,将与患者预后可能相关的临床病理特征包括年龄、性别、ECOG评分、术后病理分期、淋巴结转移、肿瘤组织病理学分级、肿瘤发生部位,以及术后放疗与否进行单因素分析,提示ECOG评分、术后病理分期、淋巴结转移、肿瘤组织病理学分级及肿瘤发生部位与患者生存预后相关。将单因素分析有意义的指标进行多因素分析,肿瘤发生部位设置为哑变量,以胃窦癌为参照水平,结果显示淋巴结转移及ECOG评分为影响患者生存的重要预后因素,见表 3。
|
|
表 3 全组患者临床病理因素与生存预后的单因素和多因素分析 Tab 3 Univariate and multivariate analysis of clinicopathological factors and survival of all patients |
两组患者主要不良反应为血液毒性、胃肠道反应及神经毒性(表 4)。试验组与对照组比较,白细胞减低和血小板减低发生率分别为75.0%、15.0%和61.5%、12.8%,两组差异无统计学意义;恶心、呕吐发生率分别为87.5%和66.7%,试验组恶心、呕吐发生率高于对照组(P=0.043),但多为Ⅰ、Ⅱ度,Ⅲ度以上的呕吐发生率差异无统计学意义(P=0.562);神经毒性发生率相似,且主要为Ⅰ、Ⅱ度神经毒性。试验组共5例患者因不良反应未按试验设计要求完成治疗,其中3例患者因腹泻及血液毒性暂时性中断放疗,2例患者同步放化疗后出现白细胞减低,序贯化疗仅完成2周期。对照组无患者因不良反应出现治疗中断。
|
|
表 4 试验组与对照组主要不良反应比较 Tab 4 Comparison of main toxicities between the two groups |
胃癌是最常见的恶性肿瘤之一,统计数据表明胃癌占我国恶性肿瘤发病率的第2位,占恶性肿瘤死亡率的第3位[6]。近年来,虽然人们生活水平及卫生保健意识普遍提高,但我国仍未像日本和韩国那样在胃癌高危人群中开展普查,早期胃癌的诊断率仍较低,多数患者就诊时肿瘤已处于晚期,即便部分患者可行手术治疗,亦存在较高的术后复发率[7]。研究表明,对于局部晚期胃癌,即使行根治性手术,其术后复发率仍可高达50%[8],术后5年生存率仅为10%~50%。R0基础上的D2淋巴结清扫术,是否可作为局部进展期胃癌的标准手术方式,一直是东西方争论的焦点,但近年的研究表明,D2淋巴结清扫术作为可切除胃癌的标准手术渐已成为东西方的共识[9]。
多数研究证实,D1淋巴结清扫术后,辅助放化疗能降低局部复发率,但对D2淋巴结清扫术后辅助放化疗的研究报道较少,且多是作为亚组分析的研究结果,研究结果也多有分歧[10, 11]。本研究选取D2淋巴结清扫术后的局部进展期胃癌患者为观察对象,病理满足T3以上和(或)淋巴结阳性,但没有外周转移。放疗方式采用IMRT,疗程开始前3 d及治疗期间每周行CBCT扫描,充分保证照射野和靶区吻合的准确性,同时又较传统的二维放疗和三维适型放疗(3DCRT)能最大限度地减少脊髓、肝、肾、心等周围重要脏器的受量[12]。同步化疗方案选用口服单药卡培他滨,在保证化疗效果不减低的同时,起到放疗增敏的作用,与放疗同步应用能提高安全性[13]。试验组序贯化疗方案和对照组术后辅助化疗同为XELOX方案,该方案为NCCN指南推荐胃癌首选化疗方案,已广泛用于胃癌的辅助化疗和姑息化疗,且较顺铂联合氟尿嘧啶(FLP)有更低的毒性[14]。本研究结果显示,对于局部晚期胃癌D2淋巴结清扫术后患者,同步放化疗序贯化疗较术后单纯化疗降低了局部复发率,两组分别为40.0%和64.1%,差异有统计学意义(P=0.032)。3年无病生存率分别为42.5%和28.2%,试验组高于对照组,但差异未见统计学意义(P=0.238),中位无病生存期为31个月和29个月,差异亦无统计学意义(P=0.296)。由于本研究样本量较少,且入组的患者年龄偏大,对同步放化疗的耐受性稍差,以致试验组中35例按计划完成治疗,而其余5例患者未能按试验设计要求治疗,其中3例患者因腹泻及血液毒性暂时性中断放疗,中断时间均小于7 d,经对症处理后继续完成治疗;2例患者因同步放化疗后出现白细胞减低,仅序贯2周期XELOX方案。在后期的随访中,这5例患者均出现了复发或转移。即便如此,去除这5例患者后,试验组与对照组比较,亦未能得出3年无病生存率及3年总生存率在两组之间的差异有统计学意义。因此笔者认为,对于局部进展期胃癌患者,如果局部治疗达到D2淋巴结清扫,同步放化疗对控制远处转移的作用有限,下一步的临床研究可尝试同步化疗方案和后继序贯方案,选用新的疗效确切且不良反应小的新药组合。术后同步放化疗能否改善生存,还有待于大样本更长期的随访结果。值得一提的是,2015年1月5日《临床肿瘤学》杂志在线刊发了2014年ASCO会议上由韩国报道的胃癌辅助放化疗试验(ARTIST)Ⅲ期临床研究的最终研究报告[15],458例接受D2根治术的ⅠB~Ⅳ期的胃癌患者,术后随机给予XP方案(卡培他滨+顺铂)6个周期或XP方案联合同步放化疗[XP化疗2个周期,序贯同步放化疗(总剂量为45 Gy/25次+卡培他滨,再序贯XP方案化疗2个周期)]。中位随访7年,结果显示,两组患者无疾病生存和总生存相似,但在接受D2根治术的“淋巴结阳性”和“肠型”的胃癌患者中,辅助放化疗能明显改善无病生存。然而该试验中60%为Ⅰ~Ⅱ期患者,而我国接受综合治疗的患者以Ⅲ期为多,与我国患者群体有差异;另外,入组较多的Ⅰ~Ⅱ期患者的复发危险度较Ⅲ期患者低,因此放化疗的作用因为“入组人群”的原因而被“冲淡”。本研究对于淋巴结阳性患者的亚组分析,结果同样表明D2术后同步放化疗提高了淋巴结阳性患者的3年生存率(P=0.049)。中位无病生存期比较,试验组与对照组分别为26个月和19个月,且差异有统计学意义(P=0.024),显示出与ARTIST试验基本一致的结果。说明D2手术联合放疗,对于淋巴结阳性的患者确实有改善生存的趋势,而对于没有淋巴结转移的患者,D2手术已能取得较好的治疗效果。单因素及多因素分析结果也强烈提示淋巴结转移为影响生存的重要预后因素,与国内外多数报道[16, 17]一致。同时,本研究还发现ECOG行为状况评分对患者的预后亦有明显影响,ECOG评分为2分的患者死亡风险是0~1分患者的2.014倍,这一点国内外研究的资料却很少。单因素分析中有意义的指标术后病理分期、肿瘤组织病理学分级及肿瘤发生部位,对于生存预后亦有一定的参考价值,但多因素分析未显示统计学意义。考虑到入组患者中全胃癌及多中心癌患者仅3例,且术后病理分期与淋巴结阳性有一定相关性,评估前述指标是否具有独立预后的价值,尚有待于扩大样本量进一步深入研究。
综上所述,本项研究结果显示,局部晚期胃癌患者D2根治术后同步放化疗序贯化疗较单纯辅助化疗能降低局部复发率,对于淋巴结阳性的患者有改善总生存的趋势。但同步放化疗的不良反应如血液毒性和胃肠道反应等亦不容忽视。临床应用时,术后同步放化疗应尽量选择不良反应小的化疗方案联合,对于有淋巴结转移、行为状况好的患者,术后同步放化疗可能更适合。
| [1] | Bang Y J,Kim Y W,Yang H K,Chung H C,Park Y K, Lee K H,et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC): a phase 3 open-label, randomized controlled trial[J]. Lancet,2012,379:315-321. |
| [2] | Sakuramoto S, Sasako M, Yamaguchi T, Kinoshita T, Fujii M, Nashimoto A, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med,2007,357:1810-1820. |
| [3] | Macdonald J S, Smalley S R, Benedetti J, Hundahl S A, Estes N C, Stemmermann G N, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med,2001,345:725-730. |
| [4] | 吴一龙.循证医学、肿瘤学GCP原则及临床研究[M]//孙 燕.临床肿瘤学高级教程.北京:人民军医出版社,2011:126-135. |
| [5] | 姚 阳.恶性肿瘤的诊断与综合治疗[M].上海:复旦大学出版社,2005:562-570. |
| [6] | 赫 捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:28-30. |
| [7] | 孙益红,章 真,印季良.胃癌[M]//汤钊猷.现代肿瘤学.3版.上海:复旦大学出版社,2011:845-889. |
| [8] | Persiani R, D'Ugo D, Rausei S, Sermoneta D, Barone C, Pozzo C, et al. Prognostic indicators in locally advanced gastric cancer (LAGC) treated with preoperative chemotherapy and D2-gastrectomy[J]. J Surg Oncol,2005,89:227-236. |
| [9] | Songun I, Putter H, Kranenbarg E M, Sasako M, van de Velde C J. Surgical treatment of gastric cancer: 15-year follow-up results of the randomized nationwide Dutch D1D2 trial[J]. Lancet Oncol,2010,11:439-449. |
| [10] | Kim S, Lim D H, Lee J, Kang W K, MacDonald J S, Park C H, et al. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach[J]. Int J Radiat Oncol Biol Phys,2005,63:1279-1285. |
| [11] | Lee J, Lim do H, Kim S, Park S H, Park J O,Park Y S, et al. Phase Ⅲ trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial[J]. J Clin Oncol,2012,30:268-273. |
| [12] | 漆利军,张红雁,罗文广,张洪波,刘 磊,周 进.胃癌术后放疗方式对肾脏剂量学影响的比较研究[J].中华肿瘤防治杂志,2012,19:303-306. |
| [13] | Spigel D R, Greco F A, Meluch A A, Lane C M, Farley C, Gray J R, et al. Phase Ⅰ/Ⅱ trial of preoperative oxaliplatin, docetaxel, and capecitabine with concurrent radiation therapy in localized carcinoma of the esophagus or gastroesophageal junction[J]. J Clin Oncol,2010,28:2213-2219. |
| [14] | Al-Batran S E, Hartmann J T, Probst S, Schmalenberg H, Hollerbach S, Hofheinz R, et al. Phase Ⅲ trial in metastatic gastroesophageal adenocarcinoma with fluorouracil, leucovorin plus either oxaliplatin or cisplatin: a study of the Arbeitsgemeinschaft Internistische Onkologie[J]. J Clin Oncol,2008,26:1435-1442. |
| [15] | Park S H, Sohn T S, Lee J, Lim D H, Hong M E, Kim K M, et al. Phase Ⅲ trial to compare adjuvant chemotherapy with capecitabine and cisplatin versus concurrent chemoradiotherapy in gastric cancer: final report of the adjuvant chemoradiotherapy in stomach tumors trial, including survival and subset analyses[J]. J Clin Oncol, 2015, 33:3130-3136. |
| [16] | 邵新宏,韩 渊.胃癌外科治疗术后影响预后因素COX分析[J].中国老年学杂志,2012,32:3918-3920. |
| [17] | Kwon S J, Kim G S. Prognostic significance of lymph node metastasis in advanced carcinoma of the stomach[J]. Br J Surg, 1996, 83:1600-1603. |
 2016, Vol. 37
2016, Vol. 37


