2. 同济大学附属同济医院病理科, 上海 200065
2. Department of Pathology, Tongji Hospital, Tongji University, Shanghai 200065, China
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾细胞癌中最常见的组织学类型,其治疗方式的选择和预后与病理分级密切相关[1]。目前ccRCC的病理分级主要通过Fuhrman核分级确定[2]。据报道,磁敏感加权成像(susceptibility weighted imaging,SWI)肿瘤内磁敏感信号(intratumoral susceptibility signal intensity,ITSS)可以无创评估ccRCC的Fuhrman分级[3],但该研究局限于半定量分析的形态学领域,其可行性和准确性仍有待进一步验证。动态增强T1灌注加权成像(perfusion weighted imaging,PWI)是近年来兴起的功能性MR检查方法,能够获得血管生理相关的一系列参数,其中转运常数(transfer constant,Ktrans)与肿瘤内的微血管结构及血液产物具有密切联系,从而可能与ITSS及ccRCC的病理分级相关。本研究旨在分析ccRCC中ITSS和Ktrans之间是否存在相关性,并探讨运用PWI和SWI进行术前病理分级诊断对于预测肿瘤恶性程度的可行性。
1 材料和方法 1.1 研究对象选取2013年6月至2015年1月在同济大学附属同济医院医学影像科行3.0 T MR SWI和PWI检查的连续46例可疑肾癌患者的资料。46例均为临床及实验室检查高度怀疑肾癌并且在1个月内经病理证实的患者。排除标准:(1)3.0 T MR SWI和PWI各时相屏气不稳定致使同一层面图像不匹配或图像模糊者;(2)怀疑肾脏疾病已接受一定医疗方法治疗者;(3)装有起搏器或循环系统疾病者;(4)因全身代谢性或免疫性疾病而长期服药治疗者。其中10例分别因血管平滑肌脂肪瘤(n=3)、乳头状细胞癌(n=5)、巨大淋巴结增生症(n=1)和嫌色细胞癌(n=1)而被排除。最终,36例ccRCC患者纳入本研究,其中男性23例,女性13例;年龄34~86岁,平均(60±13)岁。由一位病理科高年资主治医师进行病理Fuhrman核分级(Ⅰ~Ⅳ)评估。
1.2 病理评价Fuhrman核分级标准如下:Ⅰ级,核小且规则,直径约10 μm,核仁小或无;Ⅱ级,核略大且轻度不规则,直径约15 μm,高倍显微镜(×400)视野下可见核仁;Ⅲ级,核较大且中至重度不规则,直径约20 μm,高倍显微镜(×100)视野可见核仁明显;Ⅳ级,核形态与Ⅲ级相似,可见畸形核,大块状染色。其中Ⅰ~Ⅱ级定义为低级别,Ⅲ~Ⅳ级定义为高级别。
1.3 MRI扫描方法所有受检者均在3.0 T超导MRI成像系统(MAGNETOM Verio; Siemens Medical Systems,Erlangen,Germany)中进行扫描,采用6通道体部相控阵线圈。检查前取仰卧位进行呼吸训练,每期扫描均为屏气扫描,并尽量确保屏气位置在同一水平。扫描范围覆盖膈顶至双肾下极。所有患者检查前均签署了知情同意书。
1.3.1 常规MRI三平面定位后,行横轴面常规T1WI:TR/TE 140 ms/2.46 ms,FOV 400 mm×300 mm,矩阵320×240,层厚7 mm,层距1.4 mm,反转角70°,带宽270 Hz/pixel;横轴面常规T2WI :TR/TE 1 200 ms/98 ms,FOV 400 mm×360 mm,矩阵320×224,层厚7 mm,层距1.4 mm,反转角110°,带宽504 Hz/pixel;横轴面T1WI和T2WI的全部扫描时间分别为29 s和38 s。
1.3.2 SWI横轴面2D多次屏气SWI:TR/TE 150 ms/10 ms;FOV 380 mm×285 mm,矩阵384×250,层厚7 mm,层距1.4 mm,反转角20°,带宽260 Hz/pixel。2D SWI 扫描过程分3次屏气,每次持续约12~16 s,间歇5 s,全部采集时间约为60 s。SWI扫描完成后,将重建出一组幅值图、相位图、最小密度投影(mIP)和SWI图像。
1.3.3 PWI检查前用22 G静脉留置针建立静脉通道。PWI采用基于3D容积内插屏气扫描(VIBE)的快速T1定量序列:TR/TE 5.19 ms/1.8 ms,FOV 350 mm×263 mm,矩阵288×216,层厚5.0 mm,层距 1.0 mm,带宽260 Hz/pixel。首先利用双反转角技术进行T1-map扫描,反转角分别为2°和14°,计算出定量的T1值。在T1-map及动态增强前两个动态时相扫描完成后,第3个动态时相开始时采用高压注射器经肘静脉以4 mL/s的速率注入对比剂Gd-DTPA(北陆药业,北京,中国),剂量为0.1 mmol/kg,随后以同样速率注入20 mL生理盐水,单次扫描周期为15 s产生两期动态增强图像,此后每间隔20 s完成一期扫描,共20期,扫描时间共约350 s。
1.4 图像分析应用Syngo软件平台提供的Tofts双室药代动力学模型,将T1-map及所有灌注图像导入Tissue 4D软件进行后处理,得到血管生理相关的一系列参数,包括Ktrans、速率常数(rate constant of backflux,Kep)及血管外细胞外间质容量(extra-vascular extra-cellular space fractional volume,Ve),并生成相关灌注参数图[4, 5, 6]。
感兴趣区(region of interest,ROI)的选取首先需与病理切片的层面尽量准确对应;其次结合肿瘤的常规MRI、PWI、SWI图像进行综合分析,对照肿瘤实性组织内PWI增强后强化最明显的“亮点”区域与SWI表现为低信号的“热点”区域,尽量避开肿瘤坏死、囊变区域、邻近其他组织、钙化灶及血管的干扰,使所获取的参数值尽可能真实地反映肿瘤实性成分中恶性程度最高的部分。感兴趣区的大小保持直径为10 mm不变。
图像的定性分析由2名高年资的放射科医师完成。肿瘤内的微血管结构和出血在连续层面内显示为良好的线状和点状(有或没有聚集成团)低信号,在SWI上被定义为ITSS[3]。本研究将ITSS的形态分为3类:聚集成点状,聚集成线状,点状和线状混合结构。如果肿瘤内的低信号病变在相位图上显示为高信号则视为钙化物质而被排除[7]。评估每个肿瘤是否存在ITSS,并参照PWI强化区域计算对应的SWI图像层面高、低级别ccRCC线状(微血管结构)和点状(出血)ITSS的发生率。将SWI在肿瘤的连续区域内所获得的ITSS划分为4个等级:0级,无ITSS;1级,1~5个点状或线状ITSS;2级,6~10个点状或线状ITSS;3级,大于等于11个点状或线状ITSS,同时记录同一ROI所得ITSS等级和Ktrans值,重复测量3次,取平均值。
1.5 统计学处理应用SPSS 19.0统计分析软件(Chicago,IL,USA)进行统计学分析。应用同类相关系数(intraclass correlation coefficient,ICC)确定ITSS等级和Ktrans值的观察者间变异水平,并在不同的Fuhrman分级下分别采用Kruskal-Wallis检验和方差分析(ANOVA)进行组间比较,两两比较采用Nemenyi检验和SNK(Student-Newman-Keuls)检验。用Spearman相关系数分析ITSS与Ktrans之间的相关性。运用受试者工作特征(receiver operator characteristic,ROC)曲线分析SWI和PWI对高度恶性肿瘤的诊断效能并计算曲线下面积(AUC)、敏感性和特异性。检验水准(α)为0.05。
2 结 果 2.1 病理结果36例均为ccRCC,其中Fuhrman Ⅰ级8例,Ⅱ级16例,Ⅲ级12例;低级别组24例,高级别组12例。
2.2 SWI及PWI图像表现36例ccRCC患者的SWI图像均可观察到ITSS,其中高级别组中点状及线状ITSS的数量均高于低级别组(26.5±9.5 vs 21.0±7.4;11.0±3.0 vs 6.67±2.1)。在SWI和Ktrans灌注伪彩图上,线状ITSS(67.6%)通常对应于动态增强T1加权图像上的肿瘤边缘部分,符合视觉上Ktrans平均值最大的区域(图 1~3)。
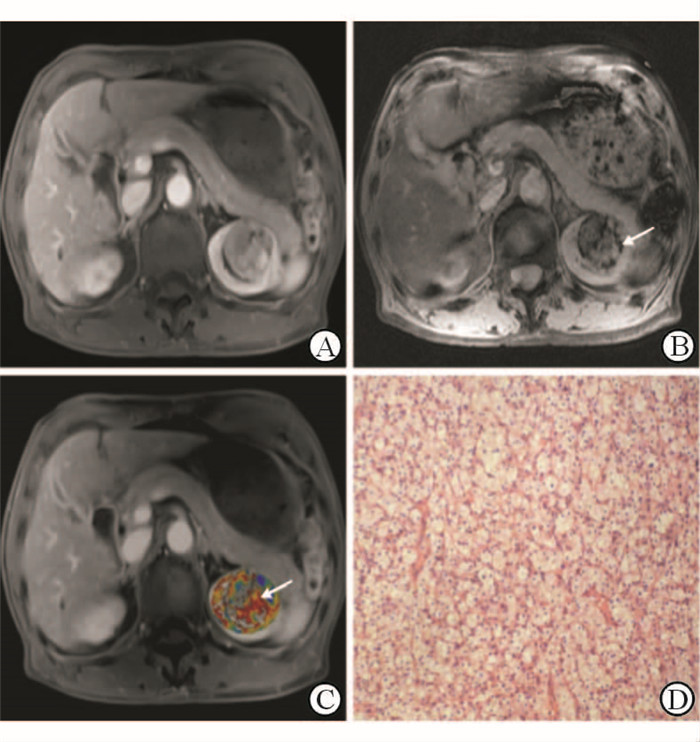
|
图 1 85岁男性左肾Fuhrman Ⅰ级透明细胞癌的MR图像 Fig 1 MR image of an 85-year-old man with a left renal clear cell carcinoma of FuhrmanⅠgrade A: The dynamic contrast-enhanced axial T1-weighted image showed an irregular enhanced mass on the left kidney; B: SWI revealed a few fine linear and dot-like ITSSs (white arrow) just in the inner portion of the enhanced rim on the T1-enhanced image; C: Corresponding Ktrans map showed high Ktransmax values in the tumor segment, including a maximum degree of ITSS (white arrow); D: Histopathologic tumor specimen demonstrated small and regular cell nucleus (Original magnification: ×100). SWI: Susceptibility weighted imaging; ITSS: Intratumoral susceptibility signal intensity; Ktrans: Transfer constant |
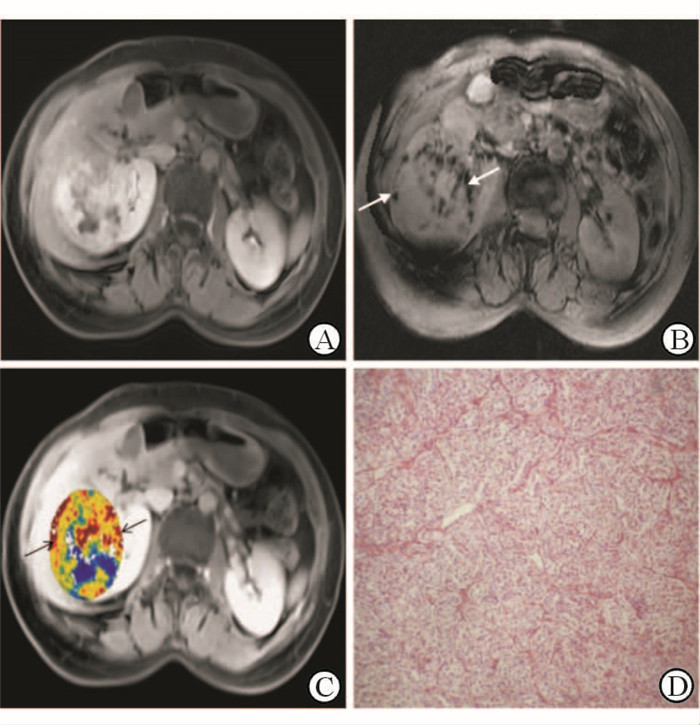
|
图 2 72岁女性右肾Fuhrman 分级Ⅱ级透明细胞癌的MR图像 Fig 2 MR image of a 72-year-old woman with a right renal clear cell carcinoma of Fuhrman Ⅱ grade A: The dynamic contrast-enhanced axial T1-weighted image showed an irregular enhanced mass on the right kidney; B: SWI revealed a few fine linear and dot-like ITSSs (white arrows) just in the inner portion of the enhanced rim on the T1-enhanced image; C: Corresponding Ktrans map showed high Ktransmax values in the tumor segment, including a maximum degree of ITSS (black arrows); D: Histopathologic tumor specimen demonstrated small and irregular cell nucleus and nucleoli(Original magnification: ×400). SWI: Susceptibility weighted imaging; ITSS: Intratumoral susceptibility signal intensity; Ktrans: Transfer constant |
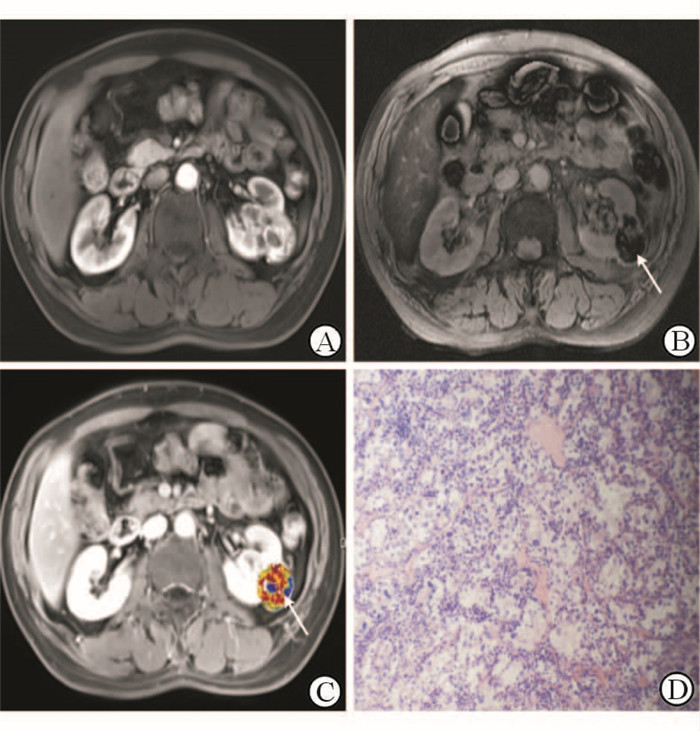
|
图 3 61岁男性左肾Fuhrman 分级Ⅲ级透明细胞癌的MR图像 Fig 3 MR image of a 61-year-old man with a left renal clear cell carcinoma of Fuhrman Ⅲ grade A: The dynamic contrast-enhanced axial T1-weighted image showed an irregular enhanced mass on the left kidney; B: SWI revealed conglomerated fine linear ITSSs (white arrow) just in the inner portion of the enhanced rim on the T1-enhanced image; C: Corresponding Ktrans map showed high Ktransmax values in the tumor segment, including a maximum degree of ITSS (white arrow); D: Histopathologic tumor specimen demonstrated irregular cell nucleus, increased chromatin and small nucleoli(Original magnification:×100). SWI: Susceptibility weighted imaging; ITSS: Intratumoral susceptibility signal intensity; Ktrans: Transfer constant |
ICC分析表明ITSS等级(ICC=0.872)和Ktrans值(ICC=0.944)均具有良好的观察者间一致性。而且经Spearman相关分析发现,在肿瘤同一ROI内,ITSS等级与Ktrans值呈中度正相关(r=0.536,P<0.01)。对不同Fuhrman分级ccRCC同一ROI的ITSS等级和Ktrans值进行比较,结果(表 1)显示ITSS等级和Ktrans值的组间差异均有统计学意义(P<0.05),但Ktrans值在FuhrmanⅡ级和Ⅲ级、FuhrmanⅠ级和Ⅱ级的组间差异无统计学意义(P>0.05)。
|
|
表 1 不同Fuhrman分级肾透明细胞癌患者ITSS等级和 Ktrans 值比较 Tab 1 ITSS degree and Ktrans value for renal clear cell carcinoma patients with different Fuhrman grades |
通过对ITSS和Ktrans在不同组织病理学分级间的AUC、敏感性和特异性进行分析,结果(表 2)显示,ITSS和Ktrans对于高、低级别ccRCC (Fuhrman Ⅲ vsⅠ~Ⅱ)鉴别诊断的AUC、敏感性和特异性相对较高,表明ITSS和Ktrans能够有效鉴别高级别和低级别ccRCC。
|
|
表 2 ITSS 等级和Ktrans值鉴别Fuhrman Ⅰ、Ⅱ和Ⅲ级肾透明细胞癌的曲线下面积、敏感性和特异性 Tab 2 AUC, sensitivity and specificity of ITSS degree and Ktrans value for differentiating renal clear cell carcinoma of Fuhrman gradeⅠ,Ⅱ and Ⅲ |
本研究发现在ccRCC相同ROI内的ITSS等级与Ktrans值呈中度正相关。SWI中线状ITSS部分对应于PWI中Ktrans平均值最大的区域(富血供区域),而ITSS特别浓密的区域并不能与Ktrans最大值区域精确匹配,因为ITSS很大程度上还与肿瘤坏死和微出血有关,且肿瘤坏死和微出血同样可以作为肿瘤血供丰富的标志。本研究还发现线状ITSS通常对应于动态增强T1加权图像上肿瘤边缘强化部分,可能是由于肿瘤中心区域肿瘤血管生成速度通常滞后于肿瘤细胞的增殖速度,导致肿瘤中心区域先于边缘发生坏死囊变。
3.2 SWI和PWI对ccRCC分级的病理基础2D多次屏气SWI是一种基于传统3D SWI的可在腹部直接应用的磁共振成像新技术[8],相比常规腹部MR序列可以增强检测微血管结构及血液产物的敏感性。恶性肿瘤中的病理性出血和微血管内大量的铁、去氧血红蛋白改变了组织间的局部磁敏感效应,从而导致ITSS相应增加[9],但该研究仅局限于形态学领域的半定量分析。
动态增强T1 PWI是近年来兴起的功能性MR检查方法,通过计算可以获得血管生理相关的一系列参数,其中Ktrans代表对比剂从血管内向细胞外血管外间质内的渗透速度[6],间接反映了组织血液中对比剂的浓度、流量、肿瘤血供、肿瘤血管表面积、肿瘤血管通透性及细胞外间隙容量。肿瘤组织一般包括实质细胞、血管和间质三个部分。Folkman[10]早就提出肿瘤依赖血管生成理论,指出丰富的肿瘤血管和肿瘤微血管的高通透性为肿瘤的生长和远处转移提供营养,埋藏在间质内新生血管的丰富程度,特别是向间质内渗透血氧的速度强弱,对肿瘤的生长速度起着决定性作用。恶性肿瘤能够产生较多的血管内皮生长因子,导致内皮细胞增殖,微血管密度增加,但新生内皮细胞功能存在缺陷、间隙增宽,因此形成的毛细血管壁基底膜不连续,使得血液从血管内向肿瘤内的渗透速度增加[11],Ktrans值也相应增高。
3.3 SWI和PWI对ccRCC分级的临床应用价值在以往的研究中,SWI提供了许多关于肾脏成像及疾病诊断的有价值信息[3, 12, 13]。同时,SWI在评价肿瘤分级方面也被认为是可行的成像技术之一[3, 14],其中ITSS是肿瘤分级的重要指标。Chen等[3]研究表明ITSS与ccRCC的病理分级相关,ITSS不仅反映了微血管的聚集,也可能提示高度恶性ccRCC中的出血坏死,因此SWI可以作为一种无创的ccRCC病理分级工具。但目前尚无将PWI用于ccRCC分级诊断的相关研究报道。本研究结果显示ITSS出现在所有ccRCC中,且在高度恶性ccRCC中SWI显示出高等级的ITSS,表明ITSS可以作为正确诊断高度恶性ccRCC的有价值信号,这一结论与Chen等[3]的研究结果一致。但ITSS等级和Ktrans值与ccRCC分级并非简单的线性关系,在Fuhrman Ⅰ~Ⅲ级中ITSS等级和Ktrans值均存在交叉。不同Fuhrman分级ccRCC同一ROI的ITSS等级和Ktrans值的组间差异有统计学意义(P<0.05),且高级别组均高于低级别组。但Ktrans值在FuhrmanⅡ级和Ⅲ级、FuhrmanⅠ级和Ⅱ级组间差异无统计学意义(P>0.05),可能与ROI的选取有关。在ROC曲线分析中,ITSS和Ktrans对于高、低级别ccRCC (Fuhrman Ⅲ vsⅠ~Ⅱ)鉴别诊断的AUC、敏感性和特异性相对较高,表明ITSS和Ktrans能够有效鉴别高级别和低级别ccRCC。
3.4 ROI的选取对Ktrans值的影响血管通透性参数Ktrans受到扫描参数设置、药代动力学模型差异、造影剂种类、组织血流灌注速率、ROI的选择、观察者间变异等多种因素的影响。本研究中Ktrans在FuhrmanⅡ级和Ⅲ级、FuhrmanⅠ级和Ⅱ级间的差异无统计学意义,其原因可能主要与ROI位置的选取有关。原则上ROI的选取应真实地反映肿瘤实性成分中恶性程度最高的部分,Braunagel等[15]研究表明ROI的大小和位置确实对肾细胞癌(RCC)定量DCE-MRI的灌注参数存在影响。本研究采用测量值变异度最高的small arbitrary ROI,并确保ROI在水平方向和垂直方向都应与病理切片尽量对应,大多数研究只注意到水平方向位置的选取,忽略了垂直方向上与病理切片层面的匹配,从而影响了数据的可靠性。而样本量的限制和潜在的误差也可能会导致阴性结果的出现。同时,阈值的确定也应建立在多中心大样本研究的基础上。因此本研究仅为初步探索,为ccRCC的分级诊断提供新方法和新思路。
综上所述,在3.0 T MR上,SWI和PWI可以评价ccRCC的病理性出血、肿瘤微血管及血管功能,而ITSS和Ktrans则可以为ccRCC术前分级诊断提供更为丰富的信息,将有助于手术方案的制定及预后的判断。
| [1] | Cairns P. Renal cell carcinoma[J]. Cancer Biomark, 2010, 9: 461-473. |
| [2] | Fukatsu A, Tsuzuki T, Sassa N, Nishikimi T, Kimura T, Majima T, et al. Growth pattern, an important pathologic prognostic parameter for clear cell renal cell carcinoma[J]. Am J Clin Pathol, 2013, 140: 500-505. |
| [3] | Chen J, Ding J, Dai Y, Xing W, Sun J, Zhang Z, et al. Assessment of intratumoral micromorphology for patients with clear cell renal cell carcinoma using susceptibility-weighted imaging[J]. PLoS One, 2013, 8: e65866. |
| [4] | Lee J, Cárdenas-Rodríguez J, Pagel M D, Platt S, Kent M, Zhao Q. Comparison of analytical and numerical analysis of the reference region model for DCE-MRI[J]. Magn Reson Imaging, 2014, 32: 845-853. |
| [5] | Ewing J R, Bagher-Ebadian H. Model selection in measures of vascular parameters using dynamic contrast-enhanced MRI: experimental and clinical applications[J]. NMR Biomed, 2013, 26: 1028-1041. |
| [6] | Khalifa F, Soliman A, El-Baz A, Abou El-Ghar M, El-Diasty T, Gimel'farb G, et al. Models and Methods for analyzing DCE-MRI: a review[J]. Med Phys, 2014, 41: 124301. |
| [7] | Haacke E M, Mittal S, Wu Z, Neelavalli J, Cheng Y C. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1[J]. AJNR Am J Neuroradiol, 2009, 30: 19-30. |
| [8] | Li R K, Zeng M S, Rao S X, Qiang J W, Dai Y M, Ji Y, et al. Using a 2D multibreath-hold susceptibility-weighted imaging to visualize intratumoral hemorrhage of hepatocellular carcinoma at 3T MRI: correlation with pathology[J]. J Magn Reson Imaging, 2012, 36: 900-906. |
| [9] | Mittal S, Wu Z, Neelavalli J, Haacke E M. Susceptibility-weighted imaging: technical aspects and clinical applications, part 2[J]. AJNR Am J Neuroradiol, 2009, 30: 232-252. |
| [10] | Folkman J. Tumor angiogenesis: therapeutic implications[J]. N Engl J Med, 1971, 285:1182-1186. |
| [11] | Barrett T, Brechbiel M, Bernardo M, Choyke P L. MRI of tumor angiogenesis[J]. J Magn Reson Imaging, 2007, 26: 235-249. |
| [12] | Xing W, He X, Kassir M A, Chen J, Ding J, Sun J, et al. Evaluating hemorrhage in renal cell carcinoma using susceptibility weighted imaging[J]. PLoS One, 2013, 8: e57691. |
| [13] | Mie M B, Nissen J C, Zollner F G, Heilmann M, Schoenberg S O, Michaely H J, et al. Susceptibility weighted imaging (SWI) of the kidney at 3T-initial results[J]. Z Med Phys, 2010, 20: 143-150. |
| [14] | Pinker V K, Noebauer-Huhmann I M, Stavrou I, Hoeftberger R, Szomolanyi P, Weber M, et al. High-field, high-resolution, susceptibility-weighted magnetic resonance imaging: improved image quality by addition of contrast agent and higher field strength in patients with brain tumors[J]. Neuroradiology, 2008, 50:9-16. |
| [15] | Braunagel M, Radler E, Ingrisch M, Staehler M, Schmid-Tannwald C, Rist C, et al. Dynamic contrast-enhanced magnetic resonance imaging measurements in renal cell carcinoma: effect of region of interest size and positioning on interobserver and intraobserver variability[J]. Invest Radiol, 2015, 50: 57-66. |
 2016, Vol. 37
2016, Vol. 37


