总姜黄素主要来源于天然中药姜黄,为黄色酚类物质,具有广泛的药理作用,如抑菌、抗病毒、抗氧化、抗癌、抗艾滋病毒等[1, 2]。传统中药及印度还有将总姜黄素用于治疗糖尿病的记载[3]。总姜黄素能抑制肺癌、胆囊乳头状腺癌、直肠癌等肿瘤细胞的增殖并促进肿瘤细胞的凋亡[4]。但是由于总姜黄素具有的酚类结构使其在碱性条件下易降解,对光、热、强酸及强碱均呈现不稳定性[5],并且总姜黄素水溶性极低,导致其药理活性受到限制[6]。
总姜黄素主要包括姜黄素、去甲氧基姜黄素(demethoxycurcumin,DE)、二去甲氧基姜黄素,结构式如图 1所示。虽然姜黄素是总姜黄素的主要成分[2, 7],但研究表明DE也有广泛的药理作用,甚至某些活性明显高于姜黄素,显示了广泛的药用前景[8]。本课题将以总姜黄素中分离出的DE单体作为考察对象,通过与羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin,HPCD)络合,制备成去甲氧基姜黄素羟丙基-β-环糊精包合物(demethoxycurcumin hydroxypropyl-β-cyclodextrin,DECD),采用紫外分光光度法测定了以DECD为模型药物在大鼠在体肠单向灌流实验中各肠段的吸收情况,为其临床研究提供理论基础和方法。
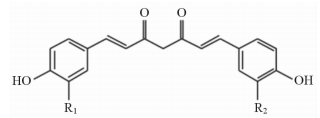
|
图 1 总姜黄素中3种化合物的结构式 R1=R2=OCH3,姜黄素;R1=OCH3,R2=H,去甲氧基姜黄素;R1=R2=H,二去甲氧基姜黄素 |
FA1004A电子天平(上海精天电子仪器有限公司);DZF-6020真空干燥箱(上海博迅实业有限公司医疗设备厂);KQ-2200B超声波清洗器(民山市超声仪器有限公司);BCD-649WE冰箱(青岛海尔股份有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);HHS-4S电子不锈钢恒温水浴锅(上海康路仪器有限公司);UV-7504型紫外可见分光光度仪(上海精密科学仪器有限公司);HL-1恒流泵(上海青浦沪西仪器厂);白金硫化硅胶管(兰格恒流泵有限公司);Zetasizer Nano激光粒度仪(英国Malvern公司)。
DE(>99%,自制);Lipoid S 75(PC,德国Lipoid公司);羧甲基纤维素钠(CMC-Na,上海时代生物科技有限公司);超纯水;Krebs-Ringer缓冲液[9](自配,1 000 mL内含氯化钠7.80 g,氯化钾0.35 g,氯化钙0.37 g,碳酸氢钠 1.37 g,磷酸二氢钠0.32 g,氯化镁20 mg,葡萄糖1.40 g,HCl和NaOH调节pH为6.5);其余试剂为分析纯。
1.2 DE检测波长及含量测定取DE乙醇溶液、HPCD乙醇溶液,以无水乙醇为空白,在200~800 nm范围内全波段扫描,确定DE的检测波长。精密称取DE适量,无水乙醇溶解后定容,摇匀,作为贮备液。精密吸取上述贮备液用Krebs-Ringer液稀释得DE质量浓度分别为1.03、2.06、3.09、4.12、5.15、6.18 μg/mL的标准品溶液。以Krebs-Ringer液为空白,在420 nm下测定其光密度(D)值,以D值对浓度进行线性回归。
1.3 DECD的制备称取适量的HPCD后加入少量超纯水,研磨均匀,再缓慢加入一定量的DE(DE与HPCD的物质的量比为1∶1),边加边研磨1 h,真空干燥2 h,研细即得DECD[8, 10],备用。
1.4 DECD的理化性质测定取适量DE、HPCD、DECD和DE+HPCD物理混合物,分别进行红外光谱(IR)分析和差示扫描量热法(DSC)分析。IR采集条件为室温(25±2)℃,扫描范围4 000~400 cm-1。DSC以Al2O3实验条件为参比,温度为-20~350℃,升温速率为10 K/min,量程为-25~25 V,气体为氮气,流速为20 mL/min,取样量为3~5 mg。另称取过量DECD和DE,分别加入超纯水形成过饱和水溶液,(25±2)℃搅拌24 h后取1 mL样品,6 375×g离心10 min,取适量上清液,无水乙醇稀释,于420 nm处测定D值,计算DECD和DE的溶解度。
1.5 DECD的形态及zeta电位测定取适量DE、HPCD、DECD和DE+HPCD物理混合物,显微照相观察形态。另取6 mg DECD,加入无水乙醇少许,后再加入10 mL 0.5%的CMC-Na溶液,超声使DECD分散混匀,配制成DECD质量浓度为0.6 mg/mL的混悬液。混悬液用蒸馏水稀释10倍后,采用马尔文粒径测定仪测定DECD的zeta电位。同法测定DE的zeta电位。
1.6 大鼠在体肠吸收评价[9]清洁级健康雄性SD大鼠12只,体质量(250±20)g,由重庆医科大学实验动物中心提供,许可证号:CQLA-2012-100。将12只SD大鼠随机分为DECD组和DE组(n=6)。大鼠使用前未用过其他药物,禁食不禁水12 h,3.5%水合氯醛10 mL/kg腹腔注射麻醉并固定于实验台。沿腹中线打开腹腔,在需要测定的肠段上端和下端分别剪开一个小口,然后插管结扎稳固,先用37℃保温的生理盐水将肠内容物冲洗干净,排出生理盐水,用空白Krebs-Ringer循环液循环15 min,流速0.2 mL/min,然后更换含药循环液(DECD溶液或DE混悬液,相当于含DE 60 μg/mL),以流速为0.2 mL/min进行灌流,计时1 h。四段出口处分别用25 mL容量瓶接流出液体。实验后取下容量瓶用Krebs-Ringer循环液稀释至刻度。剪下肠段,测量其长度(l)和内径(r)。根据下列公式计算其结果:
Ka=(X0-Xt)/C0t
Papp=Q×ln(Xin/Xout)/2πrl
P(%)=(X0-Xt)/X0
式中:Ka为吸收速率常数,Papp为表观渗透系数,P为吸收百分率,X0为药物的初始质量,Xt为时间t时药物灌流液中剩余的药物质量,C0表示药物初始浓度,t为灌流时间,Q为流速,Xin和Xout分别表示流入和流出的药物量,l和r分别为被灌流肠段的长度和横截面半径。
1.7 统计学处理采用SPSS 17.0软件进行统计学分析,组间比较采用t检验,检验水准(α)为0.05。
2 结 果 2.1 DE检测波长及含量测定结果DE的最大吸收波长为420 nm,且在420 nm波长处HPCD没有吸收,故以420 nm为DE的检测波长。检测结果表明,DE在1.03~6.18 μg/mL浓度范围内与D值呈良好的线性关系。以紫外分光光度法测定DE的含量,日内精密度及日间精密度良好,稳定性实验能满足测定需要,平均加样回收率为99.95%,RSD 为0.18%(n=3),符合分析要求。
2.2 DECD的理化表征 2.2.1 IR分析DE的特征吸收峰:1 624.52 cm-1代表C=O的吸收峰,1 574.93 cm-1和1 509.19 cm-1、1 137.30 cm-1及1 167.86 cm-1代表-OH的吸收峰,1 281.60 cm-1、1 235.23 cm-1代表双键上氢的吸收峰。DECD在IR图谱中药物特征吸收峰1 261.70 cm-1峰(代表双键上的氢)消失,而1 574.93 cm-1和1 509.19 cm-1吸收峰强度明显减弱,1 281.60、1 235.23 cm-1、1 137.30 cm-1及1 167.86 cm-1吸收峰消失。DE的特征吸收峰1 624.52 cm-1吸收强度明显减弱,表明DE被部分或全部包合进了HPCD的空穴中。而HPCD的特征吸收峰是1 653 cm-1,DECD在1 653 cm-1处有吸收峰。DE+HPCD物理混合物图谱中药物特征吸收峰1 574.93 cm-1峰消失,1 509.19 cm-1吸收峰减弱,但是DECD减弱程度明显强于物理混合物,表明DECD已形成(图 2)。
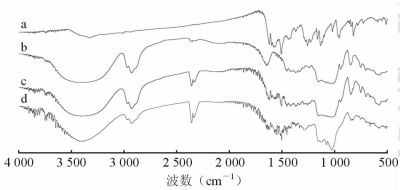
|
图 2 DECD系列红外(IR)扫描结果图 a: DE; b: HPCD; c: DE+HPCD物理混合物; d: DECD. DE: 去甲氧基姜黄素; HPCD: 羟丙基-β-环糊精; DECD: 去甲氧基姜黄素羟丙基-β-环糊精 |
DE在30.3℃和174.8℃分别有一个吸热峰,为DE的熔融峰。HPCD在29.1℃有一个吸热峰。DE+HPCD物理混合物在30.4℃及172.9℃分别有一个吸热峰;而DECD在33.2℃有吸收峰,其在174.8℃没有吸收峰出现,表明成功制备了DECD(图 3)。
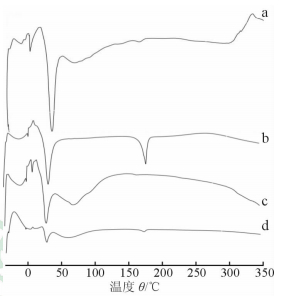
|
图 3 DECD系列差示扫描量热法分析结果图
a: DECD; b: DE; c: HPCD; d: DE+HPCD物理混合物. DE: 去甲氧基姜黄素; DECD: 去甲氧基姜黄素羟丙基-β-环糊精; HPCD: 羟丙基-β-环糊精 |
DECD的平均溶解度为2.30 g/L,是游离药物DE的38.33倍,结果表明将DE制备成DECD后,溶解度得到了很大的改善。
2.3 DECD的形态及zeta电位DE在显微镜下为红棕色的块状物质,HPCD呈现为均匀的灰色球状固体,DE+HPCD物理混合物为红棕色的块状物质和灰色球状固体的物理混合状态,而DECD呈现为深棕色的不规则状态,和DE、HPCD及DE+HPCD物理混合物的显微形态有明显区别,辅助说明DECD初步包合成功(图 4)。采用马尔文粒径测定仪测得DECD的zeta电位为-32.2 mV,而DE的Zeta电位为-59.1 mV。

|
图 4 DECD系列的显微形态
A: DE; B: HPCD; C: DE+HPCD物理混合物; D: DECD. DE: 去甲氧基姜黄素; HPCD: 羟丙基-β-环糊精; DECD: 去甲氧基姜黄素羟丙基-β-环糊精. Original magnification: ×200 |
各个肠段吸收情况如图 5所示。DECD在各肠段的平均Ka为(176.76±72.20)×10-5 s-1,是DE的180.88%;平均Papp为(19.28±7.46)×10-5 cm/s,较DE提高了171.97%;平均P为(46.49±5.29)%,是DE的158.96%,表明DECD能明显增加DE在大鼠各肠段的吸收,改善其在大鼠各肠段内的吸收动力学特征。
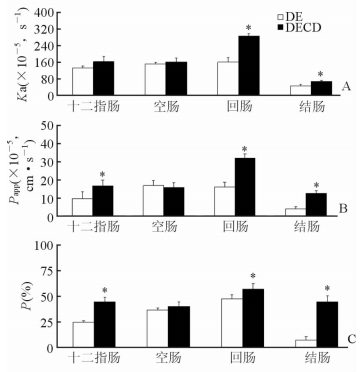
|
图 5 DECD和DE在不同胃肠段的吸收情况
A: 吸收速率常数(Ka); B: 表观渗透系数(Papp); C: 吸收百分率(P). DE: 去甲氧基 姜黄素; DECD: 去甲氧基姜黄素羟丙基-β-环糊精. *P<0.05与DE比较. n=6, x ± s |
环糊精是由淀粉经酶解环合得到的6~8个葡萄糖分子以α-1,4苷键连接的环状低聚物,可在分子水平上包合各种活性成分并赋予新的理化特性,是目前最简单的包合材料[10, 11]。HPCD是β-环糊精类包合材料中应用最广泛的药用辅料[10],相对β-环糊精和其他环糊精而言具有更好的生物相容性和水溶性,是被美国食品药物管理局(FDA)批准的可用于注射的药用辅料。有研究表明无论是难溶性的抗癌药还是非抗癌药,与HPCD络合形成包合物后,其水溶性、物理化学性质以及药代动力学/药效学性质都有明显改善[10]。本研究通过环糊精包合技术将DE制备成DECD包合物,明显改善了DE的溶解度。DE在碱性环境不稳定易变质,故本研究在进行在体肠吸收实验过程中,选择pH 6.5的Krebs-Ringer液作为循环液,并且在前期实验中考察了DE和DECD在肠道灌流液中的稳定性,发现DE和DECD在37℃的肠道灌流液中能稳定放置180 min。
本研究将单体DE作为考察对象,成功制备得DECD,通过单向灌流法考察了DECD和DE在大鼠小肠内的吸收情况,结果表明DECD比DE具有更好的P值,并且Ka和Papp都有一定程度的改善,其中在回肠有显著性改善。根据Papp可将吸收性能分为3类:Papp<0.03×10-4 cm/s,吸收差;Papp>0.2×10-4 cm/s,吸收完全,介于两者之间的为中等吸收[9],本实验结果表明DECD在大鼠肠段的吸收完全。
本研究通过紫外分光光度法测定DE含量及DECD在大鼠肠段的吸收情况,灵敏度高,操作简单,而制备的DECD在大鼠肠段的吸收良好,有望为DE新的制剂设计和临床合理用药提供参考。
| [1] | Lin C C, Lin H Y, Chi M H, Shen C M, Chen H W, Yang W J, et al. Preparation of curcumin microemulsions with food-grade soybean oil/lecithin and their cytotoxicity on the HepG2 cell line[J]. Food Chem,2014, 154: 282-290. |
| [2] | 赵会娟,刘红星,黄初升,黄克立. 姜黄色素3种主要成分的分离纯化研究进展[J].化工技术与开发,2012, 41: 41-46. |
| [3] | Zhang D W, Fu M, Gao S H, Liu J L. Curcumin and diabetes: a systematic review[J]. Evid Based Complement Alternat Med, 2013, 2013: 636053. |
| [4] | Zhang W, Bai W, Zhang W. MiR-21 suppresses the anticancer activities of curcumin by targeting PTEN gene in human non-small cell lung cancer A549 cells[J]. Clin Transl Oncol, 2014, 16: 708-713. |
| [5] | 张继芬,唐 勤,莫 婷,谢小芳,徐晓玉. 姜黄素磷脂载体的表征及肠吸收研究[J]. 中国药学杂志,2012, 47: 1736-1740. |
| [6] | Maiti K, Mukherjee K, Gantait A, Saha B P, Mukherjee P K. Curcumin-phospholipid complex: preparation, therapeutic evaluation and pharmaco-kinetic study in rats[J]. Int J Pharm, 2007, 330: 155-163. |
| [7] | 李 立,国大亮,朱晓薇,朱彩芳,何灵通. 姜黄素类物的提取分离及精制[J]. 天津中医药, 2010, 27: 509-511. |
| [8] | 农克良,韦良兴,慕光杉,农容丰,石 郦. 姜黄色素的简易提取与柱色谱分离研究[J]. 化工技术与开发, 2006, 35: 3-5. |
| [9] | 钟 萌,杨 林,杨 梅,胡雪原,张景勍.单向灌流法研究阿奇霉素泡囊的大鼠在体肠吸收[J]. 第二军医大学学报,2014,4:419-422. ZHONG M, YANG L, YANG M, HU X Y, ZHANG J Q. Single-pass intestinal perfusion for studying intestinal absorption of azithromycin niosomes in rats[J]. Acad J Sec Mil Med Univ, 2014,4:419-422. |
| [10] | Tan Q, Wu J, Li Y, Mei H, Zhao C, Zhang J. A supermolecular curcumin for enhanced antiproliferative and proapoptotic activities: molecular characteristics, computer modeling and in vivo pharmacokinetics[J]. Nanotechnology, 2013, 24: 035102. |
| [11] | 宋玉英,于 玲,李彦艳,付 鑫. 羟丙基-β-环糊精在药剂学中的应用进展[J]. 医药导报,2010, 29: 1314-1317. |
 2016, Vol. 37
2016, Vol. 37


