2. 南通大学航海医学研究所, 南通 226001
2. Institute for Nautical Medicine, Nantong University, Nantong 226001, Jiangsu, China
藁本内酯(ligustilide,LIG)在1960年由Mitsuhashi首次从伞形科藁本属植物Ligusticum acutilobum中分离得到,是淡黄色带香味的油状液体[1, 2, 3]。LIG可透过血脑屏障,能够改善脑微循环、抗氧化损伤、抑制炎症反应[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15]。已有的报道主要以研究LIG对海马神经的保护作用为主,而对皮质神经的保护作用的研究较少。本研究利用低灌注大鼠模型研究LIG对大鼠皮质神经元的保护作用,为开发治疗长期脑低灌注导致的相关疾病提供实验依据。
1 材料和方法 1.1 主要试剂和器材LIG按照先前报道的方法提取[16](纯度:HPLC测定95%~97%);焦油紫(上海如吉进口分装);鼠抗神经元特异性核蛋白(NeuN)一抗(Millipore,USA);兔抗Caspase-3一抗(Bioworld,USA);兔抗微管相关蛋白2(MAP-2)一抗(Bioworld,USA);FITC羊抗鼠二抗(Bioworld,USA);TRITC 羊抗兔二抗(Bioworld,USA);抗鼠/兔二抗试剂盒(北京中杉金桥生物技术有限公司);其他试剂为国产分析纯。冰冻切片机、正置荧光显微镜(Leica,德国)。
1.2 实验动物与分组健康雄性SD大鼠18只,清洁级,体质量250~270 g,由南通大学医学实验动物中心提供,许可证号SYXK(SU)2007-0021。将大鼠随机分为两组,第1组6只,第2组12只。按照文献报道的方法[16],分别进行如下手术处理(手术前大鼠断食12 h,断水6 h,10%水合氯醛进行麻醉):第1组,从其颈部正中切开,剥离出左右颈总动脉,不结扎,然后缝合创口;第2组,大鼠双侧颈总动脉结扎(two-vessel occlusion,2VO),从其颈部正中切开,剥离出左、右颈总动脉,用无菌尼龙手术缝合线(0号线)永久性结扎,并缝合创口。
两组大鼠术后饲养7 d后,进行如下处理:第1组大鼠,口腔灌服无菌食用大豆油1 mL,1次/d,连续灌服21 d,设为对照组;第2组,随机选取其中6只大鼠,口腔灌服无菌食用大豆油1 mL,1次/d,连续灌服21 d,设为模型组;剩余6只大鼠,口腔灌服含有LIG的无菌食用大豆油1 mL(LIG灌服量为80 mg/kg),1次/d,连续灌服21 d,设为LIG治疗组。所有大鼠均在相同条件下进行手术和饲养。
1.3 取材与切片3组大鼠(对照组、模型组、LIG治疗组)结束给药后继续饲养7 d。用10%水合氯醛腹腔注射麻醉后,剪开胸腔,将连接有生理盐水的注射针头插入左心室,并剪破左心耳。使用生理盐水灌注大鼠,直至无血液流出;然后改换10%甲醛溶液灌注,直至大鼠无任何反应。将灌注好的大鼠大脑全部取出。转入10%甲醛溶液继续浸泡12 h后,转入20%蔗糖溶液。直至大脑完全沉底后,转入30%蔗糖溶液,直至沉底,4℃保存备用。
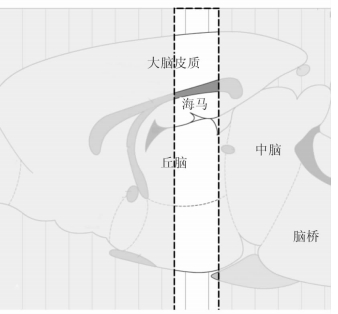
取上述大鼠大脑,按照冰冻切片机说明书操作,冠状方向取大脑皮质顶叶区域(图 1)的切片,切片厚度25 μm。将脑切片均匀铺在载玻片上后,-20℃保存备用。
|
图 1 脑切片区域示意图 虚线框内为选取进行实验的区域 |
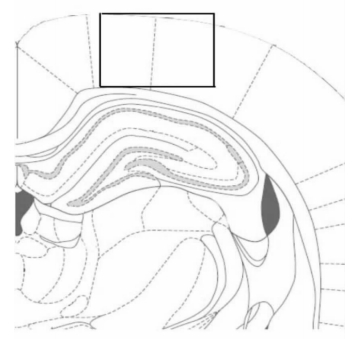
取上述脑切片,按照文献报道的方法[3]分别进行尼氏染色、免疫荧光和免疫组化实验。其中NeuN和Caspase-3进行免疫荧光实验,MAP-2进行免疫组化实验;显微镜下观察。利用Image-Pro Plus Version 6.0(IPP 6.0)软件对尼氏染色细胞、NeuN阳性细胞和Caspase-3阳性细胞进行计数(观察和计数部位见图 2),计数面积0.27 mm2,双侧计数,每组至少统计3只不同大鼠的脑切片。
|
图 2 观察和计数区域示意图 黑线框内为实际计数区域,面积为0.27 mm2 |
将各组数据换算成与对照组平均值的比值为统计数据,利用SPSS 13.0软件进行方差分析。MAP-2阳性数据不做量化统计。各组数据以x ± s表示,检验水准(α)为0.05。
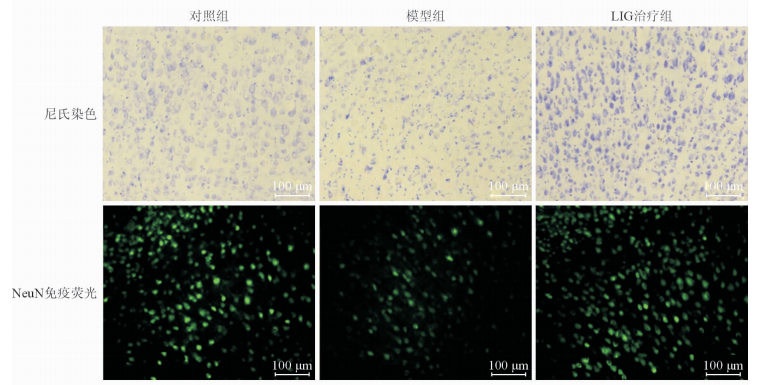
2 结 果 2.1 LIG对低灌注大鼠皮质神经元的影响尼氏染色结果(图 3)显示:模型组大鼠皮质区尼氏染色阳性神经元数量较对照组减少(0.49±0.11 vs 1.00±0.04,n=6,P<0.01)。LIG治疗组大鼠在相同区域则没有观察到明显的尼氏小体减少,与模型组比较差异有统计学意义(1.09±0.04 vs 0.49±0.11,n=6,P<0.01)。
|
图 3 3组大鼠皮质尼氏染色和神经元特异性核蛋白(NeuN)免疫荧光结果 LIG: 藁本内酯 |
NeuN免疫荧光实验(图 3)也验证了LIG在阻止低灌注大鼠皮质神经元减少方面的作用,模型组与对照组相比差异具有统计学意义(0.41±0.09 vs 1.00±0.03,n=6,P<0.01),LIG治疗组与模型组相比差异也具有统计学意义(0.95±0.06 vs 0.41±0.09,n=6,P<0.01)。
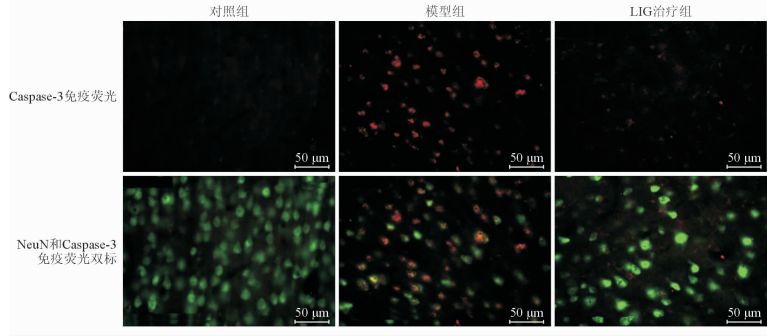
2.2 LIG对低灌注大鼠皮质神经细胞凋亡的影响Caspase-3免疫荧光结果(图 4)显示,模型组皮质区Caspase-3阳性细胞较对照组增加(6.20±0.30 vs 1.00±0.07,n=6,P<0.01);LIG治疗组皮质区Caspase-3阳性细胞数量较模型组减少(2.40±0.15 vs 6.20±0.30,n=6,P<0.01)。NeuN和Caspase-3免疫荧光双标实验(图 4)显示,模型组导致的皮质区凋亡细胞主要是NeuN阳性神经元,提示LIG能够阻止低灌注引起的皮质区神经元的凋亡。
|
图 4 3组大鼠皮质区Caspase-3免疫荧光及神经元特异性核蛋白(NeuN)和Caspase-3免疫荧光双标结果 LIG: 藁本内酯 |
作为神经元突触结构的重要组成部分,MAP-2在正常大鼠皮质表达量高,呈丝状或纤维状排列。本实验中MAP-2免疫染色结果(图 5)显示,对照组大鼠皮质区域MAP-2排列整齐,纤维结构明显;在模型组中,MAP-2表达较对照组明显减少,结构完整性也较差;LIG治疗组大鼠MAP-2表达量较模型组得到了提高,结构更加完整,排列更加整齐。提示LIG对低灌注大鼠皮质区MAP-2的表达或阻止其减少具有积极的作用。

|
图 5 3组大鼠皮质微管相关蛋白2(MAP-2)免疫组化结果 LIG: 藁本内酯 |
LIG在神经保护方面的作用,在之前的研究中有大量报道[4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17]。但是,这些研究报道中,LIG对慢性脑缺血神经保护作用的研究报道并不多;而关于其对大脑皮质神经元的保护作用,除我们研究小组之前的报道外[3]未见更多的报道。在本研究中,我们较之前的研究延长了大鼠慢性低灌注的时间,进一步观察LIG对皮质神经元的保护作用及相关机制。
本研究结果显示,通过对长期慢性低灌注大鼠给予LIG持续治疗后,能够有效防止低灌注大鼠皮质神经元结构的损伤和数量的减少。通过观察神经元尼氏小体和NeuN的表达变化发现,在长达5周的低灌注过程中,给予大鼠连续3周的LIG干预能够有效地阻止低灌注大鼠皮质神经元的减少。这一结果提示,LIG不仅对短期低灌注大鼠具有很好的神经保护作用[3],对于长期低灌注大鼠也具有类似的神经保护作用。
MAP-2在神经系统扮演重要角色,其不仅构成了神经元的骨架结构、维持神经细胞的形态,而且参与树突的生长、分支和重塑。MAP-2作为神经元损伤的标记物,其表达量的减少直接反映树突病变程度[18]。有文献报道,在2VO模型中,术后4 周大脑血流低灌注导致MAP-2 的表达量逐渐减少[19, 20]。本研究中,检测LIG治疗低灌注5 周大鼠皮质MAP-2 的表达变化情况,结果显示持续低灌注可明显导致大鼠皮质MAP-2表达减少。LIG给药后,低灌注大鼠皮质树突排列有显著改善,MAP-2表达量较低灌注模型组明显增加。因此我们认为LIG可有效阻止低灌注对大脑皮质神经元树突的损伤。
Caspase-3作为细胞凋亡的重要指标,其表达量的多少在一定程度上反映细胞凋亡的途径和进程。本研究发现,在低灌注大鼠模型的皮质中出现了大量神经元凋亡,而且这种凋亡主要集中在NeuN特异性的神经元。这一结果提示,低灌注大鼠的神经元凋亡是一个持续发生的过程,并随着时间的推移可能加重。LIG治疗组大鼠皮质凋亡神经元数量明显少于模型组,提示LIG能够有效抑制低灌注导致的皮质区神经元凋亡。这一结果进一步证实了之前有关LIG抗凋亡的报道[21]。
综上所述,LIG对长期低灌注导致的大鼠大脑皮质神经损伤具有一定的神经保护作用。这一保护作用可能是通过抑制皮质神经元的凋亡及维持神经元结构的完整性实现的。本实验为将LIG应用于治疗和预防长期慢性低灌注导致的相关疾病提供了实验参考和依据。
| [1] | 汪程远,杜俊蓉,钱忠明. 藁本内酯的研究进展[J]. 中国药学杂志, 2006, 41: 889-891. |
| [2] | 王雁南, 杜俊蓉. 藁本内酯对脑缺血再灌注大鼠的作用及其抗炎机制的研究[J].华西药学杂志, 2010, 25: 685-687. |
| [3] | Feng Z B, Lu Y P, Wu X M, Zhao P, Li J J, Peng B, et al. Ligustilide alleviates brain damage and improves cognitive function in rats of chronic cerebral hypoperfusion[J]. J Ethnopharmacol, 2012, 144: 313-321. |
| [4] | Guo J M, Shang E X, Duan J A, Tang Y, Qian D. Determination of ligustilide in the brains of freely moving rats using microdialysis coupled with ultra performance liquid chromatography/mass spectrometry[J]. Fitoterapia, 2011, 82: 441-445. |
| [5] | Zheng Y Z, Choi R C, Li J, Xie H Q, Cheung A W, Duan R, et al. Ligustilide suppresses the biological properties of Danggui Buxue Tang: a Chinese herbal decoction composed of radix astragali and radix angelica sinensis[J]. Planta Med, 2010, 76: 439-443. |
| [6] | Yang J Y, Chen H H, Wu J, Gong S X, Chen C Q, Zhang T J, et al. Advances in studies on pharmacological functions of ligustilide and their mechanisms[J]. Chin Herb Med, 2012, 4: 26-32. |
| [7] | Yu Y, Du J R, Wang C Y, Qian Z M. Protection against hydrogen peroxide-induced injury by Z-ligustilide in PC12 cells[J]. Exp Brain Res, 2008, 184: 307-312. |
| [8] | Kuang X, Du J R, Chen Y S, Wang J, Wang Y N. Protective effect of Z-ligustilide against amyloid beta-induced neurotoxicity is associated with decreased pro-inflammatory markers in rat brains[J]. Pharmacol Biochem Behav, 2009, 92: 635-641. |
| [9] | Cheng L L, Chen X N, Wang Y, Yu L, Kuang X, Wang L L, et al. Z-ligustilide isolated from Radix Angelicae sinensis ameliorates the memory impairment induced by scopolamine in mice[J]. Fitoterapia, 2011, 82: 1128-1132. |
| [10] | Li J J, Zhu Q, Lu Y P, Zhao P, Feng Z B, Qian Z M, et al. Ligustilide prevents cognitive impairment and attenuates neurotoxicity in D-galactose induced aging mice brain[J]. Brain Res, 2015, 1595: 19-28. |
| [11] | Kuang X, Chen Y S, Wang L F, Li Y J, Liu K, Zhang M X, et al. Klotho upregulation contributes to the neuroprotection of ligustilide in an Alzheimer's disease mouse model[J]. Neurobiol Aging, 2014, 35: 169-178. |
| [12] | Kuang X, Wang L F, Yu L, Li Y J, Wang Y N, He Q, et al. Ligustilide ameliorates neuroinflammation and brain injury in focal cerebral ischemia/reperfusion rats: involvement of inhibition of TLR4/peroxiredoxin 6 signaling[J]. Free Radical Bio Med, 2014, 71:165-175. |
| [13] | Shi Y, Wang D T, Lu L, Yin Y, Wang M, Li C J, et al. Ligustilide prevents the apoptosis effects of tumour necrosis factor-alpha during C2C12 cell differentiation[J]. Int Immunopharmacol, 2014, 19: 358-364. |
| [14] | Huang J, Lu X Q, Zhang C, Lu J, Li G Y, Lin R C, et al. Anti-inflammatory ligustilides from Ligusticum chuanxiong Hort[J]. Fitoterapia, 2013, 91: 21-27. |
| [15] | Peng B, Zhao P, Lu Y P, Chen M M, Sun H, Wu X M, et al. Z-ligustilide activates the Nrf2/HO-1 pathway and protects against cerebral ischemia-reperfusion injury in vivo and in vitro[J]. Brain Res, 2013, 1520:168-177. |
| [16] | Farkas E, Luiten P G M, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion-related neurodegenerative diseases[J]. Brain Res Rev, 2007, 54: 162-180. |
| [17] | 李 静,汪 宁,汪光云,朴新新. 藁本内酯神经保护药理作用研究进展[J]. 亚太传统医药, 2015, 11: 55-57. |
| [18] | Kuang X, Du J R, Liu Y X, Zhang G Y, Peng H Y. Postischemic administration of Z-ligustilide ameliorates cognitive dysfunction and brain damage induced by permanent forebrain ischemia in rats[J]. Pharmacol Biochem Behav, 2008, 88: 213-221. |
| [19] | Ballough G P, Martin L J, Cann F J, Graham J S, Smith C D, Kling C E, et al. Microtubule-associated protein 2 (MAP-2): a sensitive marker of seizure-related brain damage[J]. J Neurosci Methods, 1995, 61: 23-32. |
| [20] | Annaházi A, Mracskó E, Süle Z, Karg E, Penke B, Bari F, et al. Pre-treatment and post-treatment with α-tocopherol attenuates hippocampal neuronal damage in experimental cerebral hypoperfusion[J]. Eur J Pharmacol, 2007, 571: 120-128. |
| [21] | Kuang X, Yao Y, Du J R, Liu Y X, Wang C Y, Qian Z M. Neuroprotective role of Z-ligustilide against forebrain ischemic injury in ICR mice[J]. Brain Res, 2006, 1102: 145-153. |
 2016, Vol. 37
2016, Vol. 37


