2. 山西医科大学医学影像学系, 太原 030001
2. Department of Medical Imaging, Shanxi Medical University, Taiyuan 030001, Shanxi, China
近年来,癌症患者的医疗总支出已经导致经济资源的巨大流失。据统计,我国每年多达1 500亿元用于对癌症的治疗(而不是预防上),每年死于癌症的人数超过160万,新发病例每年约220万人以上,癌症目前已是中国公共卫生的头号公敌[1-2]。肿瘤标记物是肿瘤(癌)细胞本身存在或分泌的特异性物质,绝大多数存在于恶性肿瘤中,其中肿瘤表面抗原是研究进展较快的指标之一[3-5]。癌胚抗原(CEA)是一个广谱性肿瘤标记物,能反映多种肿瘤的存在,对大肠癌、乳腺癌和肺癌的疗效判断、病情发展、监测和预后估计均有良好的应用价值[6]。因此,及时、准确地检测出血清中CEA的含量对肿瘤的预警及早期诊断具有重要意义。
免疫分析技术是以抗原-抗体的特异性结合为基础对肿瘤标记物进行定量检测的技术[7-9]。该技术融合了传感技术的高灵敏性和免疫反应的高选择性,具有现场检测、选择性高、操作简便和价格低廉等优点,现已广泛应用于疾病分析和诊疗等领域。电化学免疫传感器是在免疫分析技术的基础上,以电信号作为信号放大技术所构建的,它具有易于微型化、灵敏度高、易于自动化控制等特点,是检测肿瘤标记物的有力工具。纳米材料因具有独特的性质,广泛应用于探索具有超高灵敏度、超高选择性的电化学免疫分析方法,其中模拟酶纳米材料是免疫分析方面研究的重要领域,对于提高分析方法的灵敏度与准确性至关重要[10-12]。
本研究成功合成了碘化银(AgI)模拟酶纳米材料,并以其作为分子探针在电极表面构建夹心式免疫传感器。由于AgI的类过氧化酶活性可以催化四氯萘酚生成不溶物,使该不溶物沉积在电极表面,导致电极的电化学阻抗值增加,将其与肿瘤标记物建立对应关系,可用来检测CEA的浓度。
1 材料和方法 1.1 仪器与试剂多克隆鼠抗人CEA抗体(Ab,3.0 mg/mL)和CEA购自 Sigma-Aldrich公司;1-乙基-3,3-二甲基氨丙基碳化二亚胺(EDC)、壳聚糖(CS)、N-羟基丁二酰亚胺(NHS)和氯金酸(HAuCl4·4H2O)均购自Alfa公司;牛血清白蛋白(BSA,纯度:96%)购自德国Merck-Schuchardt 公司。其他试剂均为分析纯,实验用水均为二次蒸馏水。
CHI 660E电化学工作站购自上海辰华仪器有限公司;工作电极金(Au)电极,对电极铂丝电极,参比电极Ag/AgCl均购自武汉高仕睿联有限公司;紫外可见分光光度计UV-1800(1102 UV-vis)购自美析(中国)仪器有限公司;电子天平购自上海精密科学仪器有限公司(FA2004);透射电子显微镜(TEM,H600)购自日本Hitachi公司;H2050R高速台式冷冻离心机购自长沙湘仪离心机仪器有限公司。
1.2 CS修饰的AgI(CS-AgI)纳米颗粒的制备与表征CS-AgI纳米颗粒参照Chang等[13]的经典沉淀法合成获得。配制0.1 mol/L硝酸银(AgNO3)水溶液、0.5% CS水溶液和0.15 mol/L碘化钾(KI)水溶液,分别量取AgNO3水溶液和CS水溶液各20 mL,混合均匀,并在暗室中搅拌30 min;随后逐滴加入KI水溶液,继续在暗室中搅拌30 min,离心收集沉淀,二次蒸馏水清洗后超声清洗3~5 min,再次离心;重复上述清洗工作4~5次,洗去多余离子,最终得到CS-AgI纳米颗粒。分别使用TEM和傅里叶红外光谱仪对合成的CS-AgI的形态和官能团进行表征。
1.3 Ab和CS-AgI共轭复合物(Ab-CS-AgI)的制备用传统的碳化二亚胺交联方法将CS-AgI纳米颗粒标记在CEA抗体上。取2.2 mg NHS和3.0 mg EDC溶解在500 μL CS-AgI纳米颗粒水溶液中,室温下持续搅拌45 min;再加入100 μL Ab,缓慢搅拌12 h使Ab和CS-AgI充分交联在一起。离心去除多余的Ab和试剂,将制备的Ab-CS-AgI纳米标记物分散在1.0 mL磷酸盐缓冲液(PBS;0.1 mol/L,pH 7.4)中待用。
1.4 电化学免疫传感器分子探针的制备Au电极依次用0.3 μm和0.05 μm的氧化铝抛光粉打磨,再依次用丙酮、乙醇和水各超声清洗5 min,在空气中自然晾干待用。在干净的Au电极表面滴涂 L-半胱氨酸(L-Cys),室温下孵育4 h,使L-Cys通过金-硫(Au-S)键结合在电极表面;二次蒸馏水清洗后,把L-Cys功能化的Au电极浸泡在纳米金溶液中孵育4 h,得到Au/L-Cys/Au电极,其中金纳米颗粒通过Au-NH键结合在电极表面。之后将Au/L-Cys/Au电极浸泡在Ab中,4℃孵育过夜,制备得Ab/Au/L-Cys/Au电极;最后将获得的修饰电极浸入质量分数为3.0%的BSA溶液中孵育60 min,消除电极的非特异性吸附并封闭剩余的活性位点。制备所得分子探针Ab/Au/L-Cys/Au电极保存在冰箱中待用。
1.5 电化学检测所有的电化学检测均由上海辰华电化学工作站通过三电极系统采集得到。首先将上述制备的Ab/Au/L-Cys/Au电极在室温下分别置于不同浓度的CEA(0.1、0.5、1、5、10、50、80 ng/mL)溶液中孵育30 min,得到CEA/Ab/Au/L-Cys/Au电极;随后在Ab-CS-AgI溶液中孵育30 min,得到Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au电极;用二次蒸馏水清洗后,采用交流阻抗法记录响应信号。进一步对上述电极进行催化反应,在检测底液中加入过氧化氢(H2O2,5 mmol/L)和4-氯-1-萘酚(5 mmol/L),将Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au电极置于溶液中反应10 min后再记录交流阻抗值。交流阻抗实验(EIS)在5.0 mmol/L K3Fe(CN)6溶液(含有10 mmol/L KCl作为支持电解质)中进行,扫描电压频率变化范围 0.1~10 000 Hz。所有的电化学检测均在室温下进行,测量3次取平均值。
2 结果和讨论 2.1 CS-AgI纳米颗粒的表征对制备所得CS-AgI纳米颗粒进行TEM及红外光谱分析,由TEM图(图 1A)可见球形的CS-AgI纳米颗粒均匀分散在水溶液中,直径约为100 nm。通过红外光谱图(图 1B)可见,在3 448 cm-1处有1个羟基的特征吸收峰,同时在1 637 cm-1有1个酰胺基的特征吸收峰,表明CS被成功修饰在AgI纳米材料的表面。

|
图 1 CS-AgI纳米颗粒的透射电镜图(A)和红外光谱图(B) Fig 1 TEM images (A) and infrared spectrogram (B) of CS-AgI nanoparticles TEM: Transmission electron microscope; CS-AgI: Chitosan modified AgI |
2.2 修饰电极的电化学特性
不同修饰电极的线性扫描循环伏安曲线如图 2A所示。Au/L-Cys/Au (曲线b)电极的氧化还原峰值大于裸电极(曲线a),主要是由于纳米Au具有良好的导电性。当Ab和CEA分别依次固定在Au/L-Cys/Au电极表面后,Ab/Au/L-Cys/Au电极(曲线c)和 CEA/Ab/Au/L-Cys/Au电极(曲线d)的峰电流均逐渐下降,其原因可能是抗原和抗体都是大分子蛋白质,阻碍了电子的传递。然而,Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au 电极(曲线e)显示出良好的电化学性能,造成这种差异的原因可能是CS-AgI具有良好的导电性,可以促进电子传递。

|
图 2 不同修饰电极的循环伏安曲线(A)和交流阻抗曲线(B) Fig 2 The cyclic voltammetry curve (A) and AC impedance curve (B) of different modified electrodes a: Bare gold electrode; b: Au/L-Cys/Au; c: Ab/Au/L-Cys/Au; d: CEA/Ab/Au/L-Cys/Au; e: Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au; f: Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au catalyzed by 4-chloro-naphthol |
不同修饰电极的交流阻抗曲线(图 2B)与循环伏安曲线相对应,随着对电极的每一步修饰,电极的电化学阻抗发生了明显变化。同裸电极(曲线 a)相比,Au/L-Cys/Au电极(曲线b)的阻抗值减小,而依次组装抗体抗原后的Ab/Au/L-Cys/Au电极(曲线c)和CEA/Ab/Au/L-Cys/Au电极(曲线d)的阻抗增大;当捕获二抗固定到电极上后,Ab-CS-AgI/CEA/Ab/Au/L-Cys/Au电极(曲线 e)的阻抗值减小,这是由于CS-AgI作为导电性物质促进了电子的传递所致。发生催化反应后,电极阻抗(曲线f)进一步增加,其原因可能是AgI可以在H2O2存在的条件下催化四氯萘酚并生成不溶物沉积在电极表面,阻碍电子的传递,导致阻抗增大。
2.3 阻抗型电化学免疫传感器制备过程中实验条件的优化免疫传感器的性能受到 pH 的影响。考察pH 5.5~8.5的5 mmol/L K3Fe(CN)6 溶液中传感器的阻抗响应情况,在pH 5.5~7.0范围内,传感器的阻抗随pH增大而增大;而pH为7.0~8.5时,阻抗值逐渐减小(图 3A)。由于pH能影响CS的溶解性(pKa≈6.3),当溶液pH<pKa时,CS易溶解,而pH较高又会破坏其膜的结构,因此本实验中检测底液PBS的pH为7.0。

|
图 3 电化学免疫传感器制备过程中pH(A)和孵育时间(B)优化结果 Fig 3 The optimization of pH (A) and incubating time (B) during the preparation of electrochemical immunosensor ΔRet: The difference between response and background impedance values. n=3,±s |
温度对生物蛋白质分子的活性也有重要影响,考虑到传感器在未来的实际应用,本实验选择在室温(25.0±0.5)℃下进行。抗原-抗体的孵育时间也影响传感器的性能,孵育时间在10~30 min内时,传感器的阻抗值随时间的增加而增大,这是由于随着时间的推移抗原与抗体的结合量逐渐增大,因而阻抗明显增加。抗原-抗体孵育时间在30 min之后传感器的阻抗响应值趋于平衡(图 3B),表明抗原和抗体的结合达到了饱和。因此选择抗原-抗体的孵育时间为30 min。
2.4 CEA 的电化学阻抗谱测定通过检测不同浓度的CEA来考察构建的阻抗型电化学免疫传感器的性能,结果(图 4)可见电化学免疫传感器的交流阻抗响应值与CEA浓度(CCEA)的对数呈线性正相关,CCEA在0.1~80 ng/mL范围内其对数值时与阻抗差值ΔRet(ΔRet=响应阻抗值-背景阻抗值)呈现出较好的线性关系,线性回归方程为ΔRet=358.9+230.6 lg CCEA(r=0. 996),检测限为0.05 ng/mL。实验结果表明该阻抗型免疫传感器具有较宽的线性测量范围和较低的检测限。同时将该方法与传统的酶联免疫吸附分析(ELISA,检测限为5 ng/mL)[14]、放射免疫分析(RIA,检测限为5 ng/mL)[14]和化学发光法(ICA,检测限为0.5 ng/mL)[15]进行对比,可发现该阻抗型免疫传感器在进行CEA检测时具有较低的检测限。
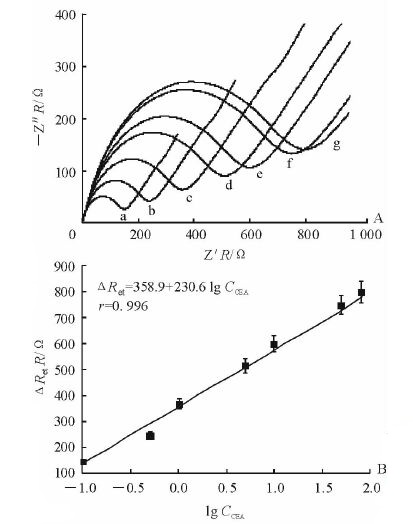
|
图 4 电化学免疫传感器对不同浓度CEA的阻抗曲线(A)和线性工作曲线(B) Fig 4 Impedance curves (A) and linear working curve (B) of sensor referring to different concentrations of CEA a-g: 0.1,0.5,1,5,10,50,and 80 ng/mL CEA,respectively. ΔRet: The difference between response and background impedance values. CEA: Carcinoembryonic antigen. n=3,±s |
2.5 阻抗型电化学免疫传感器的重现性、稳定性和特异性
可靠性、重现性、稳定性和选择性对于电化学免疫传感器性能的评价非常重要。本实验分别用批间和批内两种方法考察电化学免疫传感器的重现性。分别取同一批次和不同批次制备的4根电极测定0.5 ng/mL的CEA标准样品,每个样品平行测定 5 次,结果可见批次内及批次间的相对标准偏差分别为 5.7%和8.6%,表明构建的免疫传感器具有可重复性。此外,将制备的免疫传感器在4℃的条件下保存 20 d后再次检测,结果发现该传感器仍可以保留95%的电化学活性,表明构建的免疫传感器稳定性高。
免疫传感器构建的原理是利用抗原-抗体的结合实现其识别功能,结合方式的特异性赋予了免疫传感器独特的选择性。本实验以溶液中的小分子元素或人体中的其他蛋白质作为干扰成分,如 Mg2+、Cl-、葡萄糖(Glu)、甲胎蛋白(AFP)、前列腺特异抗原(PSA)、IgG和K+等,对构建的免疫传感器进行了特异性分析,结果发现只有CEA有响应。表明该免疫传感器能够用于检测特定的免疫分析物,选择性良好。
3 结 论本实验主要以CS-AgI 标记的 CEA抗体作为分子信标,构建了一种可行的阻抗型免疫传感器,用于检测CEA。和常规的酶标记抗体相比,AgI纳米颗粒表现出了优异的类过氧化物酶活性,此外,酶具有易改性、易失活的特点,而纳米材料可以避免这些缺陷。为进一步开放该免疫传感器的应用,我们未来将更加注重对其他目标蛋白和生物实际样品的分析。
| [1] | CHEN W, ZHENG R, BAADE P, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI: 10.3322/caac.21338 |
| [2] | PAVLOU M, DIAMANDIS E. The search for new prostate cancer biomarkers continues[J]. Clin Chem, 2009, 55: 1277–1279. DOI: 10.1373/clinchem.2009.126870 |
| [3] | ZHANG B, DING C. Displacement-type amperometric immunosensing platform for sensitive determination of tumour markers[J]. Biosens Bioelectron, 2016, 82: 112–118. DOI: 10.1016/j.bios.2016.03.053 |
| [4] | CHANG H, ZHANG H, LV J, ZHANG B, WEI W, GUO J. Pt NPs and DNAzyme functionalized polymer nanospheres as triple signal amplification strategy for highly sensitive electrochemical immunosensor of tumour marker[J]. Biosens Bioelectron, 2016, 86: 156–163. DOI: 10.1016/j.bios.2016.06.048 |
| [5] | HONG W, LEE S, CHO Y. Dual-responsive immunosensor that combines colorimetric recognition and electrochemical response for ultrasensitive detection of cancer biomarkers[J]. Biosens Bioelectron, 2016, 86: 920–926. DOI: 10.1016/j.bios.2016.07.014 |
| [6] | 杨长成, 王文涓, 高锋. 癌胚抗原相关黏附分子1与肿瘤[J]. 检验医学, 2014, 29: 877–883. |
| [7] | 刘红英, 朱俊杰. 金纳米簇信号放大的电化学免疫传感器[J]. 分析化学, 2013, 41: 658–663. |
| [8] | 刘仪, 刘婷知, 胡蓉, 白茹燕, 张坤蕾, 郑丽, 等. 基于Ag-Pt纳米颗粒标记型C-反应蛋白免疫传感器的研制[J]. 云南大学学报, 2015, 37: 888–895. |
| [9] | 陈学梅, 谢爱娟, 孔泳, 杨艳伟, 丁小峰, 周民. 基于聚吡咯修饰膨胀石墨电极的甲胎蛋白电化学免疫传感器[J]. 分析化学, 2013, 41: 1199–1203. |
| [10] | 王广凤, 朱艳红, 陈玲, 王伦. 功能性纳米材料在电化学免疫传感器中的应用[J]. 分析化学, 2013, 41: 608–615. |
| [11] | 董秀秀, 王宇, 沈玉栋, 孙远明, 王弘, 雷红涛, 等. 基于新型纳米材料的电化学免疫传感器及其在食品安全检测中的应用进展[J]. 中国食品学报, 2015, 15: 136–146. |
| [12] | LI M, WANG P, LI F, CHU Q, LI Y, DONG Y. An ultrasensitive sandwich-type electrochemical immunosensor based on the signal amplification strategy of mesoporous core-shell Pd@Pt nanoparticles/amino group functionalized graphene nanocomposite[J]. Biosens Bioelectron, 2017, 87: 752–759. DOI: 10.1016/j.bios.2016.08.076 |
| [13] | CHANG H, LV J, ZHANG H, ZHANG B, WEI W, QIAO Y. Photoresponsive colorimetric immunoassay based on chitosan modified AgI/TiO2 heterojunction for highly sensitive chloramphenicol detection[J]. Biosens Bioelectron, 2017, 87: 579–586. DOI: 10.1016/j.bios.2016.09.002 |
| [14] | 陈灿峰, 郑定容, 周伟. ICA和RIA及ELISA法测定CEA的比较[J]. 实用医技杂志, 2008, 15: 1390–1391. |
| [15] | HOU J Y, LIU T C, LIN G F, LI Z X. ZOU L P, LI M, et al. Development of an immunomagnetic bead-based time-resolved fluorescence immunoassay for rapid determination of levels of carcinoembryonic antigen in human serum[J]. Anal Chim Acta, 2012, 734: 93–98. DOI: 10.1016/j.aca.2012.04.044 |
 2016, Vol. 37
2016, Vol. 37


