肺表面活性相关蛋白A(surfactant-associated protein A,SP-A)是肺表面活性物质的重要组成成分,来源于Ⅱ型肺泡上皮细胞和Clara细胞,分泌至肺泡气液界面和细支气管表面,不仅维持着肺泡表面活性物质结构的稳定,还参与了肺组织中重要的免疫调节[1~2]。目前研究表明,SP-A可通过吞噬作用、中和反应等方式与机体多种免疫因子共同作用调节肺部炎症反应[3~5]。
棉鼠是一种主要分布于美洲的小型啮齿类实验动物,20世纪80年代首次引入我国。从最早用于脑脊髓灰白质炎的实验研究到目前广泛用于生命科学和医学领域的科学研究,棉鼠作为实验动物已有40余年的应用历史[6~7]。目前棉鼠已作为研究人类呼吸道疾病的理想动物模型,它对人类呼吸道病毒的易感性和特异性远超其他模式动物[8~10]。但目前国内外尚无棉鼠SP-A的基因序列及其生物信息学的相关报道,且有关棉鼠SP-A在机体肺损伤过程中的免疫功能和免疫调控也亟待进一步探究。为此,本研究探讨了棉鼠SP-A基因序列结构和生物信息学特点,观察棉鼠肺损伤模型中SP-A mRNA和蛋白的表达水平,初探SP-A表达规律与肺损伤的相关性,为探究肺损伤发病进程建立理想的动物模型、提供实验依据。
1 材料和方法 1.1 实验动物及处理4周龄SPF级棉鼠32只,体质量30~40 g (棉鼠种源由北京维通利华实验动物技术有限公司代购),随机均分为3个脂多糖(lipopolysaccharide,LPS)实验组和1个生理盐水对照组,每组8只。实验组棉鼠均腹腔注射给予2 mg/kg剂量的LPS溶液,再按LPS 处理24、48和96 h的3个不同时间点分为3个实验组;对照组给予注射相同剂量的生理盐水。所有动物实验均在重庆医科大学附属儿童医院动物实验中心完成[动物使用许可证号:SYXK(渝)2012-0015]。
1.2 主要试剂LPS和β-actin小鼠单抗AC-15购自Sigma公司;RT-PCR反转录试剂盒和BCA蛋白浓度测定试剂盒购自Thermo公司;总RNA提取试剂盒购自北京百泰克生物技术有限公司;SYBR○R Green qRT-PCR试剂盒购自KAPA biosysterm公司;蛋白酶抑制剂购自罗氏公司;SP-A兔多克隆抗体PA1458(该抗体为Boster公司生产,主要用于检测大、小鼠SP-A蛋白,是参照小鼠SP-A蛋白C端第233~248位氨基酸制备的兔源抗体,抗原氨基酸序列为:WNDKGCLQYRLAICEF,小鼠与大鼠的该抗原序列在第237位存在1个氨基酸差异,与棉鼠在第236位和第237位存在2个氨基酸差异)购自博士德生物公司;山羊抗兔荧光二抗C680和山羊抗鼠荧光二抗C800购自Lincoln公司。
1.3 SP-A基因的扩增通过查询和比对GenBank中多个物种间SP-A基因的序列,结合Primer5.0软件进行引物设计(F 5′-ATG TCA CTG TGT TCT TTG GCC-3′;R 5′-TCA AAA TTC ACA AAT GGC CAG-3′)。利用总RNA提取试剂盒提取棉鼠肺组织总RNA;再以总RNA为模板,利用反转录试剂盒合成cDNA;然后以cDNA为模板进行SP-A基因的PCR扩增。扩增条件为:预变性(94℃,3 min);循环扩增40次(94℃变性40 s,58℃退火45 s,72℃延伸45 s);延伸(72℃,5 min)。扩增结束后琼脂糖凝胶电泳检测PCR产物。
1.4 SP-A基因的生物信息学分析将所得的PCR扩增产物及与预期片段大小一致的样品送上海嘉根生物科技有限公司进行测序,所得测序结果采用Standard Nucleotide BLAST在线比对,检索GenBank中与测序所得核苷酸和预测氨基酸序列结果相近的物种,以确定所得序列为棉鼠SP-A基因序列。同时采用不同的生物信息学软件对该序列进行分析:采用Compute pI/Mw分析SP-A蛋白相对分子质量;采用SignalP version 4.1分析SP-A蛋白信号肽;采用GORⅣ分析SP-A氨基酸序列α螺旋结构;采用NetNGlyc version 1.0 分析SP-A氨基酸序列糖基化位点。
1.5 肺组织病理学分析实验组棉鼠在经2 mg/kg LPS分别处理24、48和96 h后置20% CO2盒内安乐死处死,解剖取肺组织保存于4%多聚甲醛溶液中,再取少许肺组织经脱水和包埋后,石蜡切片,然后H-E染色观察比较各组病理学特征。
1.6 SP-A mRNA表达水平检测在核酸浓度测定仪NanoDrop 2000上测定肺组织总RNA浓度后,各组样本均取相同浓度的RNA,经反转录后生成cDNA,然后以该cDNA作为反应模板,应用SYBR○R Green qRT-PCR试剂盒定量分析SP-A mRNA的表达水平。SP-A和内参β-actin的qRT-PCR扩增引物分别为:F 5′-CTG GCA GAG ATG GGC GAG AT-3′,R 5′-CAG GCT CTC CCT TGT CTC CAC-3′;F 5′-CCG TCT TCC CCT CCA TCG T-3′,R 5′-GCC TCG TCG CCC ACA TAG-3′。每个样本均做3个复孔,所得检测结果采用2-ΔCt法(ΔCt=CtSP-A-ΔCtβ-actin)进行定量分析。
1.7 SP-A蛋白表达检测将肺组织经加有蛋白酶抑制剂的RIPA缓冲液裂解后,用BCA试剂盒测定其蛋白总浓度。各组取蛋白量相同的样品,加入4×上样缓冲液混匀,沸水中煮5 min后行16% SDS-PAGE。电泳后将蛋白转移到硝酸纤维素膜上,并于含5%脱脂奶粉的缓冲液中封闭1 h;然后在稀释的多克隆抗体PA1458和AC-15抗体中4℃孵育过夜;次日孵育荧光二抗,最后应用双色荧光成像系统进行图像采集和蛋白表达的半定量分析。
1.8 统计学处理采用SPSS 17.0软件进行数据分析,运用GraphPad Prism 5.0软件作图;计量资料用x±s表示,组间SP-A的mRNA和蛋白水平比较均采用单因素方差分析(one-way ANOVA)。检验水准(α)为0.05。
2 结 果 2.1 棉鼠SP-A基因的序列分析和鉴定将PCR产物送生物公司测序,测序结果显示该片段长为744 bp,编码248个氨基酸,该片段长度与我们预期的棉鼠SP-A基因相符。为进一步确认该片段是否为棉鼠SP-A基因,再利用Standard Nucleotide BLAST软件对该片段进行在线比对,结果所得序列与GenBank中其他11个物种的SP-A基因在核苷酸水平的同源性在75.4%~90.1%之间,在氨基酸水平的同源性在70.2%~87.1%之间(表 1),其中尤其与金仓鼠(90.1%和87.1%)和小鼠(89.7%和86.3%)的SP-A基因同源性最高,由此推定扩增获得的序列为棉鼠SP-A基因。我们首次扩增所得的棉鼠SP-A基因序列已录入GenBank(序列号:KJ586796)。
|
|
表 1 棉鼠与其他11个物种SP-A基因序列同源性比较 Tab 1 Homology comparison of cotton rat SP-A gene seruence with other species |
2.2 棉鼠SP-A基因的生物信息学分析
利用Compute pI/Mw、SignalP version 4.1、NetNGlyc version 1.0和GOR Ⅳ等生物信息学软件对所得棉鼠SP-A基因序列进行分析,结果棉鼠SP-A基因开放阅读框含744个核苷酸,编码248个氨基酸,其中前17个氨基酸组成信号肽,预测蛋白相对分子质量为26 300。同时发现SP-A蛋白在4、26、155、224、238和246位氨基酸含6个保守的半胱氨酸位点;在21~24和207~210位氨基酸含2个N-糖基化位点。此外,SP-A蛋白在7~15、101~127、129~134和172~177氨基酸位点形成了4个α螺旋的二级结构(图 1),稳定的α螺旋约占总预测二级结构的19%。结果表明,SP-A基因是一个保守的基因,其蛋白结构相对稳定。

|
图 1 棉鼠SP-A基因的生物信息学分析 Fig 1 Bioinformatics analysis of SP-A gene between cotton rat and other species Conserved sequences with respect to cotton rat SP-A are indicated by dots. Dashes indicate missing residues. The arrow indicates the signal peptide cleavage site. The conserved cysteine residues are highlighted. The positions of α-helices are marked with single line. The boxed amino acids indicate potential N-glycosylation sites. SP-A: Surfactant-associated protein A |
2.3 肺组织病理学变化
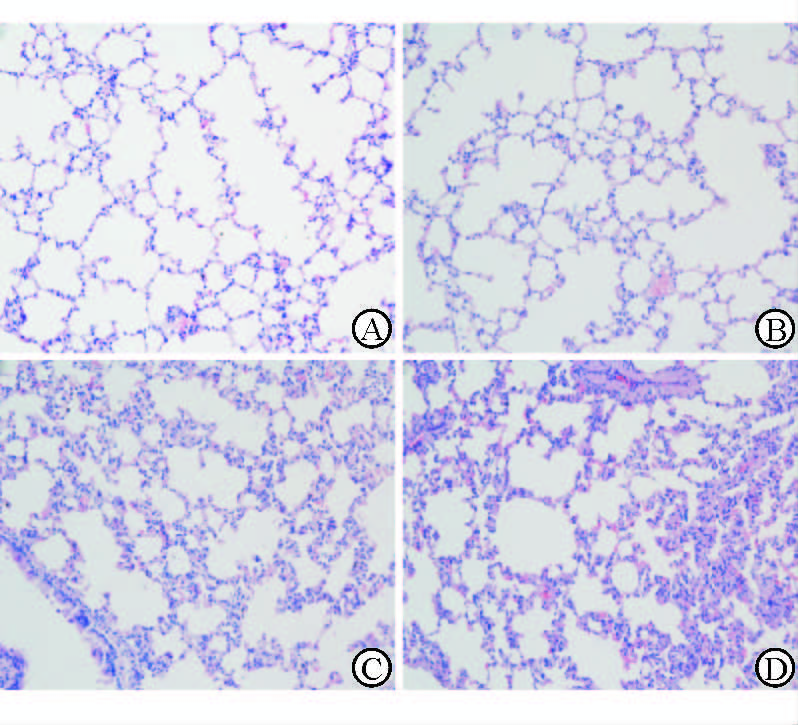
将实验组与对照组棉鼠的肺组织通过固定、脱水和包埋后,经石蜡切片和H-E染色,最后在显微镜下观察,比较各组棉鼠肺组织的病理学特征。结果显示对照组棉鼠肺组织纹理清晰,肺泡均匀,肺泡腔干净、无异常细胞浸润,组织无明显病理性改变(图 2A);而2 mg/kg LPS处理24、48和96 h的3个实验组棉鼠肺组织均呈现出不同程度的病理学改变,主要表现为肺泡壁增厚、肺泡腔变窄,甚至部分肺泡壁结构不清晰,同时伴有大量炎性细胞浸润,且随LPS刺激时间的延长,肺部组织的病理学改变逐渐加重(图 2B~2D)。
|
图 2 各组棉鼠肺组织病理学比较(H-E染色) Fig 2 Pathological changes of cotton rat lung tissues (H-E staining) A: Control group; B-D: 2 mg/kg LPS treatment for 24,48 and 96 h,respectively. Original magnification:×200 |
2.4 LPS对SP-A mRNA表达水平的影响
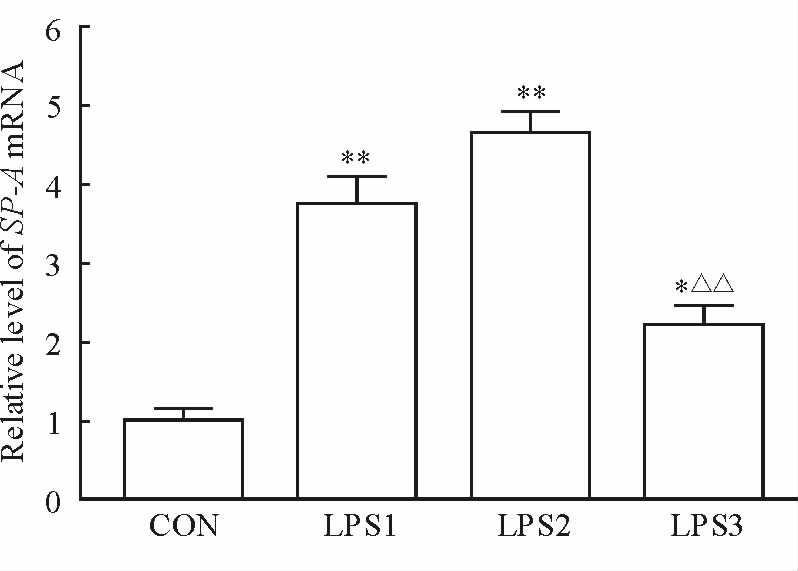
应用qRT-PCR方法检测实验组和对照组棉鼠肺组织中SP-A mRNA的表达水平。如图 3所示,与对照组相比,实验组棉鼠在用LPS处理24 h后肺组织中的SP-A mRNA的表达水平增加(P<0.01);持续处理48 h后,肺组织中的SP-A mRNA水平仍继续上升;持续处理96 h后,肺组织中的SP-A mRNA水平比48 h和24 h时下降(P<0.01),但仍高于对照组(P<0.05)。
|
图 3 LPS处理不同时间对肺组织SP-A mRNA表达的影响 Fig 3 The changes of relative level of SP-A mRNA in cotton rat lung tissues at different time points CON: Control group; LPS1-3: Three groups of 24,48 and 96 h after treatment with 2 mg/kg LPS. SP-A: Surfactant-associated protein A; LPS: Lipopolysaccharide. *P<0.05,**P<0.01 vs CON group; △△P<0.01 vs LPS1 group or LPS2 group. n=6,x±s |
2.5 LPS对SP-A蛋白表达的影响
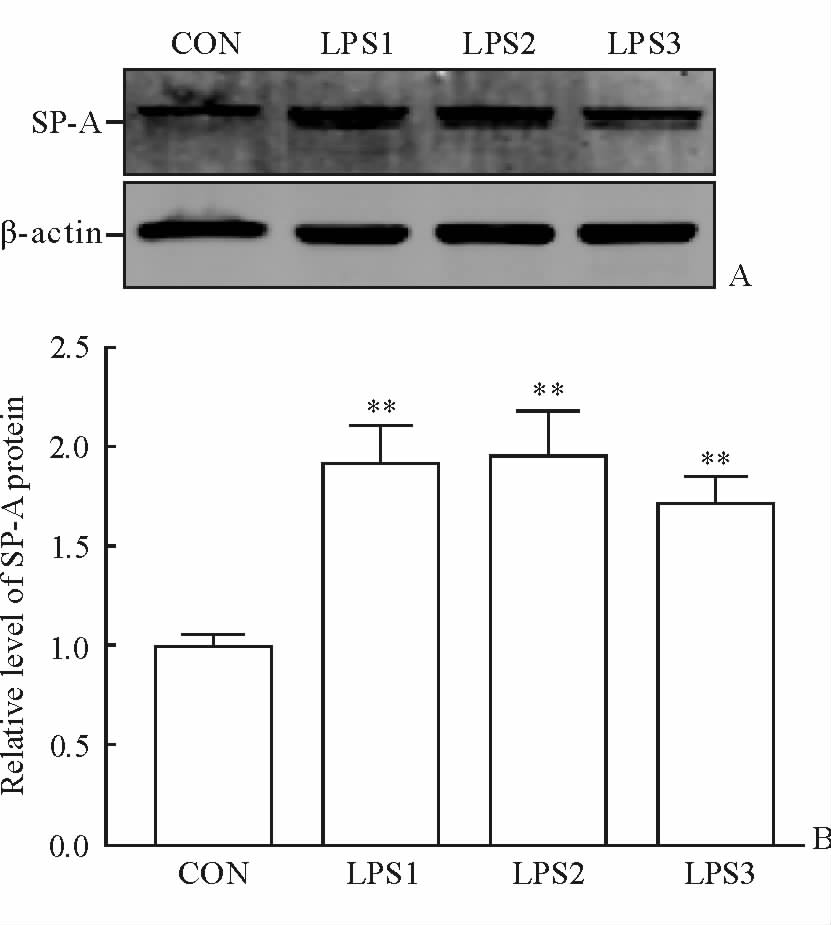
蛋白质印迹法检测结果如图 4所示,与对照组相比,24 h实验组棉鼠肺组织中SP-A蛋白的表达水平迅速增加(P<0.01),LPS连续处理48 h后SP-A蛋白的表达水平仍略有上升。当LPS处理96 h后,棉鼠肺组织中SP-A蛋白的表达水平相比24 h组和48 h组均略有下降(差异无统计学意义),但仍高于对照组(P<0.01)。结果表明利用SP-A抗小鼠多克隆抗体来检测棉鼠SP-A蛋白是有效可行的,也证明SP-A蛋白具有高度的保守性。
|
图 4 LPS处理不同时间对肺组织中SP-A蛋白表达的影响 Fig 4 The changes of SP-A protein in cotton rat lung tissues at different time points A: Detection of SP-A by Western blotting analysis; B: Relative expression level of SP-A protein. CON: Control group; LPS1-3: Three groups of 24,48 and 96 h after treatment with 2 mg/kg LPS. SP-A: Surfactant-associated protein A; LPS: Lipopolysaccharide. **P<0.01 vs CON group. n=8,x±s |
3 讨 论
SP-A不仅是肺表面活性物质中重要的一种,也是众多天然免疫分子中的一员,它除了具有维持机体正常呼吸的功能外,还在肺组织中发挥着特殊的局部免疫作用[2, 11]。SP-A可与多种病原微生物发生直接中和反应,并通过糖识别结构域与病原微生物的糖基特异性牢固结合,促发快速凝集反应[12]。同时,SP-A作为一种趋化因子,能迅速发挥趋化作用诱发多种免疫细胞发生趋化转移,并以Ca2+依赖方式促进免疫细胞对病原微生物的吞噬[13]。SP-A还可选择性地与吞噬细胞膜上的特定受体结合,这种结合不仅可介导吞噬细胞识别病原微生物,还可激发细胞内超氧自由基和一氧化氮的合成与释放,促进细胞发挥吞噬作用[14~15]。此外,SP-A还具有局部免疫调节作用,它能以剂量依赖方式来调控炎症介质和促炎性细胞因子的合成和释放,诱发机体的防御反应,从而避免因炎症反应的过度恶化造成的肺组织严重损伤,维持局部的免疫稳态[16~17]。因此,SP-A的异常表达水平从某种程度上体现了炎症反应强度、肺组织的损伤程度及疾病发生和发展的过程。因此,阐明SP-A在机体肺损伤过程中的免疫功能和免疫调控机制对呼吸道疾病的治疗具有重要的参考价值。
棉鼠是众多啮齿类实验动物模型中的一种,相比大鼠、小鼠而言目前对棉鼠生命科学领域的研究相对滞后,其可应用的科研领域和方向相对局限,但由于其对呼吸道病原体的易感性和敏感性远超于其他模式动物,使其成为呼吸道病毒相关研究公认的理想动物模型[9]。因而利用棉鼠建立肺损伤模型来研究SP-A与疾病的关系可能更具典型性和科学性,然而国内外尚无关于棉鼠SP-A的研究报道,且无检测棉鼠SP-A蛋白的特异性试剂盒。本研究从获得SP-A基因序列着手,分析SP-A基因序列的基本生物信息学构成,结果发现棉鼠与其他11个物种的SP-A基因具有高度同源性,尤其和小鼠SP-A的核苷酸序列同源性高达89.7%,这一结果为后期利用小鼠SP-A的部分氨基酸制备的抗体来检测棉鼠SP-A蛋白奠定了理论基础,也为后期实验的可行性提供了保障。本研究也表明,在生物物种进化过程中SP-A基因是一个相对保守的基因,SP-A基因这种保守性从某种程度上也表明其在机体内具有重要功能和作用。
肺损伤是多数呼吸系统疾病发生和发展的一个重要病理过程,常表现为大量炎症因子的释放以及强烈的炎症反应[18]。在病理学特点和发病机制上,LPS诱导的肺损伤与其他多种致病因素诱导的肺损伤均具有相似性。Sugahara等[19]在LPS诱导的大鼠肺损伤模型中发现,SP-A mRNA的表达水平在用LPS处理后明显增加。在人肺泡上皮细胞A549中也证实LPS处理可增加SP-A mRNA的表达水平,同时发现SP-A蛋白浓度与LPS处理存在时间依赖性[20]。因此本研究基于LPS诱导的肺损伤模型来探讨棉鼠SP-A的表达规律与疾病发生、发展的关系。本研究在棉鼠上成功构建肺损伤模型,且发现该动物模型肺组织的病理性病变程度与LPS处理时间有关,其病变主要表现为肺泡腔变窄和大量炎性细胞浸润;同时发现SP-A mRNA和蛋白的表达水平在LPS处理24 h后开始增加,48 h时持续上升并到达峰值,96 h时略有下降,但仍保持在较高水平。在该模型中肺组织的病理变化与SP-A mRNA和蛋白的表达水平均存在一定时间依赖性,且SP-A的水平与肺组织病理学改变的严重程度存在量效关系,SP-A在肺组织中的的表达水平在一定时间内反映了肺损伤病情的严重程度。可见棉鼠SP-A mRNA和蛋白表达水平反映了肺损伤的不同时程,可作为肺损伤病理进程的标志物之一,同时也为判断肺损伤病情严重程度提供了参考。
本研究首次扩增获得了棉鼠SP-A基因,并分析了其生物信息学结构,结果表明棉鼠SP-A基因具有高度保守性。研究同时发现棉鼠SP-A mRNA和蛋白的表达水平具有LPS刺激时间依赖性,且与肺损伤严重程度密切相关,反映了肺损伤的不同时程,证实了SP-A可作为肺损伤病理进程的标志物,但有关的表达调控机制还需继续深入研究。
| [1] | KISHORE U, GREENHOUGH T J, WATERS P, SHRIVE A K, GHAI R, KAMRAN M F, et al. Surfactant proteins SP-A and SP-D: structure, function and receptors[J]. Mol Immunol, 2006, 43: 1293–1315. DOI: 10.1016/j.molimm.2005.08.004 |
| [2] | WANG J Y, REID K B. The immunoregulatory roles of lung surfactant collectins SP-A, and SP-D, in allergen-induced airway inflammation[J]. Immunobiology, 2007, 212(4/5): 417–425. |
| [3] | 王谦, 宋勇. 肺表面活性蛋白A在急性肺损伤发病机制中作用的研究进展[J]. 中国急救医学, 2005, 25: 588–590. |
| [4] | JAKEL A, CLARK H, REID K B, SIM R B. The human lung surfactant proteins A (SP-A) and D (SP-D) interact with apoptotic target cells by different binding mechanisms[J]. Immunobiology, 2010, 215: 551–558. DOI: 10.1016/j.imbio.2009.09.005 |
| [5] | PANDIT H, MADHUKARAN S P, NAYAK A, MADAN T. SP-A and SP-D in host defense against fungal infections and allergies[J]. Front Biosci (Elite Ed), 2012, 4: 651–661. |
| [6] | NIEWIESK S, PRINCE G. Diversifying animal models: the use of hispid cotton rats (Sigmodon hispidus) in infectious diseases[J]. Lab Anim, 2002, 36: 357–372. DOI: 10.1258/002367702320389026 |
| [7] | GREEN M G, HUEY D, NIEWIESK S. The cotton rat (Sigmodon hispidus) as an animal model for respiratory tract infections with human pathogens[J]. Lab Anim (NY), 2013, 42: 170–176. DOI: 10.1038/laban.188 |
| [8] | BLANCO J C, PLETNEVA L, BOUKHVALOVA M, RICHARDSON J Y, HARRIS K A, PRINCE G A. The cotton rat: an underutilized animal model for human infectious diseases can now be exploited using specific reagents to cytokines, chemokines, and interferons[J]. J Interferon Cytokine Res, 2004, 24: 21–28. DOI: 10.1089/107999004772719873 |
| [9] | BOUKHVALOVA M S, PRINCE G A, BLANCO J C. The cotton rat model of respiratory viral infections[J]. Biologicals, 2009, 37: 152–159. DOI: 10.1016/j.biologicals.2009.02.017 |
| [10] | OTTOLINI M G, BLANCO J C, EICHELBERGER M C, PORTER D D, PLETNEVA L, RICHARDSON J Y, et al. The cotton rat provides a useful small-animal model for the study of influenza virus pathogenesis[J]. J Gen Virol, 2005, 86(Pt 10): 2823–2830. |
| [11] | REID K B. Functional roles of the lung surfactant proteins SP-A and SP-D in innate immunity[J]. Immunobiology, 1998, 199: 200–207. DOI: 10.1016/S0171-2985(98)80027-2 |
| [12] | HEINRICH S M, GRIESE M. Assessment of surfactant protein A (SP-A) dependent agglutination[J]. BMC Pulm Med, 2010, 10: 59. DOI: 10.1186/1471-2466-10-59 |
| [13] | BI X, TANEVA S, KEOUGH K M, MENDELSONHN R, FLACH C R. Thermal stability and DPPC/Ca2+ interactions of pulmonary surfactant SP-A from bulk-phase and monolayer IR spectroscopy[J]. Biochemistry, 2001, 40: 13659–13669. DOI: 10.1021/bi011188h |
| [14] | 王妍亭, 颜浩, 韩娟, 刘进衡. 肺表面活性蛋白A与肺部疾病关系的研究进展[J]. 实用心脑肺血管病杂志, 2016, 24: 1–4. |
| [15] | CARRETO-BINAGHI L E, ALIOUAT EL M, TAYLOR M L. Surfactant proteins, SP-A and SP-D, in respiratory fungal infections: their role in the inflammatory response[J]. Respir Res, 2016, 17: 66. DOI: 10.1186/s12931-016-0385-9 |
| [16] | KISHORE U, BERNAL A L, KAMRAN M F, SAXENA S, SINGH M, SARMA P U, et al. Surfactant proteins SP-A and SP-D in human health and disease[J]. Arch Immunol Ther Exp (Warsz), 2005, 53: 399–417. |
| [17] | SU X, LI Z, WANG M, WANG Q, LU W, LI X, et al. The protective effect of different airway humidification liquids to lung after tracheotomy in traumatic brain injury: the role of pulmonary surfactant protein-A (SP-A)[J]. Gene, 2016, 577: 89–95. DOI: 10.1016/j.gene.2015.11.024 |
| [18] | HUANG X, LIU Y, LU Y, MA C. Anti-inflammatory effects of eugenol on lipopolysaccharide-induced inflammatory reaction in acute lung injury via regulating inflammation and redox status[J]. Int Immunopharmacol, 2015, 26: 265–271. DOI: 10.1016/j.intimp.2015.03.026 |
| [19] | SUGAHARA K, IYAMA K, SANO K, KUROKI Y, AKINO T, MATSUMOTO M. Overexpression of surfactant protein SP-A, SP-B, and SP-C mRNA in rat lungs with lipopolysaccharide-induced injury[J]. Lab Invest, 1996, 74: 209–220. |
| [20] | CHUANG C Y, CHEN T L, CHEN R M. Molecular mechanisms of lipopolysaccharide-caused induction of surfactant protein-A gene expression in human alveolar epithelial A549 cells[J]. Toxicol Lett, 2009, 191(2/3): 132–139. |
 2016, Vol. 37
2016, Vol. 37


