2. 上海交通大学医学院仁济医院南院肿瘤介入科, 上海 201112
2. Department of Tumor Intervention, Renji Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 201112, China
在外科实践中,部分肝切除术(partial hepatectomy,PHx)后肝再生有利于恢复肝功能,预防肝衰竭[1~2]。本课题组在前期实验中发现细胞外基质降解酶——乙酰肝素酶(heparanase,HPSE)对大鼠PHx后肝再生具有正向调控作用[3],但其机制目前仍不清楚。为此,本研究以70%肝切除大鼠为肝再生模型,运用小干扰RNA(small interfering RNA,siRNA)抑制 HPSE表达,以探讨其调控肝再生的作用机制。
1 材料和方法 1.1 大鼠肝再生模型制备SPF级雄性SD大鼠,体质量250~300 g,由第二军医大学实验动物中心提供[动物生产许可证号:SCXK(沪)2013-0016]。按照Higgins和Anderson[4]的方法行70%肝切除。
1.2 HPSE siRNA的制备和转染实验用HPSE siRNA序列为:sense 5′-AGC UUC GUA CCU UGG CCA GTT-3′,antisense5′-CUG GCC AAG GUA CGA AGC UTT-3′(上海吉凯基因化学技术有限公司);转染试剂为in vivo-jetPEI-Gal (法国Polyplus公司)。试剂制备和转染方法同文献[3]。
1.3 实验分组将实验大鼠分为5组:对照组(Control组,无手术操作)、假手术组(Sham组,仅开关腹)、70%肝切除组(PHx组,仅行70%肝切除)、空载体组(PHx+vector组,于70%肝切除后立即从尾静脉注射不含siRNA的in vivo-jetPEI-Gal溶液1 mL/鼠)和siRNA干扰组(PHx+siRNA组,于70%肝切除后立即从尾静脉注射in vivo-jetPEI-Gal-siRNA复合物1 mL/鼠)。每组6只大鼠。肝切除后24 h处死所有大鼠,分别取肝组织进行相关检测。
1.4 免疫组化检测肝组织肝细胞生长因子(hepatocyte growth factor,HGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达将各组大鼠肝组织标本制成石蜡切片,按照厂家操作说明以enVision法(试剂盒购于丹麦DAKO公司)检测HGF和VEGF蛋白的表达,HGF抗体和VEGF抗体购于美国Santa Cruz公司;二抗染色后,在光镜下连续观察10个高倍视野,分别计数阳性细胞数;然后计算每100个细胞中的阳性细胞数;最后将各组数据以对照组为参照进行标准化,结果以各组与对照组的比值表示。
1.5 蛋白质印迹法检测肝组织基质金属蛋白酶(matrix metalloprotein,MMP)-2和MMP-9蛋白的表达检测按文献[3]方法进行,MMP-2抗体和MMP-9抗体购于美国Santa Cruz公司,最后以Fluor-S多功能成像系统及Quantity One软件(美国Bio-Rad公司)对发光条带进行扫描拍照和定量分析(以GAPDH为内参)。
1.6 肝组织微血管密度(microvessel density,MVD)检测以Ⅷ因子免疫组化染色(方法同1.4项,一抗为Ⅷ因子抗体,购自美国Santa Cruz 公司)标识肝组织微血管,然后进行计数:先用40倍光镜扫视整个切片,寻找高血管密度区域,然后在此区域内以200倍光镜随机取5个视野,计数每个视野中染成棕色的微血管数目,取其平均值。各组数据以对照组为参照进行标准化,结果以各组与对照组的比值表示。
1.7 统计学处理采用SPSS14.0软件进行数据处理。数据以x±s表示,独立样本t检验用于两样本间均数的比较,单因素方差分析用于多个样本间均数的比较。检验水准(α)为0.05。
2 结 果 2.1 HPSE siRNA对大鼠肝组织中HGF蛋白表达的影响免疫组化结果(图 1)显示,PHx组和PHx+vector组大鼠肝组织中HGF蛋白表达较Control组和Sham组增高(P<0.05),而PHx+siRNA组HGF蛋白的表达较其他组均降低(P<0.01),提示HPSE对大鼠肝组织中HGF蛋白的表达有正向调控作用。
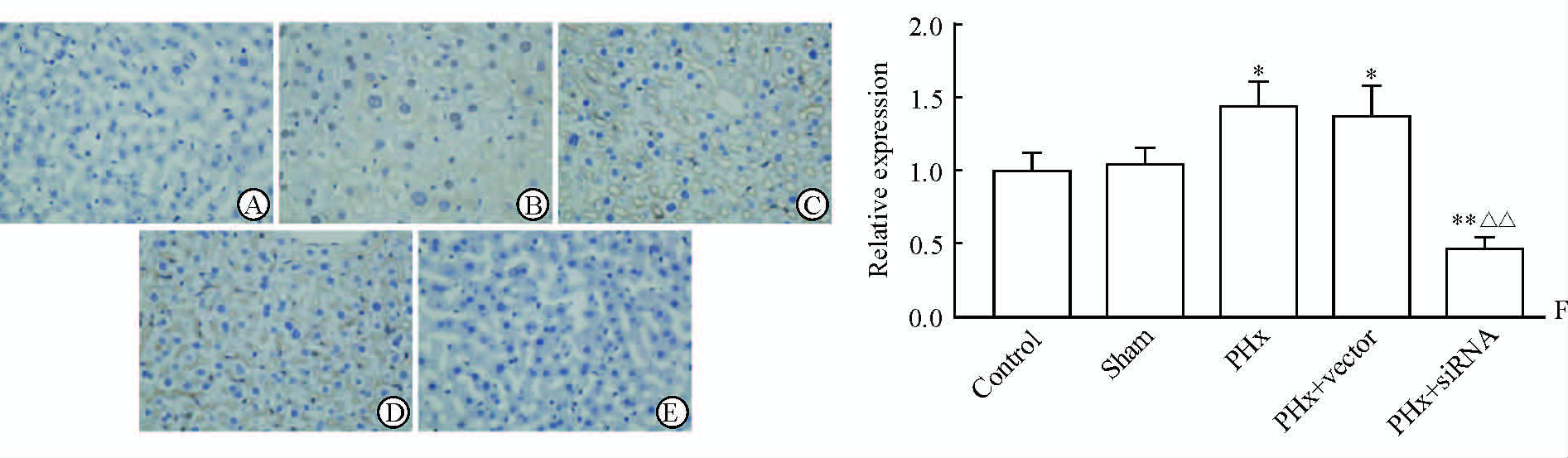
|
图 1 各组大鼠肝组织中HGF蛋白的表达(免疫组化) Fig 1 Expression of HGF in rat liver (immunohistochemistry) A: Control group; B: Sham group; C: PHx group; D: PHx+vector group; E: PHx+siRNA group; F: Relative expression compared to control group. HGF: Hepatocyte growth factor; PHx: Partial hepatectomy; siRNA: Small interfering RNA. Original magnification: ×400 (A-E). *P<0.05,**P<0.01 vs control and sham groups; △△P<0.01 vs PHx and PHx+vector groups. n=6,x±s |
2.2 HPSE siRNA对大鼠肝组织中VEGF蛋白表达的影响
免疫组化结果(图 2)显示PHx组和PHx+vector组大鼠肝组织中VEGF蛋白的表达较Control组和Sham组增高(P<0.05),而PHx+siRNA组VEGF蛋白的表达较其他组均降低(P<0.01),提示HPSE对大鼠肝组织中VEGF蛋白的表达有正向调控作用。
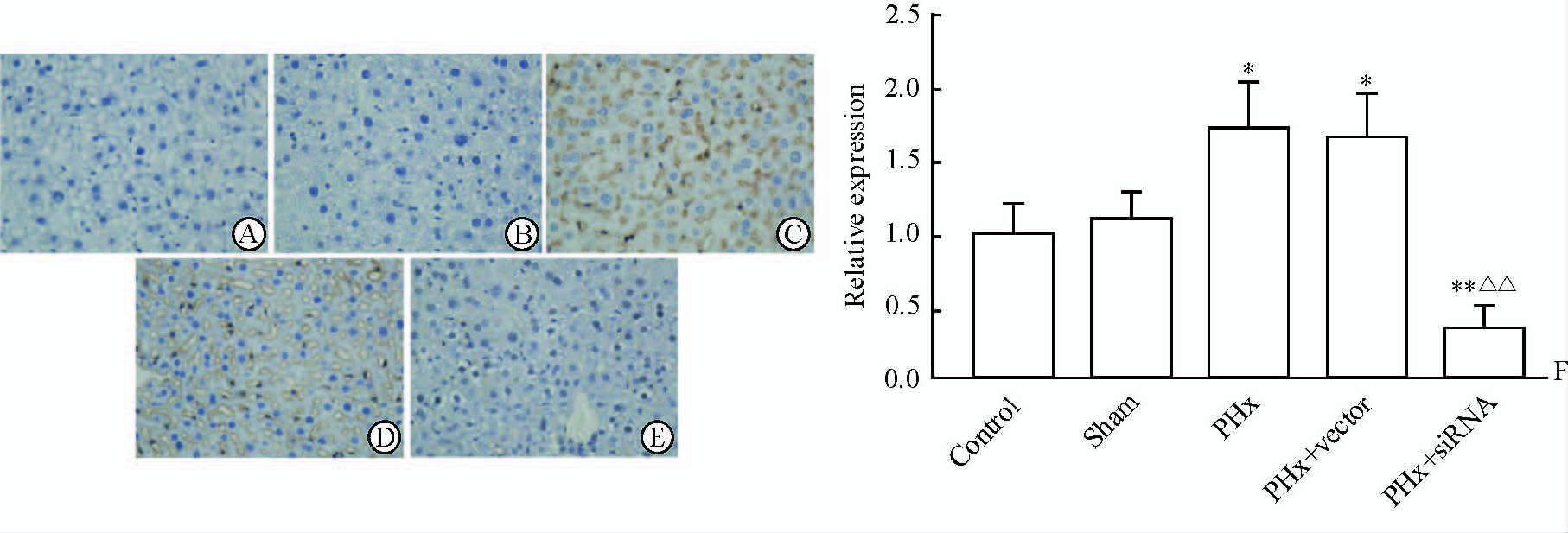
|
图 2 各组大鼠肝组织中VEGF蛋白的表达(免疫组化) Fig 2 Expression of VEGF in rat liver (immunohistochemistry) A: Control group; B: Sham group; C: PHx group; D: PHx+vector group; E: PHx+siRNA group; F: Relative expression compared to control group. VEGF: Vascular endothelial growth factor; PHx: Partial hepatectomy; siRNA: Small interfering RNA. Original magnification: ×400 (A-E). *P<0.05,**P<0.01 vs control and sham groups; △△P<0.01 vs PHx and PHx+vector groups. n=6,x±s |
2.3 HPSE siRNA对大鼠肝组织中MVD的影响
实验结果(图 3)显示PHx组和PHx+vector组大鼠肝组织中MVD较Control组和Sham组增高(P<0.05),而PHx+siRNA组的MVD较其他组均降低(P<0.01),提示HPSE对大鼠肝组织中的MVD有正向调控作用。
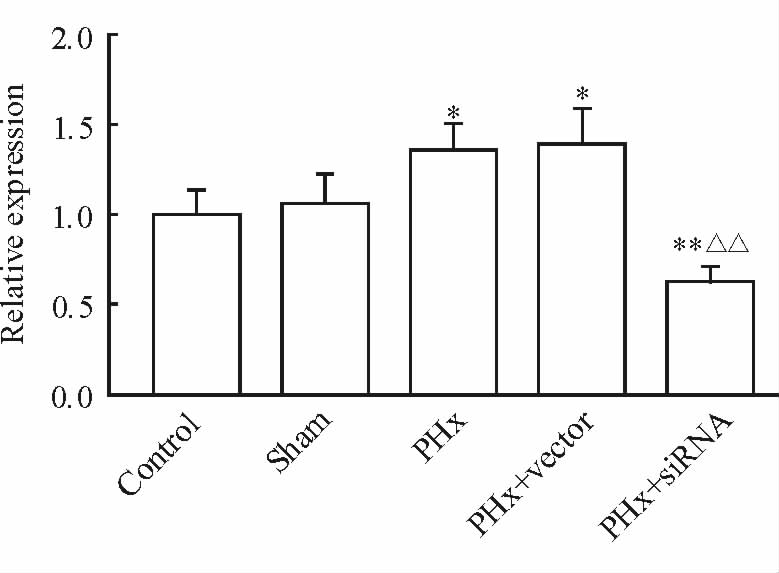
|
图 3 各组大鼠肝组织中的MVD(免疫组化) Fig 3 Expression of MVD in rat liver (immunohistochemistry) MVD: Microvessel density; PHx: Partial hepatectomy; siRNA: Small interfering RNA. *P<0.05,**P<0.01 vs control and sham groups; △△P<0.01 vs PHx and PHx+vector groups. n=6,x±s |
2.4 HPSE siRNA对大鼠肝组织中MMP-2和MMP-9蛋白表达的影响
PHx组和PHx+vector组大鼠肝组织中MMP-2和MMP-9蛋白表达较Control组和Sham组增高(P<0.01),而PHx+siRNA组MMP-2和MMP-9蛋白的表达较其他组均降低(P<0.01,图 4),提示HPSE对大鼠肝组织中MMP-2和MMP-9的表达有正向调控作用。

|
图 4 各组大鼠肝组织中MMP-2(A)和MMP-9(B)表达 Fig 4 Expression of MMP-2 (A) and MMP-9 (B) in rat liver MMP: Matrix metalloprotein; PHx: Partial hepatectomy; siRNA: Small interfering RNA. **P<0.01 vs control and sham groups; △△P<0.01 vs PHx and PHx+vector groups. n=6,x±s |
3 讨 论
研究表明肝脏再生与细胞外基质(ECM)密切相关,ECM降解重塑一方面能够为再生细胞提供排列骨架,另一方面能够促进肝细胞增殖[5]。HPSE是一种特异性糖苷内切酶,其降解底物是硫酸乙酰肝素,后者是ECM中的重要成分。HPSE能够通过参与ECM的降解和重塑、释放活化ECM中的各类生长因子、激活信号转导等多种机制在胚胎发育、组织修复等过程中发挥重要作用[6]。Carmel等[7]研究证实HPSE能够促进肝再生过程中肝细胞和内皮细胞的增殖。
HGF已被证实是最强有力的促肝细胞分裂原,也是启动肝再生的关键因子[8~9]。本研究发现 HPSE能够显著增加HGF活性蛋白的表达,提示HPSE可能通过HGF通路调控肝再生。Carmel等[7]报道 HPSE不能增加肝切除后的HGF mRNA表达水平,提示HPSE主要在蛋白质水平调控HGF的表达。其可能机制为正常 ECM中绑定有大量无活性的HGF前体蛋白,HPSE表达增加后,特异性水解ECM,将HGF前体蛋白释放,并对其进行剪切活化,使活性HGF蛋白大量增加[6],从而在肝切除后启动肝细胞再生过程中发挥作用。
血管生成是肝再生的重要条件之一[10~11],VEGF 是强效促血管生长因子。本研究发现,HPSE能够明显促进大鼠残肝VEGF的表达和增高MVD,提示HPSE可能通过促进血管生成调控肝再生。HPSE可通过3条途径促进血管生成:途径1是与HPSE水解酶活性相关的经典途径,即HPSE通过水解ECM释放和活化其中储存的各种生长因子,如VEGF和碱性成纤维生长因子(bFGF)等,从而刺激血管内皮细胞增殖和迁移,促进血管生成[12~13]。途径2是HPSE通过激活蛋白激酶B(Akt)途径刺激内皮细胞迁移,促进血管生成[14];另有研究发现HPSE能够通过激活p38磷酸化促进内皮细胞迁移和血管生成[15]。途径3是HPSE通过上调VEGF表达促进血管生成,研究发现无酶活性的HPSE能够上调VEGF mRNA和蛋白表达,其调控作用是通过激活Src家族成员的磷酸化实现的,给予Src磷酸化抑制剂可有效阻断这一通路[15~16]。途径2和途径3均是新近发现的不依赖于HPSE水解酶活性的新的通路,也是目前研究的热点。
已有实验证实MMP-2和MMP-9在肝再生中发挥重要作用,其表达增加能够促进肝再生[17]。本研究发现HPSE表达减少能够下调MMP-2和MMP-9的表达,提示HPSE可能通过MMP-2和MMP-9通路调控肝再生。Purushothaman等[18]研究发现,HPSE能够通过丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶(mitogenactivated protein kinase/extracelluar regulated protein kinase,MAPK/ERK)路径在mRNA水平调控MMP-2和MMP-9的表达,上调HPSE表达可促进ERK磷酸化,ERK磷酸化后MMP-2和MMP-9表达增加;而给予MAPK/ERK通路抑制剂阻断ERK磷酸化能够抑制MMP-2和MMP-9的表达;HPSE还能够促进尿激酶型纤维蛋白酶原激活剂及其受体 (urokinase-type plasminogen activator/urokinase-type plasminogen activator receptor,uPA/uPAR)的表达,后者对MMP-2和MMP-9的基质降解功能有协同作用,可共同促进肝再生。
综上所述,HPSE可能通过以下机制调控肝再生:(1)释放激活ECM中的HGF等生长因子,促进肝细胞增殖;(2)促进血管生成;(3)上调MMP-2和MMP-9的表达,促进肝再生。当然,肝再生是一个非常复杂的生物过程,其调控机制仍有待进一步深入探讨。
| [1] | YIN C, EVASON K J, ASAHINA K, STAINIER D Y. Hepatic stellate cells in liver development, regeneration, and cancer[J]. J Clin Invest, 2013, 123: 1902–1910. DOI: 10.1172/JCI66369 |
| [2] | DUNCAN A W, SOTO-GUTIERREZ A. Liver repopulation and regeneration: new approaches to old questions[J]. Curr Opin Organ Transplant, 2013, 18: 197–202. DOI: 10.1097/MOT.0b013e32835f07e2 |
| [3] | 张玉霞, 崔淑芳, 张友磊. 乙酰肝素酶siRNA对部分肝切除大鼠术后肝再生的抑制作用[J]. 肝胆外科杂志, 2014, 22: 311–313. |
| [4] | HIGGINS G M, ANDERSON R M. Experimental pathology of the liver: restoration of the liver of the white rat following partial surgical removal[J]. Arch Pathol, 1931, 12: 186–202. |
| [5] | KWON Y J, LEE K G, CHOI D. Clinical implications of advances in liver regeneration[J]. Clin Mol Hepatol, 2015, 21: 7–13. DOI: 10.3350/cmh.2015.21.1.7 |
| [6] | MEIROVITZ A, GOLDBERG R, BINDER A, RUBINSTEIN A M, HERMANO E, ELKIN M. Heparanase enzyme in inflammation and inflammation-associated cancer[J]. FEBS J, 2013, 280: 2307–2319. DOI: 10.1111/febs.12184 |
| [7] | CARMEL J, ARISH A, SHOSHANY G, BARUCH Y. Heparanase accelerates the proliferation of both hepatocytes and endothelial cells early after partial hepatectomy[J]. Exp Mol Pathol, 2012, 92: 202–209. DOI: 10.1016/j.yexmp.2012.01.002 |
| [8] | MICHALOPOULOS G K. Liver regeneration after partial hepatectomy: critical analysis of mechanistic dilemmas[J]. Am J Pathol, 2010, 176: 2–13. DOI: 10.2353/ajpath.2010.090675 |
| [9] | MICHALOPOULOS G K. Advances in liver regeneration[J]. Expert Rev Gastroenterol Hepatol, 2014, 8: 897–907. DOI: 10.1586/17474124.2014.934358 |
| [10] | UDA Y, HIRANO T, SON G, IIMURO Y, UYAMA N, YAMANAKA J, et al. Angiogenesis is crucial for liver regeneration after partial hepatectomy[J]. Surgery, 2013, 153: 70–77. DOI: 10.1016/j.surg.2012.06.021 |
| [11] | CHEN J A, SHI M, LI J Q, QIAN C N. Angiogenesis: multiple masks in hepatocellular carcinoma and liver regeneration[J]. Hepatol Int, 2010, 4: 537–547. DOI: 10.1007/s12072-010-9192-4 |
| [12] | ZHANG Y, WANG Y, FU Z, SHEN F. Heparanase, a key target for gene therapy against human malignancies[J]. ScientificWorldJournal, 2007, 7: 1965–1967. DOI: 10.1100/tsw.2007.313 |
| [13] | VREYS V, DAVID G. Mammalian heparanase: what is the message?[J]. J Cell Mol Med, 2007, 11: 427–452. DOI: 10.1111/jcmm.2007.11.issue-3 |
| [14] | GINGIS-VELITSKI S, ZETSER A, FLUGELMAN M Y, VLODAVSKY I, ILAN N. Heparanase induces endothelial cell migration via protein kinase B/Akt activation[J]. J Biol Chem, 2004, 279: 23536–23541. DOI: 10.1074/jbc.M400554200 |
| [15] | ZETSER A, BASHENKO Y, EDOVITSKY E. Heparanase induces vascular endothelial growth factor expression: correlation with p38 phosphorylation levels and Src activation[J]. Cancer Res, 2006, 66: 1455–1463. DOI: 10.1158/0008-5472.CAN-05-1811 |
| [16] | OHAYON O, MAWASI N, PEVZNER A, TRYVITZ A, GILDOR T, PINES M, et al. Halofuginone upregulates the expression of heparanase in thioacetamide-induced liver fibrosis in rats[J]. Lab Invest, 2008, 88: 627–633. DOI: 10.1038/labinvest.2008.30 |
| [17] | KIM T H, MARS W M, STOLZ D B, MICHALOPOULOS G K. Expression and activation of pro-MMP-2 and pro-MMP-9 during rat liver regeneration[J]. Hepatology, 2000, 31: 75–82. DOI: 10.1002/(ISSN)1527-3350 |
| [18] | PURUSHOTHAMAN A, CHEN L, YANG Y, SANDERSON R D. Heparanase stimulation of protease expression implicates it as a master regulator of the aggressive tumor phenotype in myeloma[J]. J Biol Chem, 2008, 283: 32628–32636. DOI: 10.1074/jbc.M806266200 |
 2016, Vol. 37
2016, Vol. 37


