2. 南方医科大学珠江医院血液内科, 广州 510280
2. Department of Hematology, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, Guangdong, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)为许多恶性血液病的治疗提供了根治手段[1]。尽管allo-HSCT技术已经取得了很大进展,但是因供受者主要或者次要组织相容性抗原存在差异引起的移植物抗宿主病(graft versus host disease,GVHD )仍然是影响移植后患者长期生活的主要障碍[2]。急性移植物抗宿主病(acute graft versus host disease,aGVHD)的发病率随着新的免疫抑制剂的使用已经得到了很好的控制,但是慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)的治疗仍然进展缓慢,严重影响患者的预后,cGVHD的发病机制不清楚是主要的原因[3]。建立能够模拟临床cGVHD发病过程的动物模型对于探讨cGVHD的发病机制尤为重要,同时也可为cGVHD的治疗提供理论基础。目前国内尚缺乏模拟临床采取化疗药物作为预处理方案的cGVHD动物模型及其定量评价体系,本实验模拟临床的移植过程,采取化疗的预处理方案建立此模型并进行评价。
1 材料和方法 1.1 试剂与仪器RPMI 1640培养基(美国Gibco公司),红细胞裂解液(Tris-NH4Cl),磷酸盐缓冲液(pH=7.4),FITC-H-2kbmAb、APC-H-2kdmAb(Becton Dickinson公司,美国),高压灭菌消毒器,玻璃注射器针芯,普通光学显微镜,高速台式离心机(Heermle Z323k,USA),CytoFLEX流式细胞仪(Beckman公司,美国),洁净工作台,眼科剪,200 目不锈钢筛网,止血钳,镊。
1.2 实验动物SPF级健康雄性BALB/cH-2kd小鼠70只,8~12周龄,体质量 18~22 g,作为供鼠。SPF级健康雌性C57BL/6H-2kb小鼠80只,8~12周龄,体质量 18~22 g,作为受鼠。受鼠在移植前1周开始饮用含3.2×105 U/L庆大霉素和250 mg/L红霉素的灭菌溶液,无菌饲养于洁净的饲养柜中。所有供、受体小鼠均购自南方医科大学动物实验中心,SPF级,动物使用许可证号:SYXK(粤)2011-0074。实验于2015年4月至2015年10月在南方医科大学动物实验中心完成,实验过程中对动物的处置符合医学伦理学标准[4]的实验方法。
1.3 建模方法 1.3.1 实验动物分组根据减低强度(reduced-intensity conditioning,RIC)预处理方案的不同,分为RIC-1预处理方案和RIC-2预处理方案。每一种预处理方案根据输注的细胞数不同,将受鼠按照随机数字表法分为4组,分别为2×107个骨髓细胞组、2×107个骨髓细胞+6×107个脾细胞组、2×107个骨髓细胞+4×107个脾细胞组、空白对照组,每组10只小鼠。
1.3.2 移植前预处理采用化疗药物对受鼠进行预处理。RIC-1:白消安20 mg/(kg·d)×4 d,在细胞移植前4~7 d给予;环磷酰胺150 mg/(kg·d)×2 d,在细胞移植前2~3 d给予。RIC-2:白消安20 mg/(kg·d)×4 d,在细胞移植前4~7 d给予;环磷酰胺100 mg/(kg·d)×2 d,在细胞移植前2~3 d给予。停药后间隔24 h进行细胞移植。
1.3.3 移植细胞制备和GVHD诱导取供鼠脱颈处死,用75%乙醇消毒5 min,无菌切取股骨、胫骨、腓骨及脾脏。将股骨、胫骨、腓骨剪开两端骨骺,用注射器吸取RPMI 1640培养液反复冲洗髓腔,将冲出的所有供鼠的骨髓细胞合并后通过200目筛网形成单细胞悬液,再采用淋巴细胞分离液分离单个核细胞,制成悬液。用不含血清的RPMI 1640培养液洗涤2次,计数细胞并调成所需细胞密度 (1×108/mL) 备用。将脾脏剪成小块后在200目筛网上用注射器针芯轻轻研磨,同时用RPMI 1640培养液冲洗过滤形成单细胞悬液,离心后去上清液,用Tris-NH4C1溶液溶解红细胞,同样用不含血清的RPMI 1640培养液洗涤2次,计数细胞并调成所需细胞密度(1×108/mL)备用。根据各分组要求输注的细胞数不同,调整好每只受鼠输入细胞悬液的体积,经尾静脉注入受鼠体内,输注的总体积不超过0.5 mL。空白对照组在采用不同的预处理方案后,输入等体积的RPMI 1640培养液。
1.4 模型的评价 1.4.1 嵌合体分析细胞移植后第2、5、8、12周,每组随机抽取2只受鼠,摘眼球取血,采用FITC-H-2kbmAb(受者型)和APC-H-2kdmAb(供者型)单克隆抗体作为双标染色受鼠脾细胞,上流式细胞仪进行嵌合体分析。供鼠染色体占受鼠染色体15%以上为植入,即形成嵌合体。
1.4.2 cGVHD临床评分细胞移植18 d后,对受体小鼠的临床表现每3 d进行1次评分,主要观察小鼠的体质量、腹泻情况、姿势、活动度、脱毛情况及生存情况。评分标准参照相关文献的评分系统[5~8]。
1.4.3 组织病理学观察细胞移植后第2、5、8、12周,每组随机抽取2只受鼠,摘眼球取血后,取小鼠肝脏、脱毛部分皮肤、肠、脾脏,用10%甲醛固定,石蜡包埋,常规切片,苏木精-伊红染色,光镜下观察。
1.5 统计学处理应用SPSS 15.0软件进行统计分析。计量数据以x±s表示,采用单因素方差分析比较各组间的差异;计数资料以百分率(%)表示,采用χ2检验比较各组之间的差异。检验水准(α)为0.05。
2 结 果 2.1 嵌合体分析双标染色体结果显示,输注2×107个骨髓细胞+6×107 个脾细胞时,采用RIC-1预处理方案较RIC-2预处理方案能形成更稳定的高水平嵌合体;采用同一预处理方案时,输注2×107个骨髓细胞+6×107 个脾细胞与2×107个骨髓细胞+4×107 个脾细胞均能形成较稳定的嵌合体,而输注2×107个骨髓细胞组未能形成嵌合体。随着移植时间的延长,嵌合体的比例也升高。见图 1。
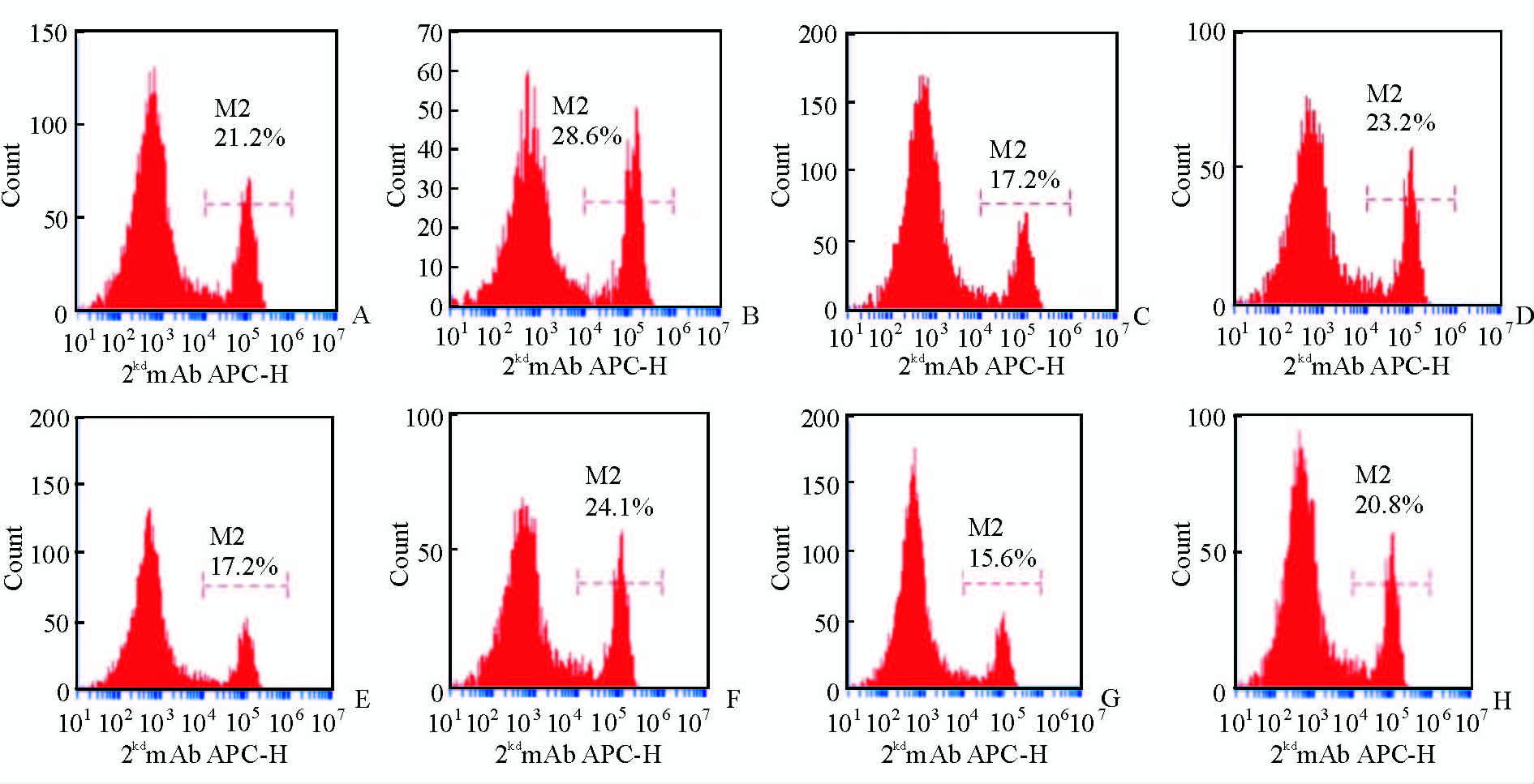
|
图 1 移植后不同预处理方案及不同时间段供受鼠细胞嵌合体比例 Fig 1 Chimeric ratio in different conditioning regimens at different time points after transplantation in donor mice A,B: Injecting 6×107 spleen cells+2×107 bone marrow cells for 8 weeks (A) and 12 weeks (B) followed by busulfan (BU) 20 mg/(kg·d)×4 d + cyclophosphamide (CTX) 150 mg/(kg·d)×2 d preconditioning; C,D: Injecting 4×107 spleen cells+2×107 bone marrow cells for 8 weeks (C) and 12 weeks (D) followed by BU 20 mg/(kg·d)×4 d + CTX 150 mg/(kg·d)×2 d preconditioning; E,F: Injecting 6×107 spleen cells+2×107 bone marrow cells for 8 weeks (E) and 12 weeks (F) followed by BU 20 mg/(kg·d)×4 d + CTX 100 mg/(kg·d)×2 d preconditioning; G,H: Injecting injected 4×107 spleen cells+2×107 bone marrow cells for 8 weeks (G) and 12 weeks (H) followed by BU 20 mg/(kg·d)×4 d + CTX 100 mg/(kg·d)×2 d preconditioning |
2.2 cGVHD临床评分
各组小鼠活动度、皮肤脱毛情况、体质量减轻、腹泻及弓背姿势之间的比较结果提示,cGVHD的发生时间多集中在细胞移植后的30~90 d。根据评分标准,采用RIC-1预处理方案时,2×107个骨髓细胞+6×107个脾细胞组和2×107个骨髓细胞+4×107 个脾细胞组小鼠cGVHD的发生率分别为72%和64%,差异有统计学意义(P<0.05);采用RIC-2预处理方案时,2×107个骨髓细胞+6×107个脾细胞组和2×107个骨髓细胞+4×107 个脾细胞组小鼠cGVHD的发生率分别为67%和56%,差异有统计学意义(P<0.05)。2×107个骨髓细胞组未发生cGVHD。各组发病的小鼠主要表现为静止性弓背,刺激状态下活动性明显降低,皮肤表面脱毛以局部脱毛为主,腹泻发生情况较少。总体来说,在同一预处理方案下,输注细胞数高的移植组小鼠的临床评分高于输注细胞数少的移植组(P<0.05);在相同移植细胞数量的情况下,化疗药物剂量大的预处理方案处理后小鼠的临床评分高于化疗药物剂量小的预处理方案(P<0.05)。见表 1。
|
|
表 1 移植后第8周各组cGVHD小鼠的临床评分 Tab 1 Clinical score of rats with chronic graft-versus-host disease (cGVHD) at the 8th week after cell transplanting |
2.3 组织病理学观察
cGVHD小鼠肠道病理表现为肠壁肌细胞肥大,脂肪细胞减少,单核细胞及淋巴细胞浸润(图 2A);肝脏病理表现为肝细胞水肿,细胞排列紊乱呈条索状,汇管区小灶状坏死及炎症细胞浸润(图 2B);皮肤病理表现为皮下胶原沉积,炎性细胞浸润,脂肪层变薄(图 2C);脾脏病理表现为脾细胞排列紊乱,脾小结消失,大量的炎性细胞浸润(图 2D)。
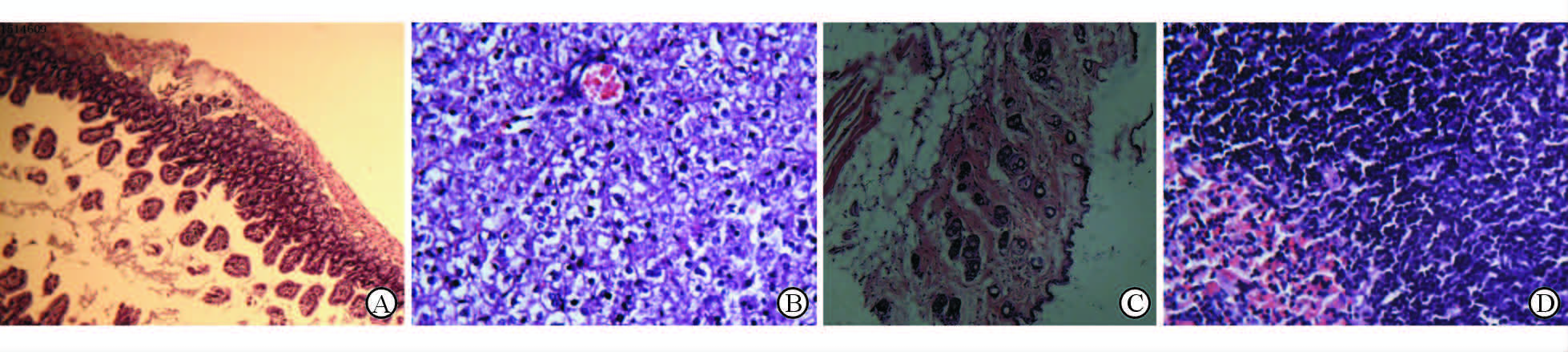
|
图 2 慢性移植物抗宿主病小鼠肠(A)、肝脏(B)、皮肤(C)和脾脏(D)病理改变 Fig 2 Pathological changes of the mouse intestinal (A),liver (B),skin (C),and spleen (D) All of the specimens are from RIC-1,2×107 bone marrow cell+6×107 spleen cell transplant group. H-E staining.Original magnification: ×40 |
3 讨 论
建立能够模拟临床allo-HSCT cGVHD发病过程的动物模型对于探讨cGVHD的发病机制及预防其发生的策略具有重要意义。邓兰等[9]通过照射的预处理方案建立了MHC半相合的cGVHD模型,与Fujii等[10]的研究结果相类似。吴远彬等[11]以及Eisenberg和Via[12]建立的单倍体cGVHD模型均采取了简化的预处理方案和直接输注脾细胞的方式,此种建模方式与临床实际存在一定的出入。贺信等[13]采取将C57BL/6H-2kb小鼠的骨髓及脾细胞移植给BALB/cH-2kd的移植方式建立了allo-HSCT aGVHD模型,为本研究建立cGVHD模型提供了很好的实验基础。本研究模型与之相比,同样是采取脾细胞加骨髓的输注方式,但是增加了细胞数,骨髓细胞为2×107个,脾细胞为6×107或4×107 个,同时模拟临床采用化疗作为预处理的方式建模,更符合实际应用。BALB/cH-2kd及C57BL/6H-2kb是两种具有不同遗传背景的小鼠[9],本研究采取将BALB/cH-2kd移植给C57BL/6H-2kb的方式建立allo-HSCT cGVHD模型,嵌合体分析、临床评分及组织病理学表现均提示allo-HSCT cGVHD模型建立成功。移植细胞数高的移植组小鼠的临床评分和cGVHD的发生率均高于移植细胞数少的移植组,说明cGVHD的发生和来源与供者的T细胞及数量有很大关系,这与Fujii等[10]的研究结果相符合。
在临床上,对于一些难治性复发的儿童白血病患者,化疗失败后采取移植是治疗方式之一[14]。基于此,我们的cGVHD动物模型的预处理方案采取白消安+环磷酰胺化疗模式。实验表明白消安20 mg/(kg·d)×4 d、在细胞移植前4~7 d给予,环磷酰胺150 mg/(kg·d)×2 d、在细胞移植前2~3 d给予,并输注数量较大的骨髓细胞及脾细胞,可以建立比较稳定的cGVHD模型。相较于半相合的cGVHD小鼠模型,此种allo-HSCT cGVHD模型能更好地模拟临床cGVHD的发生过程,为探讨预防和治疗cGVHD的策略及cGVHD的发病机制提供了实验平台。
| [1] | APPELBAUM F R. Haematopoietic cell transplantation as immunotherapy[J]. Nature, 2001, 411: 385–389. DOI: 10.1038/35077251 |
| [2] | JOFFRE O, VAN MEERWIJK J P. CD4+CD25+ regulatory T lymphocytes in bone marrow transplantation[J]. Semin Immunol, 2006, 18: 128–135. DOI: 10.1016/j.smim.2006.01.005 |
| [3] | PEFFAULT DE LATOUR R. Transplantation for bone marrow failure: current issues[J]. Hematology Am Soc Hematol Educ Program, 2016(1): 90–98. |
| [4] | SIMPSON E, SCOTT D, JAMES E, LOMBARDI G, CWYNARSKI K, DAZZI F, et al. Minor H antigens: genes and peptides[J]. Transpl Immunol, 2002, 10(2/3): 115–123. |
| [5] | KAPLAN D H, ANDERSON B E, MCNIFF J M, JAIN D, SHLOMCHIK M J, SHLOMCHIK W D. Target antigens determine graft-versus-host disease phenotype[J]. J Immunol, 2004, 173: 5467–5475. DOI: 10.4049/jimmunol.173.9.5467 |
| [6] | ANDERSON B E, MCNIFF J M, JAIN D, BLAZAR B R, SHLOMCHIK W D, SHLOMCHIK M J. Distinct roles for donor- and host-derived antigen-presenting cells and costimulatory molecules in murine chronic graft-versus-host disease: requirements depend on target organ[J]. Blood, 2005, 105: 2227–2234. DOI: 10.1182/blood-2004-08-3032 |
| [7] | MATTE C C, LIU J, CORMIER J, ANDERSON B E, ATHANASIADIS I, JAIN D, et al. Donor APCs are required for maximal GVHD but not for GVL[J]. Nat Med, 2004, 10: 987–992. DOI: 10.1038/nm1089 |
| [8] | ANDERSON B E, MCNIFF J M, MATTE C, ATHANASIADIS I, SHLOMCHIK W D, SHLOMCHIK M J. Recipient CD4+ T cells that survive irradiation regulate chronic graft-versus-host disease[J]. Blood, 2004, 104: 1565–1573. DOI: 10.1182/blood-2004-01-0328 |
| [9] | 邓兰, 郭坤元, 尹晓琳, 李玉华, 吴岚晓. MHC半相合骨髓移植后慢性GVHD小鼠模型的建立[J]. 免疫学杂志, 2005, 21: 306–312. |
| [10] | FUJII H, LUO Z J, KIM H J, NEWBIGGING S, GASSAS A, KEATING A, et al. Humanized chronic graft-versus-host disease in NOD-SCID il2rγ-/- (NSG) mice with G-CSF-mobilized peripheral blood mononuclear cells following cyclophosphamide and total body irradiation[J/OL]. PLoS One, 2015, 10: e0133216. doi: 10.1371/journal.pone.0133216. |
| [11] | 吴远彬, 郭坤元, 陆志刚, 周健, 宋朝阳, 吴秉毅, 等. 单倍体相合造血干细胞移植后慢性移植物抗宿主病小鼠模型的建立及评价[J]. 中国组织工程研究与临床康复, 2008, 12: 2326–2330. |
| [12] | EISENBERG R A, VIA C S. T cells, murine chronic graft-versus-host disease and autoimmunity[J]. J Autoimmun, 2012, 39: 240–247. DOI: 10.1016/j.jaut.2012.05.017 |
| [13] | 贺信, 许晓军, 王静, 伊文芳, 叶永斌, 黄宇贤, 等. 白消安联合环磷酰胺诱导小鼠急性移植物抗宿主病模型的建立[J]. 细胞与分子免疫学杂志, 2015, 31: 1637–1642. |
| [14] | NABHAN C, MEHTA J, TALLMAN M S. The role of bone marrow transplantation in acute promyelocytic leukemia[J]. Bone Marrow Transplant, 2001, 28: 219–226. DOI: 10.1038/sj.bmt.1703119 |
 2016, Vol. 37
2016, Vol. 37


