2. 南昌大学第一附属医院肝胆胰外科, 南昌 330000
2. Department of Hepatobiliary and Pancreatic Surgery, the First Affiliated Hospital of Nanchang University, Nanchang 330000, Jiangxi, China
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见的恶性肿瘤之一,其死亡率位居我国常见恶性肿瘤死亡率的第2位[1]。肝切除是治疗HCC的有效方法,分为解剖性肝切除(anatomic liver resection,AR)和非解剖性肝切除(non-anatomic liver resection,NAR)[2~3]。AR依据肝脏解剖学特点,行肝段、肝叶、半肝或肝三叶范围切除;而NAR主要根据病变范围而定,行肝楔形切除、局限性肝切除。有关两种手术方法对HCC预后的影响目前存在争议[4~7]。本研究应用倾向值匹配(propensity score-matching,PSM)法减少回顾性研究中的选择偏倚,均衡了两种方法中对预后有重要影响的协变量,就AR和NAR对HCC治疗的疗效作一客观评价。
1 资料和方法 1.1 一般资料回顾性分析2010年1月至2015年12月期间在南昌大学第一附属医院住院并接受肝切除术的HCC患者的临床资料,共计124例。根据手术方式不同,分为AR组64例和NAR组60例。病例纳入标准:(1)肝癌的首次治疗为肝切除术;(2)肝功能Child-Pugh评分A级或B级;(3)病理诊断为HCC。排除标准:(1)术前接受过经肝动脉化疗栓塞术、射频消融或其他抗肿瘤治疗;(2)合并门静脉主干及一级分支、总肝管及一级分支、肝静脉主干及下腔静脉癌栓;(3)肝外转移;(4)同期罹患其他器官恶性肿瘤或其他严重疾病;(5)肝癌破裂;(6)肝癌复发。本研究获得医院伦理委员会批准,并取得患者知情同意。
1.2 诊断标准及随访方法HCC的临床诊断标准符合原发性肝癌诊疗规范(2011年版)[8],HCC和肝硬化的诊断均由术后病理证实;结合影像学检查,将重度肝硬化定义为:肝脏形态比较规则,边缘呈小结节状和(或)轻度波浪状,质地不均匀、呈弥漫颗粒状,肝叶比例基本正常,肝裂正常或增宽[9];肝癌复发包括肝内和肝外复发,复发定义为:CT或MRI发现肝内外新发病灶,或者甲胎蛋白水平持续性升高。患者出院后每3个月随访1次,随访截止时间为2016年4月30日。
1.3 PSM法PSM法是利用非随机对照数据进行干预效应评估时的一种非常实用的统计学方法,可使组间协变量平衡分布,减少混杂因素对研究结果的影响。本研究以AR组为基准,按1∶2 邻距法(nearest neighbor matching)进行匹配,卡钳值为0.2[10],在保证匹配后组间均衡性的同时,最大限度减少了未匹配成功的研究对象数量。进入倾向评分模型的协变量有:性别、年龄、术前血红蛋白、术前血小板、术前凝血酶原时间、术前白蛋白、术前总胆红素、术前丙氨酸转氨酶(ALT)、术前天冬氨酸转氨酶(AST)、术前甲胎蛋白、术前乙型肝炎病毒DNA水平、乙型肝炎表面抗原、术中出血量、肝癌病理分级、肿瘤直径、肿瘤数量、肿瘤包膜、脉管癌栓、肝硬化、重度肝硬化、巴塞罗那临床肝癌(Barcelona clinic liver cancer,BCLC)分期。
1.4 统计学处理采用SPSS 21.0软件进行数据的统计分析,计量资料用±s表示,组间比较采用t检验;计数资料用例数(百分比)表示,组间率的比较采用χ2检验;总体生存率用Kaplan-Meier法估计,两组间差异用Log-rank检验进行比较;预后影响因素分析采用Cox比例风险模型。检验水准(α)为0.05。
2 结 果 2.1 两组患者匹配前后基线资料分布情况匹配前共计124例HCC患者纳入研究,在所收集的21个协变量中,性别、重度肝硬化、肿瘤包膜、肿瘤数量、脉管癌栓和BCLC分期6个协变量在组间分布不平衡(P<0.05,表 1)。采用1∶2 邻距法,卡钳值取0.2,以AR组为基准进行匹配成功后,AR组为29例,NAR组为45例,匹配后组间所有协变量均达到平衡(P>0.05,表 1)。
|
|
表 1 匹配前后患者临床资料分布情况 |
2.2 术后第3天肝功能比较
术后第3天,患者的总胆红素、ALT和AST水平较术前均有升高,提示术后HCC患者的肝功能均有不同程度的损害。匹配后AR组患者术后第3天的ALT和AST水平均低于NAR组(P<0.05,表 2),提示AR组患者术后第3天肝功能优于NAR组。
|
|
表 2 匹配前后两组患者术后第3天肝功能比较 |
2.3 生存分析
匹配前,AR组(n=64)和NAR组(n=60)患者的术后中位无瘤生存时间分别是18 (14.78~21.22)个月和13 (9.52~16.48)个月,组间差异无统计学意义(χ2=0.469,P=0.494,图 1A);AR组和NAR组患者的术后中位总体生存时间分别是48 (45.78~50.22)个月和33 (28.63~37.37)个月,AR组高于NAR组(χ2=10.460,P=0.001,图 1B)。
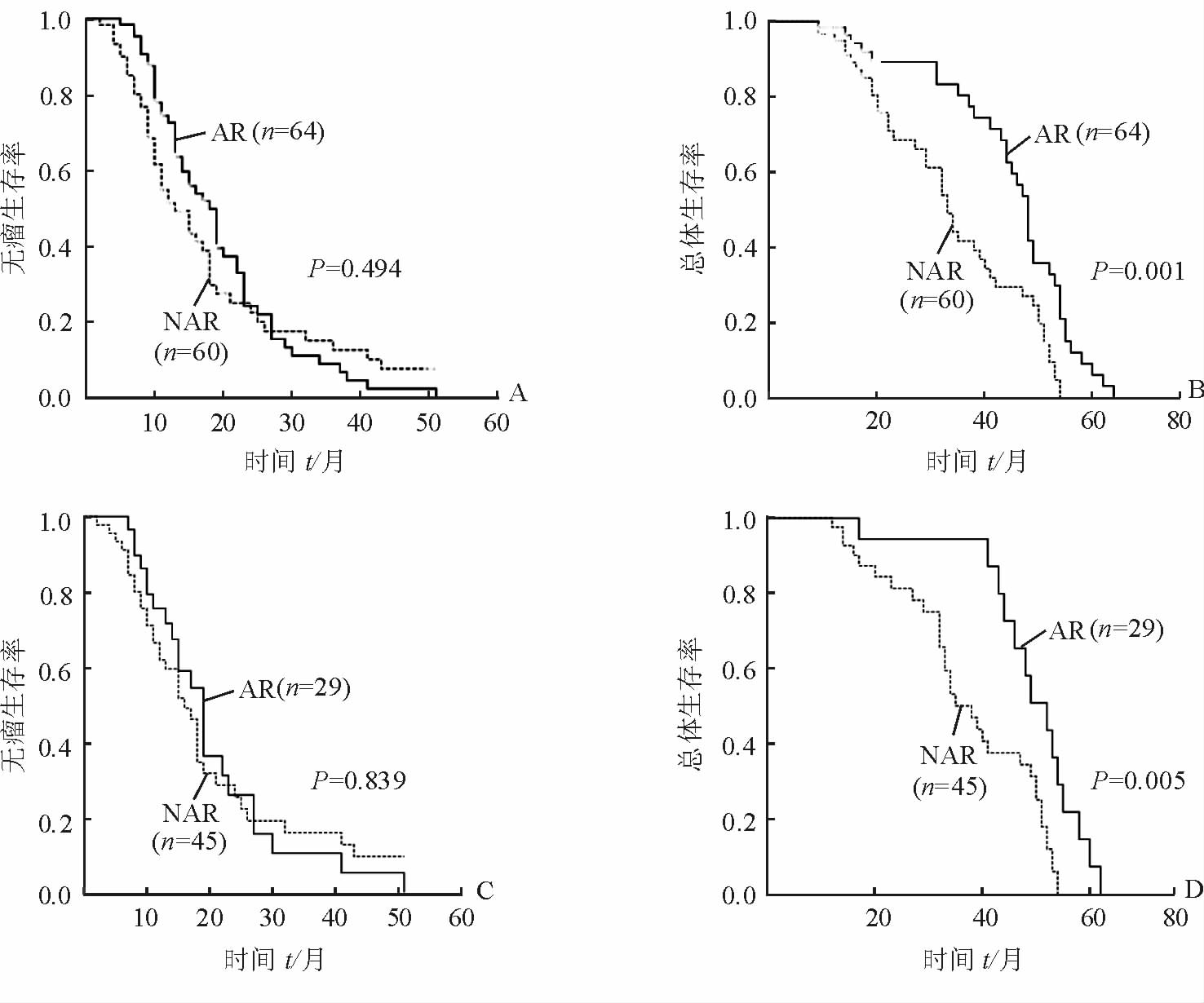
|
图 1 匹配前和匹配后两组的无瘤生存和总体生存比较 A: 匹配前两组无瘤生存比较; B: 匹配前两组总体生存比较; C: 匹配后两组无瘤生存比较; D: 匹配后两组总体生存比较. AR: 解剖性肝切除; NAR: 非解剖性肝切除 |
匹配后,AR组(n=29)和NAR组(n=45)患者的术后中位无瘤生存时间分别是19 (15.57~22.44)个月和16 (12.96~19.05)个月,组间差异无统计学意义(χ2=0.041,P=0.839,图 1C);AR组和NAR组患者的术后中位总体生存时间分别是52 (44.83~59.17)个月和38 (31.45~44.55)个月,AR组高于NAR组(χ2=7.945,P=0.005,图 1D)。
2.4 HCC患者预后因素分析Cox回归单因素分析结果显示:AR、重度肝硬化、脉管癌栓、肿瘤直径、肿瘤包膜、BCLC分期、乙型肝炎病毒表面抗原、乙型肝炎病毒DNA水平、年龄等因素与HCC术后生存有关(P<0.1);Cox回归多因素分析结果显示:重度肝硬化、肿瘤直径、BCLC分期、乙型肝炎病毒DNA水平是影响HCC患者术后总体生存的独立危险因素,AR是HCC患者术后总体生存的保护因素(P<0.05,表 3)。
|
|
表 3 患者预后多因素分析 |
3 讨 论
肝切除术是我国最常见的肝癌手术方式,以是否根据肝脏Couinaud分段进行切除,分为AR和NAR。与NAR相比,AR可减少胆漏等并发症的发生及肿瘤的复发,提高肝癌患者的生存率[7, 11~13],其主要原因为:(1) AR完整地切除了相对独立的肝脏解剖单位,肝实质离断确切,保障了剩余肝脏的血供和胆管的相对完整,减少了出血,降低了术后并发症的发生;(2) AR切除了可能存在的隐匿病灶,降低了肿瘤复发率;(3) AR强调预先切断病变侧的入肝血流,降低了因肿瘤挤压造成的肝内播散或远处转移。本研究对全组124例HCC患者进行研究发现,AR组患者的总体生存率高于NAR组(P=0.001)。但是,本研究中,NAR组和AR组患者在性别、重度肝硬化、肿瘤包膜、肿瘤数量、脉管癌栓和BCLC分期6个协变量上存在组间分布不平衡,NAR组患者重度肝硬化、包膜不完整、肿瘤多发、脉管癌栓和BCLC分期B期等因素的占比均高于AR组,提示AR组可能纳入了较多的肝硬化较轻、具有完整包膜、单个肿瘤、无脉管癌栓和BCLC分期分级较好的HCC病例,故AR能使HCC患者生存获益的结论值得商榷,近期就有部分学者提出了相反的结论或认为两者生存无差异[14~15]。
倾向指数的概念由Rosenbaum和Rubin[16]在1983年首次提出,该方法能降低偏倚,保证组间基线资料的均衡可比,达到近似随机对照临床研究的结果[17]。为进一步检验本研究前面的结论,我们运用PSM方法对两组进行合理匹配,匹配成功后,共入选HCC患者74例,其中AR组29例,NAR组45例,组间各协变量全部达到均衡(P>0.05)。匹配后的结果显示:AR组患者的总体生存率仍高于NAR组(P=0.005);Cox模型多因素分析也提示:AR是HCC患者术后总体生存的保护因素(相对危险度为0.54,P=0.04)。
研究认为,HCC的预后与患者术后肝功能和肿瘤直径、肿瘤数量、脉管癌栓等肿瘤特性相关[18~19]。本研究采用PSM法使两组患者术前的肝功能和肿瘤特性等指标达到均衡,结果发现AR组患者的总体生存优于NAR组,这和AR更符合肿瘤的无瘤原则以及在完整切除肿瘤的同时更注重保护剩余肝组织功能有关。Roayaie等[4]也认为完整的肝解剖单位的切除能更好地保护剩余肝脏的血供,减少肝组织缺血坏死的发生。因此,切除病灶后,在剩余肝体积相似的患者中,NAR组患者术后肝组织缺血坏死面积会更大,导致了NAR组患者术后肝功能比AR组更差,这一点也被本研究数据所证实。Hasegawa等[20]认为AR可以切除肝组织中可能存在的隐匿性转移灶,从而降低HCC患者的术后复发率,改善HCC患者的预后。而本研究结果显示,AR组患者的无瘤生存时间虽然高于NAR组,但差异并无统计学意义,其原因可能是肝癌复发与HCC的多中心生长而非肝内转移相关[6]。
肝硬化是HCC的一个常见合并症,大多数合并肝硬化的HCC患者的肝脏储备功能下降,术后出现肝功能衰竭的风险增加,对于合并肝硬化的HCC患者,黄锦龙等[21]建议行NAR。本研究结果显示:在匹配后的肝硬化HCC患者中,AR组和NAR组患者术后中位生存时间分别为52(43.88~60.12)个月和38(30.01~45.99)个月,组间比较有统计学意义(χ2=7.508,P=0.006;结果中未列出)。但本研究中合并肝硬化的HCC样本量只有67例,低于黄锦龙等[21]的样本量(337例),故我们认为对于重度肝硬化的HCC患者,应慎用AR。
总之,在匹配前后,AR组患者的总体生存均高于NAR组,可以认为AR能提高HCC患者的预后,对于肝脏储备功能较好的肝癌患者应积极行AR。
| [1] | 陈万青, 郑荣寿, 张思维, 等. 2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2016, 25: 1–8. |
| [2] | ARII S, TANAKA S, MITSUNORI Y, NAKAMURA N, KUDO A, NOGUCHI N, et al. Surgical strategies for hepatocellular carcinoma with special reference to anatomical hepatic resection and intraoperative contrast-enhanced ultrasonography[J]. Oncology, 2010, 78(Suppl 1): 125–130. |
| [3] | TOMIMARU Y, EGUCHI H, MARUBASHI S, WADA H, KOBAYASHI S, TANEMURA M, et al. Equivalent outcomes after anatomical and non-anatomical resection of small hepatocellular carcinoma in patients with preserved liver function[J]. Dig Dis Sci, 2012, 57: 1942–1948. DOI: 10.1007/s10620-012-2114-7 |
| [4] | ROAYAIE S, OBEIDAT K, SPOSITO C, MARIANI L, BHOORI S, PELLEGRINELLI A, et al. Resection of hepatocellular cancer≤2 cm: results from two Western centers[J]. Hepatology, 2013, 57: 1426–1435. DOI: 10.1002/hep.25832 |
| [5] | KUBO S, TAUKAMOTO T, HIROHASHI K, TANAKA H, SHUTO T, TAKEMURA S, et al. Appropriate surgical management of small hepatocellular carcinomas in patients infected with hepatitis C virus[J]. World J Surg, 2003, 27: 437–442. DOI: 10.1007/s00268-002-6475-5 |
| [6] | DAHIYA D, WU T J, LEE C F, CHAN K M, LEE W C, CHEN M F. Minor versus major hepatic resection for small hepatocellular carcinoma (HCC) in cirrhotic patients: a 20-year experience[J]. Surgery, 2010, 147: 676–685. DOI: 10.1016/j.surg.2009.10.043 |
| [7] | KANG C M, CHOI G H, KIM D H, CHOI S B, KIM K S, CHOI J S, et al. Revisiting the role of nonanatomic resection of small ( < or=4 cm) and single hepatocellular carcinoma inpatients with well-preserved liver function[J]. J Surg Res, 2010, 160: 81–89. DOI: 10.1016/j.jss.2009.01.021 |
| [8] | 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肿瘤学杂志, 2011, 16: 929–946. |
| [9] | 张闽光, 黄学菁, 朱琼, 耿坚, 张安君. 肝硬化的CT分型[J]. 中国医学计算机成像杂志, 2004, 10: 42–45. |
| [10] | AUSTIN P C. Some methods of propensity-score matching had superior performance to others: results of an empirical investigation and Monte Carlo simulations[J]. Biom J, 2009, 51: 171–184. DOI: 10.1002/bimj.v51:1 |
| [11] | 陈焕伟, 廖珊, 王峰杰, 李梅生, 甄作均. 解剖性肝切除治疗肝细胞癌的长期结果和预后影响因素分析:附90例报告[J]. 中华肝胆外科杂志, 2012, 18: 110–114. |
| [12] | CHO Y B, LEE K U, LEE H W, CHO E H, YANG S H, CHO J Y, et al. Anatomic versus non-anatomic resection for small single hepatocellular carcinomas[J]. Hepatogastroenterology, 2007, 54: 1766–1769. |
| [13] | 李予闽. 解剖性和非解剖性肝切除对肝细胞癌患者预后的影响[J]. 临床外科杂志, 2014, 22: 669–672. |
| [14] | YAMAMOTO Y, IKOMA H, MORIMURA R, KONISHI H, MURAYAMA Y, KOMATSU S, et al. Clinical analysis of anatomical resection for the treatment of hepatocellular carcinoma based on the stratification of liver function[J]. World J Surg, 2014, 38: 1154–1163. DOI: 10.1007/s00268-013-2369-y |
| [15] | MARUBASHI S, GOTOH K, AKITA H, TAKAHASHI H, SUGIMURA K, MIYOSHI N, et al. Analysis of recurrence patterns after anatomical or non-anatomical resection for hepatocellular carcinoma[J]. Ann Surg Oncol, 2015, 22: 2243–2252. DOI: 10.1245/s10434-014-4214-4 |
| [16] | ROSENBAUM P R, RUBIN D B. The central role of the propensity score in observational studies for causal effects[J]. Biometrika, 1983, 70: 41–55. DOI: 10.1093/biomet/70.1.41 |
| [17] | AUSTIN P C. Optimal caliper widths for propensity-score matching when estimating differences in means and differences in proportions in observational studies[J]. Pharm Stat, 2011, 10: 150–161. DOI: 10.1002/pst.v10.2 |
| [18] | MIZUGUCHI T, KAWAMOTO M, MEGURO M, NAKAMURA Y, HARADA K, KUKITA K, et al. Prognostic impact of preoperative the branched-chain amino acid to the tyrosine ratio in hepatocellular carcinoma patients after initial hepatectomy[J]. J Gastrointest Surg, 2011, 15: 1433–1439. DOI: 10.1007/s11605-011-1566-y |
| [19] | SUMIE S, KUROMATSU R, OKUDA K, ANDO E, TAKATA A, FUKUSHIMA N, et al. Microvascular invasion in patients with hepatocellular carcinoma and its predictable clinicopathological factors[J]. Ann Surg Oncol, 2008, 15: 1375–1382. DOI: 10.1245/s10434-008-9846-9 |
| [20] | HASEGAWA K, KOKUDO N, IMAMURA H, MATSUYAMA Y, AOKI T, MINAGAWA M, et al. Prognostic impact of anatomic resection for hepatocellular carcinoma[J]. Ann Surg, 2005, 242: 252–259. DOI: 10.1097/01.sla.0000171307.37401.db |
| [21] |
黄锦龙, 王清, 于勇, 姜小清, 罗祥基. 解剖性肝切除对肝细胞癌预后的影响[J]. 第二军医大学学报, 2015, 36: 492–499.
HUANG J L, WANG Q, YU Y, JIANG X Q, LUO X J. Effect of anatomic liver resection on prognosis of patients with hepatocellular carcinoma[J]. Acad J Sec Mil Med Univ, 2015, 36: 492–499. DOI: 10.3724/SP.J.1008.2015.00492 |
 2016, Vol. 37
2016, Vol. 37


