2. 解放军昆明总医院眼科, 昆明 650032;
3. 兰州军区机关门诊部眼科, 兰州 730000
2. Department of Ophthalmology, Kunming General Hospital of PLA, Kunming 650032, Yunnan, China;
3. Department of Ophthalmology, Lanzhou Military Region Authorities Outpatient Department, Lanzhou 730000, Gansu, China
甲状腺相关性眼病(thyroid-associated ophthalmopathy,TAO)是临床上最常见的引起眼球突出的疾病,随着社会环境和人们生活习惯的改变,其发病率有逐渐升高的趋势[1~2]。TAO临床表现以眼球突出、眼睑肿胀、上睑退缩、结膜充血水肿、眼外肌麻痹等为主,较为严重的患者可因肥厚的眼外肌挤压视神经及眼球过于突出引发角膜暴露而导致视功能受损。临床上根据眼眶脂肪及眼外肌情况将TAO分为2种类型[3],且不论何种类型的眼眶脂肪病变都在TAO的发病中占据了重要位置。从病因学角度分析,TAO是一种与促甲状腺素受体(thyroid stimulating hormone receptor,TSHR)及胰岛素样生长因子-1 (IGF-1)受体(insulin-like growth factor receptor-1,IGF-1R)自身抗原密切相关的眼眶炎症性疾病。本实验通过研究TAO患者的眼眶脂肪结缔组织,探讨重组人IGF-1/IGF-1R在眼眶脂肪组织中的作用。
1 材料和方法 1.1 患者资料TAO组:选取2014年9月至2015年1月期间入住第二军医大学长征医院行眼眶减压术的稳定期TAO患者6例,其中男性2例、女性4例。TAO诊断标准:(1)眼睑退缩者只要合并以下体征或检查证据之一即可诊断,即甲状腺功能异常;眼球突出,突度≥16 mm;视神经功能障碍,包括视力下降、瞳孔反射、色觉、视野异常,无法用其他病变解释;眼外肌受累,眼球活动受限、眼外肌肥大。(2)缺乏眼睑退缩者须具备甲状腺功能异常,并应有以下体征之一,即眼球突出、眼外肌受累或视神经功能障碍,并排除其他眼病引起的类似体征。以上患者病情都稳定6个月以上。对照组:选取2014年9月至2015年1月期间在第二军医大学长征医院行下眼睑眼袋成形术及眼球摘除术的患者5例,其中男性1例、女性4例。所有患者均无甲状腺相关疾病史。
1.2 主要仪器和试剂MVE液氮罐(美国Chart-MVE公司),冰冻组织切片机(CM3050型,德国徕卡公司),CCK8试剂盒(100T;深圳伟通生物科技有限公司)。Ⅰ型胶原酶、油红O(美国Sigma公司),IGF-1R单克隆抗体、Pref-1单克隆抗体(美国Proteintech公司),IGF-1(以色列Prospec公司),DMEM/F12培养基(美国Gibco公司)。
1.3 标本获得及冰冻切片制作和免疫组化将手术获得的脂肪组织用磷酸盐缓冲液(PBS)冲洗3~4次,用OCT(optimal cutting temperature)包埋剂包绕;将恒温冷箱切片机调至-20℃,设置切片厚度为10 μm,连续切片;晾干5 min后,-20℃丙酮固定30 min。免疫组化:用3%H2O2孵育10 min,PBS清洗2次,进行血清封闭,加入IGF-1R抗体孵育后加入二抗。加入新鲜配制DAB进行显色,室温下苏木精复染,乙醇梯度脱水,干燥后二甲苯透明,树胶封片。采用结合染色强度和阳性细胞百分比的半定量法进行评价。
1.4 原代眼眶前脂肪细胞的提取、培养和鉴定将手术获得的脂肪组织用PBS冲洗3~4次,去除脂肪结缔组织中的纤维组织及血管成分,使之成为约1 mm×1 mm×1 mm的脂肪组织。DMEM/F12培养液[含10%胎牛血清(FBS)+1%PBS]冲洗后,加入含0.1%Ⅰ型胶原酶(1 mg/mL)的消化液,37℃消化30 min。200目的筛网过滤后终止消化,1 500 r/min离心10 min(离心半径为13 cm),重悬细胞后接种。于37℃、5% CO2条件下孵育,每隔48~72 h换液一次,待细胞融合后再进行传代,传至3~4代进行分离和鉴定。
1.5 眼眶前脂肪细胞的分化当细胞融合至80%时使用无血清诱导培养基进行分化诱导(分化第0天),每48 h更换一次培养液;分化到第4天时更换为分化培养基(参照Valyasevi等[4]的方法配制)继续分化;分化到第10天时结束,观察细胞脂滴合成情况,并进行油红O染色。
1.6 CCK8检测TAO组和对照组患者的眼眶前脂肪细胞分别加入不同浓度IGF-1(0、1、5、10、20 nmol/L)作用,48 h后按照CCK-8试剂盒说明进行相关操作,检测各组细胞在450 nm下的光密度(D)值。另取两组患者的眼眶前脂肪细胞,分别加入5 nmol/L IGF-1,并分别设立不加IGF-1的相应对照组,培养5 d后检测不同时间点各组细胞在波长450 nm下的D值,绘制生长曲线。
1.7 油红O染色取TAO组眼眶前脂肪细胞,分别加入不同浓度IGF-1(0、1、5、10、20 nmol/L)作用,第10天时观察细胞脂滴合成情况,并进行油红O染色及后续实验。将100 mL异丙醇和0.5 g干粉(油红O)混合,溶解后进行过滤,在4℃下避光保存;将储备液与蒸馏水按3∶2稀释,使用滤纸进行过滤;将分化后的脂肪细胞使用4%多聚甲醛固定5 min,加入油红O工作液染色放置3 min;再于37℃培养箱中放置1 h后PBS清洗3次;异丙醇抽提油红O,检测各组细胞在波长510 nm下的D值。
1.8 RNA提取及PCR检测使用TRIzol试剂盒抽提脂肪组织和分化细胞中的总RNA,按反转录试剂盒说明合成cDNA,37℃下反转录30 min,94℃下灭活2 min,加入SYBR Premix Ex TaqTM Ⅱ(日本TaKaRa公司)进行扩增。反应条件如下:95℃预变性2 min;95℃变性30 s,72℃退火45 s,68℃延伸20 s,共30个循环。结果以2-ΔΔCt表示,GAPDH作为内参照。设置3个复孔。引物序列如下:IGF-1R F 5′-TCC ACA TCC TGC TCA TCT CC-3′,R 5′-AGA AGT CAC GGT CCA CAC AG-3′;PPARγ F 5′-CAT AAT GCC ATC AGG TTT GG-3′,R 5′-CTG GAT TCA GCT GGT CGA TA-3′;GAPDH F 5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′,R 5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′。
1.9 蛋白质印迹法检测蛋白的表达抽提蛋白并通过12% SDS-PAGE进行分离,电转移到PVDF膜上。将含有蛋白的膜用5%脱脂奶粉封闭2 h,接着将膜浸于孵育盒中,加入配好的一抗IGF-1R(美国Proteintech公司 ,1∶500)和β-actin抗体。4℃下摇床孵育过夜后,辣根过氧化酶偶联的二抗中37℃孵育2 h。ECL显色,暗室曝光显影。
1.10 统计学处理采用SPSS 18.0软件进行数据分析,所有计量资料以x±s表示。组间差异比较采用单因素方差分析(One-way ANOVA)。等级资料比较采用两个独立样本的秩和检验(Wilcoxon)。检验水准(α)为0.05。
2 结 果 2.1 眼眶脂肪组织中IGF-1R蛋白和mRNA的表达情况通过蛋白质印迹法对两组患者眼眶脂肪组织中的IGF-1R蛋白进行检测,结果(图 1)显示,TAO组患者眼眶脂肪组织中IGF-1R蛋白的表达量明显高于对照组。PCR检测 IGF-1R mRNA的表达水平,结果显示,TAO组患者眼眶脂肪组织中IGF-1R mRNA的表达(2.71±0.14)高于对照组(1.12±0.06,P<0.01)。

|
图 1 两组患者眼眶脂肪组织中IGF-1R蛋白的表达 Fig 1 Expression of IGF-1R protein in orbital adipose tissues in two groups TAO: Thyroid-associated ophthalmopathy; IGF-1R: Insulin-like growth factor-1 receptor |
2.2 眼眶脂肪组织冰冻切片中IGF-1R的免疫组化情况
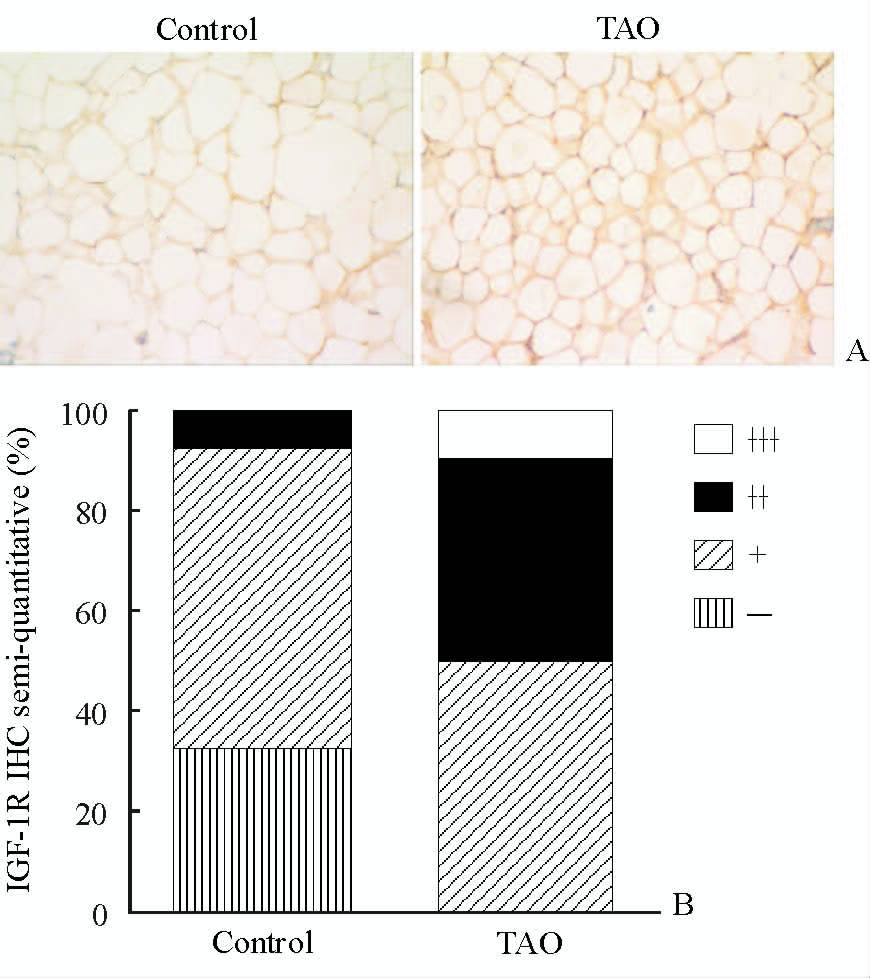
应用组织冰冻切片技术和免疫组化法检测两组患者眼眶脂肪组织中IGF-1R蛋白的分布情况。结果(图 2A)显示,IGF-1R在两组的纤维组织及小血管内可见明显表达,在脂肪细胞间也存在表达,且其在TAO组组织中相比对照组表达更明显。采用不同视野下半定量法检测两组脂肪细胞中IGF-1R的含量,结果可见TAO组细胞中IGF-1R的含量高于对照组,差异有统计学意义(P<0.01,图 2B)。
|
图 2 两组患者眼眶脂肪组织中IGF-1R蛋白的分布情况(A)和含量(B) Fig 2 The distribution (A) and content (B) of IGF-1R protein in orbital adipose tissue in two groups TAO: Thyroid-associated ophthalmopathy; IGF-1R: Insulin-like growth factor-1 receptor. n=5 for control group,n=6 for TAO group. Original magnification: ×400 (A) |
2.3 眼眶脂肪组织中原代成纤维细胞的提取及传代
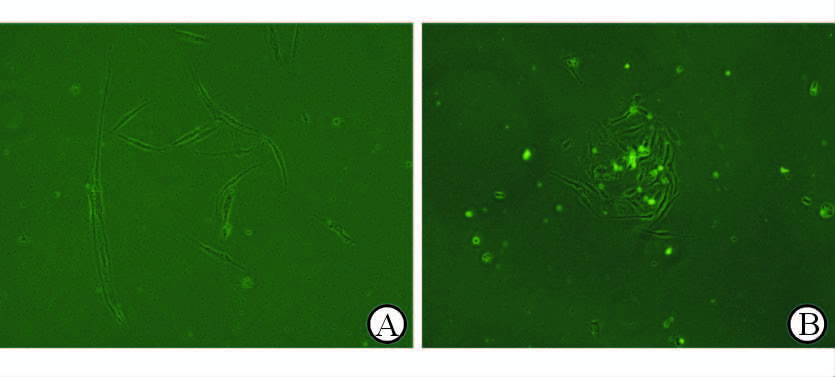
通过酶解法从获取的脂肪组织中提取原代成纤维细胞。两组眼眶脂肪组织的原代细胞均显示为体积较小的梭形细胞,细胞核相对较大,TAO组细胞体积略小于对照组(图 3)。两组细胞初期生长缓慢,7~10 d 后增殖能力明显增强;传至第2代后两组细胞在外形上差别不大,均表现为多角形或长梭形细胞。
|
图 3 培养4 d时两组眼眶原代成纤维细胞的形态 Fig 3 Morphological image of primary orbital fibroblast (4 days) in two groups A: Control group; B: TAO group. TAO: Thyroid-associated ophthalmopathy. Original magnification: ×400 |
2.4 不同浓度IGF-1对眼眶前脂肪细胞增殖能力的影响
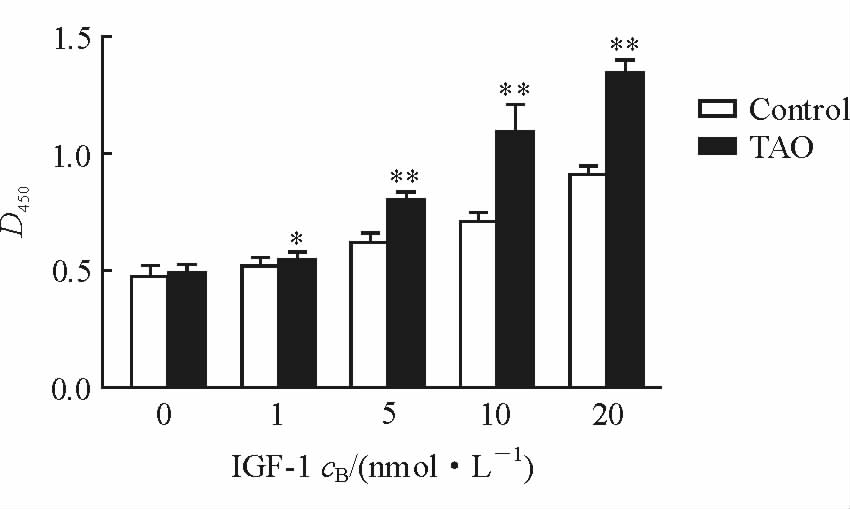
随IGF-1作用浓度的增加,TAO组和对照组眼眶前脂肪细胞的增殖水平均逐渐提高;分别与未加IGF-1自身对照组比较,差别均有统计学意义(P<0.01)。1~20 nmol/L IGF-1作用下TAO组前脂肪细胞的增殖能力均高于对照组(P<0.05,P<0.01;图 4)。
|
图 4 不同浓度IGF-1作用48 h后两组前脂肪细胞的增殖情况 Fig 4 The proliferation of preadipocyte in two groups after treatment with different concentrations of IGF-1 for 48 h TAO: Thyroid-associated ophthalmopathy; IGF-1: Insulin-like growth factor-1. *P<0.05,**P<0.01 vs control group. n=5 for control group,n=6 for TAO group; x±s |
2.5 IGF-1对眼眶前脂肪细胞生长曲线的影响
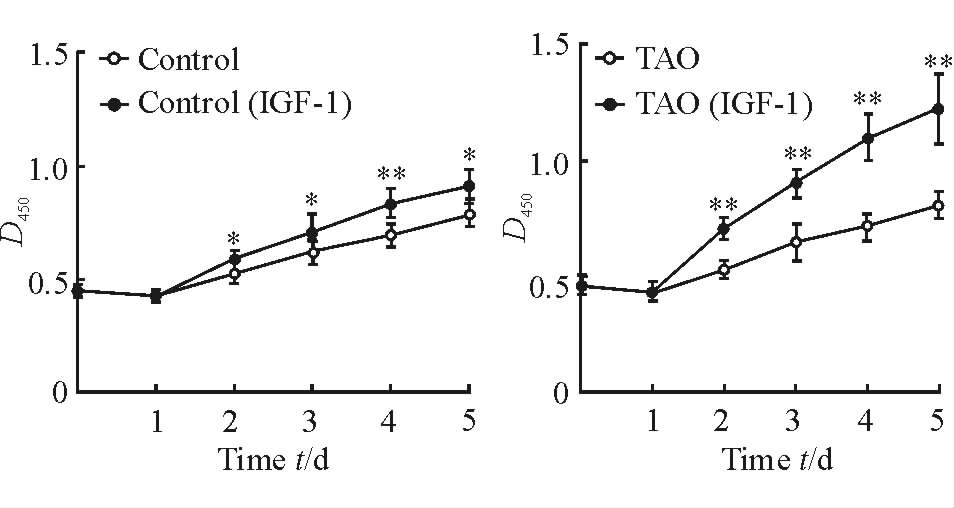
分别与未加IGF-1自身对照相比,对照组与TAO组眼眶前脂肪细胞经5 nmol/L IGF-1作用2~5 d后的细胞增殖能力均增高,差异有统计学意义(P<0.05,P<0.01;图 5)。
|
图 5 IGF-1作用后两组眼眶前脂肪细胞的生长曲线 Fig 5 The growth curve of preadipocytein two groups after treatment with IGF-1 TAO: Thyroid-associated ophthalmopathy; IGF-1: Insulin-like growth factor-1. *P<0.05,**P<0.01 vs self control group. n=5 for control group,n=6 for TAO group; x±s |
2.6 两组眼眶前脂肪细胞的分化情况和IGF-1R受体的变化
经分化培养基分化诱导6 d后两组细胞形态均发生了明显变化,细胞形态饱满,在部分细胞中间可见少量聚集在一起的透亮油滴样物质。分化结束后油红O染色显示胞成椭圆形,周边可见着色脂滴成分;且TAO组细胞的分化水平(D510=0.73±0.05)与对照组(D510=0.68±0.03)相比差异无统计学意义(P=0.39)。蛋白质印迹法检测分化前、后两组眼眶前脂肪细胞中IGF-1R蛋白的表达变化,可见分化后两组眼眶前脂肪细胞中IGF-1R蛋白的表达均下降,但分化前、后TAO组细胞中IGF-1R蛋白的表达始终高于对照组(图 6)。
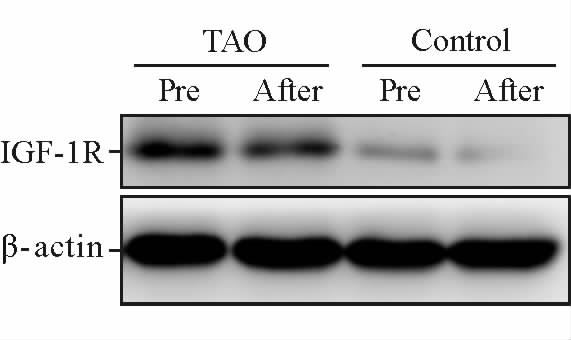
|
图 6 两组眼眶前脂肪细胞分化前、后IGF-1R蛋白的表达 Fig 6 The expression of IGF-1R protein in preadipocyte in two groups before and after differentiation TAO: Thyroid-associated ophthalmopathy; IGF-1R: Insulin-like growth factor-1 receptor |
2.7 两组前脂肪细胞分化后PPARγ mRNA的表达情况
PCR检测结果发现,TAO组与对照组细胞中PPARγ mRNA的表达量差异无统计学意义(1.06±0.03 vs 0.99±0.04,P=0.21)。
2.8 IGF-1对TAO组细胞分化后PPARγ mRNA表达及脂化水平的影响结果(图 7)显示1、5、10、20 nmol/L IGF-1组细胞中PPARγ mRNA的表达均高于未加IGF-1对照组(P<0.01)。随IGF-1作用浓度升高脂肪分化水平逐渐增强,当IGF-1浓度达到20 nmol/L时,这种增强趋势有一定的减弱(P=0.02)。对分化后的各组细胞进行油红O染色,结果发现随着IGF-1浓度的升高,油滴含量逐渐增加,且各组D510值差异有统计学意义(P<0.05,P<0.01;图 8)。当IGF-1浓度超过5 nmol/L后,油滴含量增加较为明显。
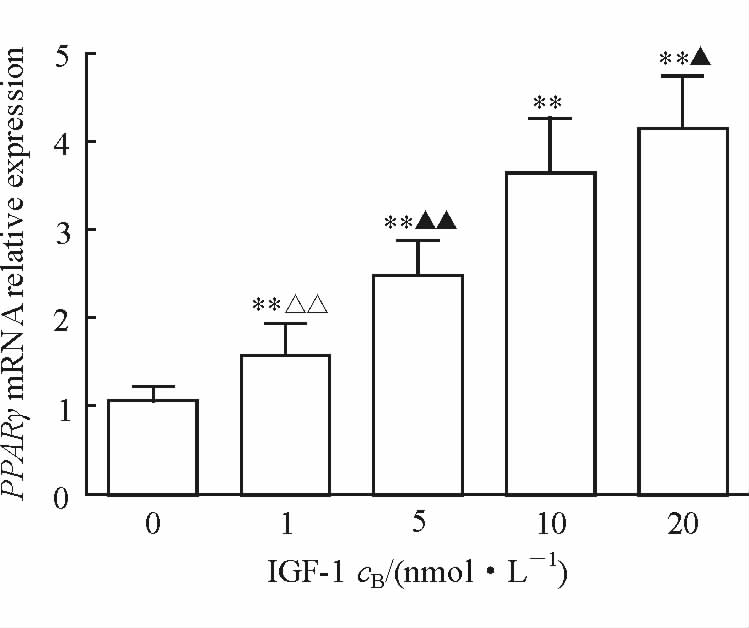
|
图 7 IGF-1对TAO组前脂肪细胞分化后PPARγ mRNA表达的影响 Fig 7 The effect of IGF-1 on PPARγ mRNA expression of preadipocyte in TAO group before and after differentiation IGF-1: Insulin-like growth factor-1; TAO: Thyroid-associated ophthalmopathy; PPARγ: Peroxisome proliferator-activated receptor. **P<0.01 vs 0 nmol/L IGF-1 group; △△P<0.01 vs 5 nmol/L IGF-1 group; ▲P<0.05,▲▲P<0.01 vs 10 nmol/L IGF-1 group. n=6,x±s |

|
图 8 IGF-1作用后TAO组前脂肪细胞油红O染色结果 Fig 8 Oil red O staining of preadipocyte in TAO group treated with IGF-1 after differentiation A: 0 nmol/L IGF-1 group; B: 1 nmol/L IGF-1 group; C: 5 nmol/L IGF-1 group; D: 10 nmol/L IGF-1 group; E: 20 nmol/L IGF-1 group; F: The proliferation level of preadipocyte in TAO group treated with different concentrations of IGF-1. IGF-1: Insulin-like growth factor-1; TAO: Thyroid-associated ophthalmopathy.*P<0.05,**P<0.01 vs control group (0 nmol/L IGF-1 group); △P<0.05,△△P<0.01 vs 5 nmol/L IGF-1 group. n=6,x±s. Original magnification: ×400 (A-E) |
3 讨 论
随着现代社会环境、社会人群心理状态及生活习惯的改变,TAO的发病率呈现逐渐上升的趋势。在美国每年大约有37 000例新发病例,每10万人口年平均约有16例女性和2.9例男性发病的患者[1]。TAO的发病机制还不是很清楚,目前认为TAO是一种与自身免疫相关的眼眶炎症性疾病,也是临床较难处理的眼科疾病之一。既往研究认为TSHR是TAO自身免疫的主要抗原[5],直到2008年Tsui等[6]通过实验提出了TSHR/IGF-1R复合共同体学说。Varewijck等[7]后来在对不同年龄段TAO患者进行血清学检查时发现,血清中IgG不仅可以激活IGF-1R,而且这种激活作用随患者年龄的增加而更加明显,这与Graves眼病(Graves’ ophthalmopathy,GO)随发病年龄增加而逐渐加重的特点相一致,从侧面验证了TSHR/IGF-1R复合共同体学说。以上这些研究表明了IGF-1R和TSHR的交互效应可能与TAO疾病有着密切的联系。
本研究检测发现TAO组眼眶脂肪组织中IGF-1R蛋白及核酸的表达较高。由于眼眶组织中还包含了纤维细胞、内皮细胞等脂肪细胞以外的成分,该实验结果仅能说明脂肪组织间存在差异。使用冰冻切片进行免疫组化检查,镜下可见IGF-1R在TAO组脂肪组织中的表达较高,其不仅在微小血管内及周边含量高,在脂肪细胞之间也较明显。此外TAO眼眶中的成纤维细胞、B细胞也都被证实存在IGF-1R过高表达的现象[8]。脂肪细胞是由前脂肪细胞分化而来,而前脂肪细胞又是成纤维细胞里一种亚型。为了进一步研究IGF-1R与脂肪细胞之间的关系,本研究提取了两组眼眶脂肪组织中的成纤维细胞进行培养,发现两组原代成纤维细胞在形态学上略有差异,虽然都表现为短梭形细胞,但TAO组细胞更小些。经过融合增殖传至第2代后细胞体积增大,并出现了树枝样伪足,两组细胞形态学上差异并不明显。
作为IGF-1R配体的IGF-1于1957年被Salmin和 Daughaday[9]首次发现,认为它和生长激素有密切关系[10]。体内肝脏等组织表达IGF-1后经过循环系统作用到各个组织及器官,主要作用是调节生长、再生和代谢。它在肿瘤、神经系统和免疫代谢系统疾病方面的作用较为明显[11]。本研究检测了不同浓度IGF-1作用下眼眶前脂肪细胞的增殖情况,结果显示对照组和TAO组前脂肪细胞的增殖能力均提高,且使用5 nmol/L IGF-1作用时,两组细胞的增值水平在培养2 d后就高于不加IGF-1自身对照组,表明细胞对IGF-1刺激较为敏感;此外,相同浓度IGF-1作用时TAO组细胞的增殖能力要高于对照组,在1 nmol/L IGF-1作用下两组差异即有统计学意义,说明TAO组细胞对IGF-1刺激更为敏感。
研究证实TSHR在TAO的发病过程中具有重要作用,在GO患者眼眶前脂肪细胞分化过程中TSHR呈现逐渐增高的表达趋势[12]。那么作为细胞TSHR受体共同学说的重要组成部分,IGF-1R在细胞分化前后的变化是否和TSHR一致呢?本研究结果显示分化后两组细胞的IGF-1R含量较分化前均略有降低,且TAO组始终高于对照组。IGF-1R的变化趋势与TSHR并不一致,分析其原因可能是虽然IGF-1R与TSHR关系密切,但作为细胞生长代谢的重要受体,IGF-1R有其自身的特点,也可能会受到其他因素的影响。
既往研究发现IGF家族的作用组织和胰岛素类似,包括脂肪组织、横纹肌及心肌组织等[13~14],其在脂肪组织水平和细胞水平均能影响糖类和脂类的代谢。研究发现生理水平状况下的IGF-1就可以促进不同阶段脂肪细胞的分化及细胞因子的合成[15],但以上研究都是在躯体脂肪中进行,而对眼眶内脂肪的研究较少[16]。本研究将获得的眼眶前脂肪细胞进行体外分化,通过检测脂滴合成量及成脂指标PPARγ发现TAO组和对照组的脂化水平差异无统计学意义。1~20 nmol/L IGF-1作用后,TAO组眼眶前脂肪细胞均呈现较强的增强的分化趋势,细胞中的油滴含量和PPARγ mRNA的表达水平均增加(P<0.01),表明IGF-1在体外可以促进TAO眼眶前脂肪细胞的分化。
综上所述,IGF-1R在TAO眼眶脂肪组织和前脂肪细胞中呈现异常高表达的状态,一定浓度的IGF-1可以提高前脂肪细胞的增殖和脂化能力,提示IGF-1R的这种变化在TAO眼眶脂肪病变中可能具有一定作用。IGF-1R抑制剂已经在肿瘤临床治疗中得到应用[17],目前已有通过利妥昔单抗对重度TAO患者进行治疗的相关报道,并已在少量的样本研究中发现其可以抑制血清中IGF-1R阳性T细胞的能力[18]。IGF-1R可能在TAO中发挥重要作用,其相关研究可能将为TAO的治疗开辟一条新途径。
| [1] | BARTLEY G B. The epidemiologic characteristics and clinical course of ophthalmopathy associated with autoimmune thyroid disease in Olmsted County, Minnesota[J]. Trans Am Ophthalmol Soc, 1994, 92: 477–588. |
| [2] | FLYNN R W, MACDONALD T M, MORRIS A D, JUNG R T, LEESE G P. The thyroid epidemiology, audit, and research study: thyroid dysfunction in the general population[J]. J Clin Endocrinol Metab, 2004, 89: 3879–3884. DOI: 10.1210/jc.2003-032089 |
| [3] | KASPAR M, ARCHIBALD C, De B A, LI A W, YAADA M, CHANG C H, et al. Eye muscle antibodies and subtype of thyroid-associated ophthalmopathy[J]. Thyroid, 2002, 12: 187–191. DOI: 10.1089/105072502753600115 |
| [4] | VALYASEVI R W, ERICKSON D Z, HARTENECK D A, DUTTON C M, HEUFELDER A E, JYONOUCHI S C, et al. Differentiation of human orbital preadipocyte fibroblasts induces expression of functional thyrotropin receptor[J]. J Clin Endocrino Metab, 1999, 84: 2557–2562. |
| [5] | WAKELKAMP I M, BAKKER O, BALDESCHI L, WIRESINGA W M, PRUMMEL M F. TSH-R expression and cytokine profile in orbital tissue of active vs inactive Graves' ophthalmopathy patients[J]. Clin Endocrinol (Oxf), 2003, 58: 280–287. DOI: 10.1046/j.1365-2265.2003.01708.x |
| [6] | TSUI S, NAIK V, HOA N, HWANG C J, AFIFIYAN N F, SINHA HIKIM A, et al. Evidence for an association between thyroid-stimulating hormone and insulin-like growth factor 1 receptors: a tale of two antigens implicated in Graves' disease[J]. J Immunol, 2008, 181: 4397–4405. DOI: 10.4049/jimmunol.181.6.4397 |
| [7] | VAREWIJCK A J, BOELEN A, LAMBERTS S W, FLIERS E, HOFLAND L J, WIERSINGA W M, et al. Circulating IgGs may modulate IGF-I receptor stimulating activity in a subset of patients with Graves' ophthalmopathy[J]. J Clin Endocrinol Metab, 2013, 98: 769–776. DOI: 10.1210/jc.2012-2270 |
| [8] | DOUGLAS R S, NAIK V, HWANG C J, AFIFIYAN N F, GIANOUKAKIS A G, SAND D, et al. B cells from patients with Graves' disease aberrantly express the IGF-1 receptor: implications for disease pathogenesis[J]. J Immunol, 2008, 181: 5768–5774. DOI: 10.4049/jimmunol.181.8.5768 |
| [9] | SALMIN W D, DAUGHADAY W H. A hormonally controlled serum factor which stimulates sulfate incorporation by cartilage in vitro[J]. J Lab Clin Med, 1957, 49: 825–836. |
| [10] | SHERLOCK M, TOOGOOD A A. Aging and the growth hormone/insulin like growth factor-Ⅰ axis[J]. Pituitary, 2007, 10: 189–203. DOI: 10.1007/s11102-007-0039-5 |
| [11] | SAX A T, JENKINSDG, DEVIN J L, HUGHES G I, BOLAM K A, SKINNER T L. The insulin-like growth factor axis: a biological mechanism linking physical activity to colorectal cancer survival[J]. Cancer Epidemiol, 2014, 38: 455–459. DOI: 10.1016/j.canep.2014.05.011 |
| [12] | VALYASEVI R W, ERICKSON D Z, HARTENECK D A, DUTTON C M, HEUFILDER A E, JYONOUCHI S C, et al. Differentiation of human orbital preadipocyte fibroblasts induces expression of functional thyrotropin receptor[J]. J Clin Endocrinol Metab, 1999, 84: 2557–2562. |
| [13] | JIA D, HEERSCHE J N. Insulin-like growth factor-1 and -2 stimulate osteoprogenitor proliferation and differentiation and adipocyte formation in cell populations derived from adult rat bone[J]. Bone, 2000, 27: 785–794. DOI: 10.1016/S8756-3282(00)00400-2 |
| [14] | ROOF S R, BOSLETT J, RUSSELLD, DEL RIO C, ALECUSAN J, ZWEIER J L, et al. Insulin-like growth factor 1 prevents diastolic and systolic dysfunction associated with cardiomyopathy and preserves adrenergic sensitivity[J]. Acta Physiol (Oxf), 2016, 216: 421–434. DOI: 10.1111/apha.2016.216.issue-4 |
| [15] | SATO T, NAGAFUKU M, SHIMIZU K, TAIRA T, IGARASHI Y, INOKUCHI J. Physiological levels of insulin and IGF-1 synergistically enhance the differentiation of mesenteric adipocytes[J]. Cell Biol Int, 2008, 32: 1397–1404. DOI: 10.1016/j.cellbi.2008.08.010 |
| [16] | ZHAO P, DRNG Y, GU P, WANG Y, ZHOU H, HU Y, et al. Insulin-like growth factor 1 promotes the proliferation and adipogenesis of orbital adipose-derived stromal cells in thyroid-associated ophthalmopathy[J]. Exp Eye Res, 2013, 107: 65–73. DOI: 10.1016/j.exer.2012.11.014 |
| [17] | BURTURM D, ZHU Z, LU D, ANDERSON D M, PREWETT M, PEREIRA D S, et al. A fully human monoclonal antibody to the insulin-like growth factor Ⅰ receptor blocks ligand-dependent signaling and inhibits human tumor growth in vivo[J]. Cancer Res, 2003, 63: 8912–8921. |
| [18] | MCCOY A N, KIM D S, GILLESPIE E F, ATKINS S J, SMITH T J, DOUGLAS R S. Rituximab (Rituxan) therapy for severe thyroid-associated ophthalmopathy diminishes IGF-1R+ T cells[J/OL]. J Clin Endocrinol Metab, 2014, 99: E1294-E1299. doi: 10.1210/jc.2013-3207. |
 2016, Vol. 37
2016, Vol. 37


