在受到电离辐射时,机体内的水分子被电离激发产生自由基,自由基可作用于其周围的生物大分子,发生连锁反应,通过原子转移反应、加成反应及单电子转移反应等,使自由基蔓延下去,产生脂类自由基、嘧啶自由基等,破坏核酸、蛋白质、糖类及脂类化合物的结构,从而损害细胞的结构和功能,造成机体的进一步损伤。国内外对辐射防护剂的研究重点是缓解和阻断电离辐射产生大量自由基的间接作用,迄今为止,还未发现一种比较理想的辐射防护剂。
氢是自然界最简单的元素,氢气无色、无嗅、无味,是具有一定还原性的双原子气体。生物学家在过去一直认为氢气属于生理性惰性气体,但研究发现氢气不仅不是生理性惰性气体,还是一种非常理想的抗氧化物质,可以特异性中和羟自由基[1]。2007年,日本Ohsawa教授首先在Nature Medicine杂志上报道称动物呼吸2%的氢气就可显著改善脑缺血再灌注损伤[1]。短短几年时间,氢气已被证明对脑、脊柱、眼、耳、肺、心、肝、肾、胰腺、肠、血管等全身多个脏器的疾病以及代谢系统疾病、炎症及变态反应疾病均有明显的疗效,适应证多达40余种[2]。研究发现氢气对辐射引起的损伤也具有明显的保护作用[2~7]。
富氢水对辐射损伤的防护研究目前多集中在大、小鼠等啮齿类动物和体外细胞学研究方面。Beagle犬是生物学实验中经常用到的非啮齿类动物,但目前还未见有关富氢水对Beagle犬辐射损伤保护作用的研究报道。本实验室前期研究了不同受照剂量及照后不同时间点人外周血淋巴细胞差异基因的表达变化,并对辐射相关基因进行了筛选[8~10]。本研究探讨了2.0 Gy 60Co γ射线照射6 h后Beagle犬淋巴细胞基因的表达变化,为富氢水在辐射防护中的作用机制研究提供实验数据。
1 材料和方法 1.1 试剂与仪器淋巴细胞分离液、D-hank’s液(北京索来宝科技有限公司),TRIzol试剂(美国Invitrogen公司),RNeasy Mini Kit试剂盒(德国QIAGEN公司),PrimerScript RT reagent Kit试剂盒(大连TaKaRa公司),Agilent Canine(V2) Gene Expression 4×44K芯片(上海欧易生物医学科技有限公司)。ENH-1000便携式溶解氢测定仪(日本Trustlex公司),NW20VF超纯水系统(香港力康生物医疗科技公司),9700型PCR仪(美国ABI公司),LightCycler 480Ⅱ型荧光定量PCR仪(瑞士Roche公司)。
1.2 实验动物雄性Beagle犬,体质量7.5~9.5 kg,购自军事医学科学院实验动物中心[生产许可证号:SCXK(军)2012-002,合格证号:0020182]。动物于普通环境中饲养[使用许可证号:SYXK(晋)2013-0002],自由饮水,用北京科澳协力饲料有限公司生产的犬维持饲料喂饲,每天上、下午各150 g,定量限饲。
1.3 辐照条件60Co γ射线腹部中心照射,照射剂量2.0 Gy,照射剂量率0.5 Gy/min,照射在中国辐射防护研究院辐照中心完成。
1.4 富氢水的制备密闭压力容器中装入纯化水,用真空泵抽真空10 min后,通入压力为0.4 MPa的氢气,过夜后制备富氢水。氢气浓度>0.5 mmol/L。
1.5 动物分组及给药动物经30 d检疫期后,按照体质量随机分为对照组、单纯照射组、富氢水组,每组5只,共15只Beagle犬。对照组接受1.5%戊巴比妥钠(2 mL/kg)的麻醉处理,不照射;单纯照射组经1.5%戊巴比妥钠(2 mL/kg)麻醉后,接受2.0 Gy 60Co γ射线照射;富氢水组在照射前5 d经灌胃给予富氢水(10 mL/kg),每天1次,照射前30 min再次给予富氢水(10 mL/kg)。照射后6 h采集各组Beagle犬外周血,分离淋巴细胞,提取RNA。
1.6 淋巴细胞及RNA提取每只Beagle犬经前肢头静脉采血5 mL,肝素抗凝,用等体积的D-hank’s液在无菌条件下稀释混匀,沿离心管壁加到等体积淋巴细胞分离液的液面上,2 000 r/min(离心半径15 cm)离心20 min。离心结束后,小心吸取第2层淋巴细胞,加入等体积D-hank’s液,2 000 r/min 离心10 min,倒掉上清液,同样方法重复洗涤1次。RNA的提取按照TRIzol试剂盒说明书进行,RNA的纯化按照RNeasy Mini Kit试剂盒说明书进行。
1.7 探针标记与杂交用纯化后的RNA合成cDNA,再进行荧光标记的cRNA的合成、纯化及浓度测定,最后进行芯片杂交。
1.8 GO(gene ontology)与KEGG(Kyoto encyclopedia of genes and genomes)富集分析差异表达基因对筛选出的差异表达基因进行GO分析,统计每个GO语义中所包含的差异基因个数,并用统计检验的方法计算每个GO 语义中差异基因富集的显著性;按照生物学过程、细胞组分和分子功能3个方面列表并注释。结合KEGG数据库,对差异表达基因进行通路显著性分析,分析每个通路中所包含的差异基因个数,计算每个通路中差异基因富集的显著性。
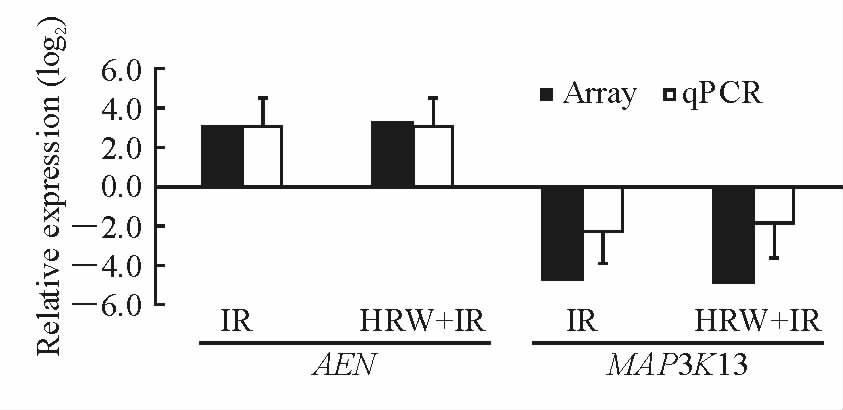
1.9 基因芯片结果验证采用SYBR Green 实时荧光定量PCR技术,以ACTB(肌动蛋白-β,引物序列F:5′-GGC AGG TCA TCA CTA TTG G-3′,R:5′-ATG ATG GAG TTG AAG GTA GTT T-3′)为内参基因,选择表达上调基因AEN(凋亡增强核酸酶,引物序列F:5′-CAT GGC GAT GTC CTC TAT G-3′,R:5′-GGA GCT TGA GGA TCT CTT TC-3′)和表达下调基因MAP3K13(促分裂原活化蛋白激酶激酶激酶13,引物序列F:5′-TGT ACT GTC AGT GTG AAC TTA G-3′,R:5′-TGG TCT GTG AGG ATG GTA AC-3′)对芯片结果进行验证。PCR扩增条件:95℃ 10 min;95℃ 10 s、60℃ 30 s,40个循环。采用2-ΔΔCt法计算2条基因表达量的比值,ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt实验组样品-ΔCt对照组样品;比值>1.00表示相对于对照样品该基因表达上调,比值<1.00表示相对于对照样品该基因表达下调。
2 结 果 2.1 差异表达基因用基因芯片检测2.0 Gy 60Co γ射线照射后6 h Beagle犬外周血淋巴细胞的基因表达情况,单纯照射组筛选出差异表达2倍以上的基因4 730条,其中上调表达基因2 147条,下调表达基因2 583条;差异表达3倍以上的基因1 907条,其中上调表达基因895条,下调表达基因1 012条;差异表达5倍以上的基因783条,其中上调表达基因423条,下调表达基因360条;差异表达10倍以上的基因240条,其中上调表达基因127条,下调表达基因113条;差异表达20倍以上的基因61条,其中上调表达基因34条,下调表达基因27条。
富氢水组筛选出差异表达2倍以上的基因4 493条,其中上调表达基因2 139条,下调表达基因2 354条;差异表达3倍以上的基因1 804条,其中上调表达基因797条,下调表达基因1 007条;差异表达5倍以上的基因781条,其中上调表达基因351条,下调表达基因430条;差异表达10倍以上的基因221条,其中上调表达基因119条,下调表达基因102条;差异表达20倍以上的基因54条,其中上调表达基因33条,下调表达基因21条。
只在单纯照射组中差异表达2倍以上的基因有3 124条,只在富氢水组中差异表达2倍以上的基因有2 887条,而在单纯照射组与富氢水组中表达均2倍以上的共同差异表达基因有1 606条(图 1)。

|
图 1 单纯照射组和富氢水组部分差异表达基因 Fig 1 Heatmap of differentially expressed genes in IR group and HRW+IR group IR: Irradiation; HRW: Hydrogen-rich water treatment |
2.2 差异表达基因的GO富集分析 2.2.1 单纯照射组
根据GO分析对基因的注释,对单纯照射组4 730条差异表达2倍以上的基因进行生物学过程、细胞组分及分子功能的分类,各有10、9和3个功能簇。生物学过程分析表明,差异表达基因主要涉及免疫应答、炎症应答、创伤应答、急性炎症应答、急性期反应、防御反应、T细胞活性调节、白细胞分化、白细胞活性和有机物反应。细胞组分分析表明,差异表达基因主要涉及细胞外区域部分、细胞外隙、细胞外区域、不溶性组分、细胞组分、细胞膜组分、水泡组分、微粒体和质膜外侧。分子功能分析表明,差异表达基因主要涉及细胞因子活性、丝氨酸内肽酶抑制剂活性和肽酶抑制剂活性。
2.2.2 富氢水组根据GO分析对基因的注释,对富氢水组4 493条差异表达2倍以上的基因进行生物学过程、细胞组分及分子功能的分类,各有15、3和4个功能簇。生物学过程分析表明,差异表达基因主要涉及创伤应答、炎症应答、免疫应答、防御反应、激素分泌调控、细胞因子生成调控、多细胞生物过程的正调控、细胞定位调控、运动行为、细胞增殖调控、趋性、趋化作用、分泌调控、细胞因子生成正调控和白细胞介素6生成调控。细胞组分分析表明,差异表达基因主要涉及细胞外区域、细胞外区域部分和细胞外隙。分子功能分析表明,差异表达基因主要涉及G蛋白偶联嘌呤核苷酸受体活性、G蛋白偶联核苷酸受体活性、嘌呤核苷酸受体活性和核苷酸受体活性。
2.2.3 单纯照射组与富氢水组比较单纯照射组与富氢水组差异表达基因共同涉及的生物学过程包括创伤应答、炎症应答、免疫应答及防御反应;单纯照射组与富氢水组差异表达基因共同涉及的细胞组分包括细胞外区域部分、细胞外隙及细胞外区域。
2.3 差异表达基因的KEGG通路分析 2.3.1 单纯照射组将单纯照射组差异表达2倍以上的基因进行KEGG通路分析,结果表明其共涉及19条通路,分别是DNA复制、造血细胞系、错配修复、p53信号通路、细胞因子-细胞因子受体相互作用、细胞周期、碱基切除修复、P450细胞色素代谢异生物质、药物代谢、叶酸碳库、肌萎缩性脊髓侧索硬化、天然杀伤细胞介导细胞毒性、癌症途径、背腹轴形成、甲烷代谢、组氨酸代谢、核苷切除修复、嘧啶代谢作用和视黄醇代谢。
2.3.2 富氢水组将富氢水组差异表达2倍以上的基因进行KEGG通路分析,结果表明其共涉及24条通路,分别是造血细胞系、细胞因子-细胞因子受体相互作用、癌症途径、碱基切除修复、p53信号通路、黏着斑、小细胞肺癌、胞外基质受体相互作用、过氧化物酶体增殖物激活受体信号通路、花生四烯酸代谢、细胞黏附分子、乙醚脂质体代谢、肥厚型心肌病、移植物抗宿主病、补体和凝血连锁、扩张型心肌病、α-亚麻酸代谢、膀胱癌、朊病毒病、钙信号通路、1型糖尿病、凋亡、亚油酸代谢和甘油脂代谢。
2.3.3 单纯照射组与富氢水组比较单纯照射组与富氢水组差异表达基因共同涉及的通路有5条:造血细胞系、p53信号通路、细胞因子-细胞因子受体相互作用、碱基切除修复和癌症途径。
2.4 实时荧光定量PCR对差异表达基因的验证结果2条验证基因AEN与MAP3K13的扩增曲线平滑,每条曲线均有明显的指数扩增期,说明该PCR检测具有较好的敏感性。2条基因的熔解曲线均为单一峰,未出现其他异常波形,说明扩增产物单一,PCR扩增的特异性较好。应用2-ΔΔCt法进行相对定量分析,结果表明所选基因的表达变化趋势与芯片结果一致,芯片数据可靠。扩增的相对定量结果见图 2。
|
图 2 实时荧光定量PCR验证结果 Fig 2 Results of the real-time quantitative PCR IR: Irradiation; HRW: Hydrogen-rich water treatment. PCR: Polymerase chain reaction; AEN: Apoptosis enhancing nuclease; MAP3K13: Mitogen-activated protein kinase kinase kinase 13. n=5,x±s |
3 讨 论
淋巴细胞是对射线最敏感的细胞之一[11],因此以外周血淋巴细胞的变化作为研究辐射损伤机制的方法具有一定的优势。电离辐射对生物体的作用非常复杂,有许多基因通过多种途径参与其中,并且各个阶段也有所不同,除了机体系统遭受破坏之外,还可能增强某些效应,诱导细胞一部分基因表达增强,并抑制其他基因的表达。汤忠祝等[12]研究发现,电离辐射和其他DNA损伤因子可以引起许多哺乳类细胞中多达数百种基因变化,其中有一些可能是特异性辐射损伤反应(如一些DNA损伤修复基因和机体内隐伏病毒基因激活等),更多的则是电离辐射触发非特异性损伤的“共同通路”反应基因,如生长因子、细胞周期蛋白和许多原癌基因的活动等。
本研究发现,Beagle犬经2.0 Gy 60Co γ射线照射后6 h,单纯照射组筛选出差异表达2倍以上的基因4 730条,富氢水组筛选出差异表达2倍以上的基因4 493条,其中只在单纯照射组中差异表达2倍以上的基因有3 124条,而只在富氢水组中差异表达2倍以上的基因有2 887条。王治东等[13]采集健康成人外周血,经0.75、2和6 Gy 60Co γ射线照射后利用全基因组芯片筛选差异表达基因,结果发现POLH和TNFSF9基因在2 Gy和6 Gy照射组中均表达上调;李坤等[14]采用5 Gy X射线照射淋巴母细胞AHH-1,6 h后检测基因表达谱的变化发现,BMP2基因表达下调,BAX基因表达上调;Ghandhi等[15]采用 4.45 Gy X射线照射正常人外周血,24 h后检测基因表达谱的变化,发现TNFSF9、BAX基因表达上调,PTGDS基因表达下调。在本研究中,同样发现单纯照射组TNFSF9、BAX基因表达上调,而富氢水组POLH基因表达下调、BMP2和PTGDS基因表达上调。KEGG通路分析表明,上述TNFSF9、BMP2、BAX等基因的变化涉及细胞因子-细胞因子受体相互作用、p53信号通路、癌症途径等多条信号通路。
GO分析包括生物学过程分析、细胞组分分析和分子功能分析。GO富集分析结果显示,单纯照射组与富氢水组差异表达基因的共同生物学过程功能簇包括创伤应答、炎症应答、免疫应答和防御反应;只从单纯照射组中筛选出的生物学过程功能簇有6个,只从富氢水组中筛选出的生物学过程功能簇有11个。结果显示,照射后6 h单纯照射组与富氢水组的差异基因均参与了辐射应答过程,并且给予富氢水后,差异表达基因涉及多个生物学调控过程。由GO分析中的细胞组分分析可以看出,经γ射线照射后6 h差异表达基因分布在细胞的不同组分,但给予富氢水后差异表达基因主要分布于胞外。分子功能分析显示,单纯照射组与富氢水组差异表达基因的富集功能各不相同,提示两组间的辐射应答机制有显著差异。
龙贤辉等[16]研究发现,比较2 Gy和10 Gy γ射线照射正常人淋巴母细胞基因表达谱同时上调的9个基因以及表达下调的11个基因,其中表达下调的基因几乎都与细胞间信号转导、细胞周期调控相关。本实验结合KEGG通路分析发现,单纯照射组与富氢水组差异表达2倍以上的基因的共同KEGG通路有5条,包括造血细胞系、p53信号通路、细胞因子-细胞因子受体相互作用、碱基切除修复和癌症途径;只在单纯照射组中差异表达的通路有14条,只在富氢水组中差异表达的通路有19条。结果显示单纯照射组与富氢水组受照后均激活多条不同信号通路。
上述研究结果表明,经2.0 Gy 60Co γ射线照射后6 h,Beagle犬外周血淋巴细胞中大量基因发生差异表达,给予富氢水后仍有大量基因发生差异表达,但参与辐射应答的基因发生了显著差异。单纯照射组与富氢水组的基因差异表达涉及多种生物学过程、细胞组分及分子功能的改变及多条信号通路的激活。下一步我们将对本研究结果从蛋白水平、转录调控等方面进行更深入的研究,以探讨富氢水对辐射损伤防护的作用机制。
| [1] | OHSAWA I, ISHIKAWA M, TAKAHASHI K, WATANABE M, NISHIMAKI K, YAMAGATA K, et al. Hydrogen acts as a therapeutic antioxidam by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13: 688–694. DOI: 10.1038/nm1577 |
| [2] | OHTA S, NAKAO A, OHNO K. The 2011 Medical Molecular Hydrogen Symposium: an inaugural symposium of the journal Medical Gas Research[J]. Med Gas Res, 2011, 1: 10. DOI: 10.1186/2045-9912-1-10 |
| [3] | TERASAKI Y, OHSAWA I, TERASAKI M, TAKAHASHI M, KUNUGI S, DEDONG K, et al. Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress[J]. Am J Physiol Lung Cell Mol Physiol, 2011, 301: L415–L426. DOI: 10.1152/ajplung.00008.2011 |
| [4] | QIAN L, CAO F, CUI J, WANG Y, HUANG Y, CHUAI Y, et al. The potential cardioprotective effects of hydrogenin in irradiated mice[J]. J Radiat Res, 2010, 51: 741–747. DOI: 10.1269/jrr.10093 |
| [5] | QIAN L, LI B, CAO F, HUANG Y, LIU S, CAI J, et al. Hydrogen-rich PBS protects cultured human cells from ionizing radiation-induced cellular damage[J]. Nucl Technol Radiat Prot, 2010, 25: 23–29. DOI: 10.2298/NTRP1001023Q |
| [6] | CHUAI Y, GAO F, LI B, ZHAO L, QIAN L, CAO F, et al. Hydrogen-rich saline attenuates radiation-induced male germ cell loss in mice through reducing hydroxyl radicals[J]. Biochem J, 2012, 442: 49–56. DOI: 10.1042/BJ20111786 |
| [7] | KANG K M, KANG Y N, CHOI I B, GU Y, KAWAMURA T, TOYODA Y, et al. Effects of drinking hydrogen-rich water on the quality of life of patients treated with radiotherapy for liver tumors[J]. Med Gas Res, 2011, 1: 11. DOI: 10.1186/2045-9912-1-11 |
| [8] | 李建国, 闻建华, 左雅慧, 秦秀军, 张伟, 王小莉. 0.2 Gy γ射线照射人外周血淋巴细胞不同时间点差异基因表达谱研究[J]. 辐射防护, 2010, 30: 220–225. |
| [9] | 李建国, 秦秀军, 张伟, 许超琪, 李炜宾, 党旭红, 等. 人外周血淋巴细胞照射后6小时差异基因表达谱的变化[J]. 中国辐射卫生, 2011, 20: 41–45. |
| [10] | 李建国, 张伟, 许超琪, 王永丽, 秦秀军, 李炜宾. 1.0 Gy 60Co γ射线诱导人淋巴细胞基因表达的改变[J].辐射防护通讯, 2010, 31: 19–25. |
| [11] | 曹飞.富H2溶液的辐射防护效应及其机制研究[D].上海:第二军医大学,2013. |
| [12] | 汤忠祝, 周翔, 罗志强, 杨谷一, 朱远. 基因芯片分析10 Gy γ射线照射后肺癌细胞株H1299基因表达谱变化[J]. 肿瘤学杂志, 2008, 14: 377–380. |
| [13] | 王治东, 沈丽萍, 林仲武, 张学清, 李孝鑫, 陈英. 利用基因芯片筛选辐射损伤早期生物标志物[J]. 辐射研究与辐射工艺学报, 2014, 32: 050205. DOI: 10.11889/j.1000-3436.2014.rrj.32.050205 |
| [14] | 李坤, 刘伟, 侯殿俊, 乔建伟, 马娅, 贾喜明, 等. 高低剂量X射线照射正常人淋巴母细胞基因表达转录谱的研究[J]. 中华放射医学与防护杂志, 2012, 32: 249–254. |
| [15] | GHANDHI S A, SMILENOV L B, ELLISTON C D, CHOWDHURY M, AMUNDSON S A. Radiation dose-rate effects on gene expression for human biodosimetry[J]. BMC Med Genomics, 2015, 8: 22. DOI: 10.1186/s12920-015-0097-x |
| [16] | 龙贤辉, 徐勤枝, 贺性鹏, 安静, 隋建丽, 白贝, 等. 2 Gy和10 Gy γ射线照射正常人淋巴母细胞基因表达转录谱的比较[J]. 中华放射医学与防护杂志, 2006, 26: 110–112. |
 2016, Vol. 37
2016, Vol. 37


