胃肠手术患者术后胃肠道存在损伤,为避免对胃肠道的功能造成影响,促进胃肠道加速修复,术后一段时间需禁饮、禁食。为满足机体营养需求,禁饮禁食的患者只能采用肠外营养支持,但应激状态下患者易发生应激性高血糖或胰岛素抵抗,影响患者术后恢复并增加并发症的发生率。因此,临床多在术后同时进行胰岛素强化治疗来控制血糖,但这会导致低血糖发生率的上升[1~2]。连续实时血糖监测系统(real-time continuous glucose monitoring system,RT-CGMS)可以实时监测患者的血糖变化,有利于及时调整胰岛素用量,从而严格控制血糖,已在临床上得到了广泛应用[3]。本研究对胜利油田中心医院重症医学科在胃肠术后需行胰岛素强化治疗的肠外营养支持患者,分别采用RT-CGMS监测和多次末梢血糖监测两种方式进行血糖监测,根据患者血糖变化情况及低血糖发生率评价两种监测方法对临床工作的指导意义,现报告如下。
1 资料和方法 1.1 研究对象选取2011年3月至2013年4月在胜利油田中心医院胃肠外科行胃大部切除术及结肠、直肠癌根治术的高血糖患者32例。所有患者因病情危重均转入重症医学科并行肠外营养治疗,均接受4~9 d 胰岛素强化治疗,其中男19例、女13例,年龄21~78岁。纳入标准:胃大部切除术及结肠、直肠癌根治术后高血糖,需肠外营养并胰岛素强化治疗;在重症医学科停留时间>3 d,入科时血糖>13.9 mmoL/L;年龄20~80岁。排除标准:严重肝、肾功能衰竭者;伴有急性心肌梗死、急性脑梗死、严重脓毒血症者;孕妇及哺乳期患者;监测未超过3 d者;拒绝参加研究者。根据血糖监测方案不同将患者分为两组:连续实时血糖监测组(RT-CGMS组)患者采用RT-CGMS(Mini Link,Medtronic公司生产)进行血糖监测;多点血糖监测组(对照组)患者采用ONETOUCH Ultra床旁血糖仪(美国LifeScan公司)进行每日多点血糖监测。
1.2 治疗方法两组患者均采用静脉持续泵入胰岛素的治疗方案,根据血糖监测结果调整药物用量。
1.3 两组患者的血糖监测及控制方法RT-CGMS组患者均全程佩戴Guardian®RRT CGMS,在血糖监测期间每天监测4次指尖血糖(每隔6 h监测一次),且每人需要监测2次静脉血糖。监测期间管床护士能够做到:(1)熟练应用床旁血糖仪监测指血血糖,每6 h监测一次,并将所测的指血血糖值输入到Guardian® RRT CGMS监测仪中;(2)明确如何消除报警程序,当出现报警时能予以合理的处理,如无法消除报警则及时通知医师消除。对照组根据患者血糖变化情况,每1~2 h应用床旁血糖仪测量1次指尖血糖。监测过程中根据检测血糖的结果调整胰岛素的剂量,当血糖值下降至7.8~10.0 mmol/L时,停止静脉泵入胰岛素;当血糖值低于5.0 mmol/L时,静脉推注50%葡萄糖注射液20 mL,同时加强观察对照组情况,如胰岛素的输入速度>4 U/h或患者血糖的波动较大时,可将测量指尖血糖的时间间隔缩短为每小时1次。在整个治疗过程中,可通过监测患者血糖值的变化情况及胰岛素的应用剂量,估算患者对胰岛素的大致需求情况,提前调整胰岛素的剂量。
1.4 两组患者的营养供给两组患者术后第1~2天能量摄入均以葡萄糖为主,平均每人每天给予150 g,术后3 d起肠外营养的非蛋白热量为84 kJ/(kg·d)、葡萄糖与脂肪比值为1∶1、热氮比为133∶1。将葡萄糖、脂肪乳、氨基酸及其他营养素在我院静配中心混合配制成“全合一”营养液,俗称“三升袋”,通过中心静脉采用循环输注法输注18~20 h/d。两组患者均按每千克体质量予以等氮等热量的肠外营养。
1.5 观察指标血糖值≤3.9 mmol/L时诊断为低血糖。记录两组患者监测的血糖值,分析RT-CGMS测定值与指尖血糖的相关性,比较两组患者每日血糖的平均值、最高值、最低值及血糖漂移和治疗过程中发生低血糖的情况。
1.6 统计学处理应用SPSS 17.0软件处理数据,根据不同的变量采用Pearson相关法分析RT-CGMS测定值与指尖血糖的相关性。计数资料比较采用χ2检验,计量资料比较用检验。检验水准(α)为0.05。
2 结 果 2.1 两组患者的一般资料RT-CGMS组共16例患者,其中男10例、女6例,年龄21~78岁;对照组共16例患者,其中男9例、女7例,年龄25~69岁。两组患者的一般资料差异无统计学意义(P>0.05,表 1),具有可比性。
|
|
表 1 两组患者的一般资料 |
2.2 两组患者的血糖变化情况
RT-CGMS组患者监测前3 d的平均血糖值分别为(10.12±2.33)、(9.01±3.20)、(8.56±2.48) mmol/L,均低于对照组 [(10.53±2.50)、(9.80±3.43)、(9.30±2.73) mmol/L],但差异无统计学意义(F=1.605,P>0.05)。两组患者的具体血糖漂移情况见表 2,可见RT-CGMS组患者的血糖最高值和血糖漂移均低于对照组(P<0.05),而血糖最低值高于对照组(P<0.05)。监测过程中RT-CGMS组发生了1次低血糖事件,而对照组发生了10次低血糖事件。
|
|
表 2 两组患者的血糖最高值、最低值及血糖漂移情况 |
2.3 RT-CGMS血糖测定值与指尖血糖的相关性分析
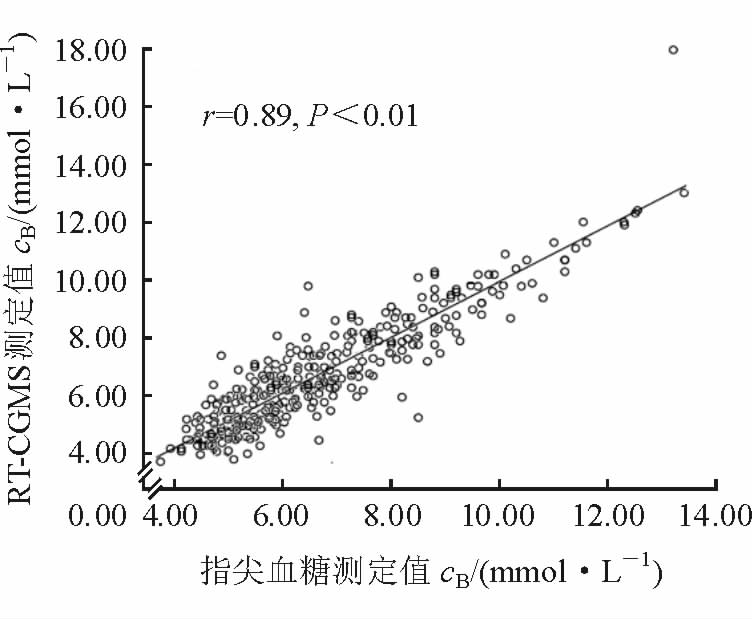
取340对配对的RT-CGMS血糖及指尖血糖测定值,以指尖血糖测定值为参考绘制RT-CGMS血糖值的散点图,结果显示RT-CGMS血糖测定值与指尖血糖的相关性良好(r=0.89,P<0.01;图 1)。
|
图 1 RT-CGMS血糖与指尖血糖测定值的相关性 RT-CGMS: 连续实时血糖监测 |
3 讨 论
胃肠道术后的患者机体处于手术创伤导致的应激状态,体内各种激素分泌紊乱,致使机体出现高代谢分解及物质代谢紊乱等不良反应,临床上往往表现为营养不良[4],进而导致刀口愈合时间延长,甚至出现刀口愈合困难、刀口感染增加及吻合口瘘等多种并发症,因此加强营养支持是胃肠道术后危重患者的重要治疗手段之一。由于患者胃肠道存在一定的创伤,难以耐受肠内营养,故一般予以肠外营养支持,虽然补充给机体的葡萄糖等物质的剂量仅用于维持生理需要,但临床上许多无糖尿病病史的危重患者也发生高血糖[5]。这种机体在持续强烈刺激下出现的反应性血糖升高,临床称为应激性高血糖,其在胃肠道术后的危重症患者中常有发生。目前临床上以2次随机血糖≥13.9 mmol/L或者随机空腹血糖≥7.8 mmol/L作为应激性高血糖的诊断标准[6]。
既往有学者认为早期血糖升高不仅可以为创伤部位的炎症组织修复提供能量,还有益于局部的抗感染和手术创伤的愈合[7]。但是目前认为对于胃肠手术后的危重患者来说,高血糖弊大于利。Davis等[8]对752例急危重症患者调查研究的结果显示,82.9%的收入监护室和抢救室的急危重症患者首次血糖升高,其中高于正常范围1倍的患者占45.1%,高于正常范围>1~2倍的占16.1%,高于正常范围3倍以上的占6.3%;而在死亡的23例患者中,血糖高于正常范围2~3倍的占21.7%,高于正常范围3倍以上的占78.3%;血糖高于正常范围1倍及以内的患者无死亡,提示急危重症患者的血糖水平上升幅度越大,病情越重,预后也越差。2002年国际糖尿病联盟(IDF)西太区的会议资料也表明伴有血糖升高的急危重症患者的抢救成功率仅仅是血糖正常患者的60%~70%[9]。
此外,在应用胰岛素控制血糖的过程中,低血糖是最常见和最危险的不良反应之一,若不能及时发现并纠正低血糖,可导致危重症患者的死亡率明显升高;而且低血糖的反复发生可过度兴奋交感神经,从而诱发心血管疾病[10]。相关研究表明,血糖的大幅度波动还能够通过触发氧化应激影响炎症反应的控制以及创伤的愈合[11]。
RT-CGMS可以实时监测组织液中的葡萄糖浓度,因此医师和患者能跟踪组织液中的葡萄糖浓度,判断高血糖和低血糖的发作。RT-CGMS 可以根据患者年龄、病程、胰岛功能、血糖控制情况等因素,在 2.2~21.6 mmol/L范围内个性化设置高、低血糖预警值。即使胰岛素敏感系数(insulin sensitivity index,ISI)、碳水化合物系数(insulin-to-carbohydrate ratio,ICR) 相同的患者注射相同量胰岛素和进食相同量碳水化合物,其血糖波动曲线也有差别;RT-CGMS可以帮助患者了解其进餐后的血糖变化与胰岛素作用规律,也可以通过图谱及实时组织液葡萄糖浓度了解运动对血糖的影响[12]。临床上由于在应用传统的点状指尖血糖监测时担心低血糖的发生,胰岛素的使用剂量明显偏小,从而导致患者的血糖常处于较高水平。为了更好地监测和控制血糖,点状监测血糖需要频繁的针刺采血,给患者带来了痛苦。而RT-CGMS则克服了这些缺点,它具有准确、连续、实时、可视、无痛等优点,能够让我们随时了解患者血糖水平,并可以通过计算患者血糖变化的速度来预估患者对胰岛素的需求量,从而可以及时大胆的调整胰岛素剂量,将患者的血糖更好地控制在一定范围之内。
本研究应用RT-CGMS监测血糖时,可以通过监测血糖值、血糖值变化速度及胰岛素的泵入速度来推断患者对胰岛素的需求量,在患者血糖未达到需要控制的上、下限值时便能及时调整胰岛素的用量,从而将患者的血糖平稳维持在一定范围内。当患者血糖因某些原因出现剧烈波动时,RT-CGMS所具备的报警系统可以及时提醒,从而及时处理(如补充高渗糖、加大胰岛素用量等措施)。本研究结果显示,RT-CGMS组患者的血糖最高值低于对照组,血糖最低值高于对照组,而血糖漂移小于对照组;其中RT-CGMS组发生了1次低血糖事件,而对照组发生了10次低血糖事件,可见RT-CGMS有助于临床严格控制血糖,为血糖控制和胰岛素强化治疗提供了支持,有望成为临床上严格控制血糖所必不可少的方法和措施。此外,RT-CGMS可使ICU需胰岛素强化治疗的患者从中获益,减少住院费用,有利于患者早日康复。
综上所述,RT-CGMS可以更好地监测患者的血糖变化情况,有利于医师及时合理地调整胰岛素泵入剂量,从而快速、平稳、安全地纠正重症患者的糖代谢紊乱情况,进而控制患者的血糖变化;同时由于RT-CGMS具有高、低血糖报警系统极大程度避免了低血糖及过高血糖的发生,将是胰岛素强化治疗所必不可少的措施。
| [1] | 江平. 不同术式胆囊切除对糖尿病患者血糖的影响[J]. 现代医学, 2010, 38: 557–558. |
| [2] | GUANG N. Study evaluates prevalence of diabetes among adults in China[J]. JAMA, 2013, 10: 161–163. |
| [3] | 黄鹏程. 30例急腹症合并糖尿病患者的围乎术期处理[J]. 现代医学, 2008, 36: 365–367. |
| [4] | 董瑞鸿. 新诊断2型糖尿病患者临床分析[J]. 山东医药, 2011, 51: 88. |
| [5] | 周岩. 144例糖尿病合并胆石症围手术期胰岛素泵强化治疗的临床观察[J]. 中国糖尿病杂志, 2006, 14: 29–30. |
| [6] | LY T T, NICHOLAS J A, RETTERATH A, DAVIS E A, JONES T W. Analysis of glucose responses to automated insulin suspension with sensor-augmented pump therapy[J]. Diabetes Care, 2012, 35: 1462–1465. DOI: 10.2337/dc12-0052 |
| [7] | RUBIN R R, PEYROT M; STAR 3 Study Group. Health-related quality of life and treatment satisfaction in the Sensor-Augmented Pump Therapy for A1C Reduction 3(STAR 3) trial[J]. Diabetes Technol Ther, 2012, 14: 143–151. DOI: 10.1089/dia.2011.0162 |
| [8] | DAVIS S N, HORTON E S, BATTELINO T, RUBIN R R, SCHULMAN K A, TAMBORLANE W V. STAR 3 randomized controlled trial to compare sensor-augmented insulin pump therapy with multiple daily injections in the treatment of type 1 diabetes: research design, methods, and baseline characteristics of enrolled subjects[J]. Diabetes Technol Ther, 2010, 12: 249–255. DOI: 10.1089/dia.2009.0145 |
| [9] | LY T T, NICHOLAS J A, RETTERATH A, LIM E M, DAVIS E A, JONES T W. Effect of sensor-augmented insulin pump therapy and automated insulin suspension vs standard insulin pump therapy on hypoglycemia in patients with type 1 diabetes: a randomized clinical trial[J]. JAMA, 2013, 310: 1240–1247. DOI: 10.1001/jama.2013.277818 |
| [10] | BUCKINGHAM B, BECK R W, RUEDY K J, CHENG P, KOLLMAN C, WEINZIMER S A, et al. Effectiveness of early intensive therapy on β-cell preservation in type 1 diabetes[J]. Diabetes Care, 2013, 36: 4030–4035. DOI: 10.2337/dc13-1074 |
| [11] | FRONTINO G, BONFANTI R, SCARAMUZZA A, RABBONE I, MESCHI F, RIGAMONTI A, et al. Sensor-augmented pump therapy in very young children with type 1 diabetes: efficacy and feasibility observational study[J]. Diabetes Technol Ther, 2012, 14: 762–764. DOI: 10.1089/dia.2012.0044 |
| [12] | KORDONOURI O, HARTMAN R, PANKOWSKA E, RAMI B, KAPELLEN T, COUTANT R, et al. Sensor augmented pump therapy from onset of type 1 diabetes: late follow-up results of the Pediatric Onset Study[J]. Pediatr Diabetes, 2012, 13: 515–518. DOI: 10.1111/pedi.2012.13.issue-7 |
 2016, Vol. 37
2016, Vol. 37


