外泌体(exosomes)是多泡体(multivesicular bodies,MVBs)与质膜融合后形成的直径为40~100 nm并释放到细胞外的膜性囊泡,电镜下呈双凹碟形或杯状[1]。外泌体可将其含有的多种特异性蛋白质、脂质和核酸传递到邻近或远距离的靶细胞中,发挥细胞间信息交流的作用,从而参与调节人体多个生理和病理过程。研究发现,外泌体中存在淀粉样前体蛋白,能参与阿尔茨海默病(Alzheimer disease,AD)的发生和发展;而在帕金森病(Parkinson disease,PD)患者的体液中也证实了外泌体与α突触核蛋白分泌有关[2],表明外泌体与中枢神经系统疾病的发病密切相关。本文综述了外泌体的生成及其在中枢神经系统疾病中的研究进展。
1 外泌体来源与内容物 1.1 外泌体的分泌和调节外泌体最初是质膜上网格蛋白被覆的微区域内陷形成的囊泡;内涵体分选复合物(endosomal sorting complexes required for transport,ESCRT)促使囊泡形成早期内涵体(early endosomes,EE);EE再次内陷形成管腔内囊泡(intraluminal vesicles,ILVs),即MVBs。MVBs既可以转化成溶酶体,也可以与质膜融合后释放到细胞外,形成外泌体[3](图 1)。
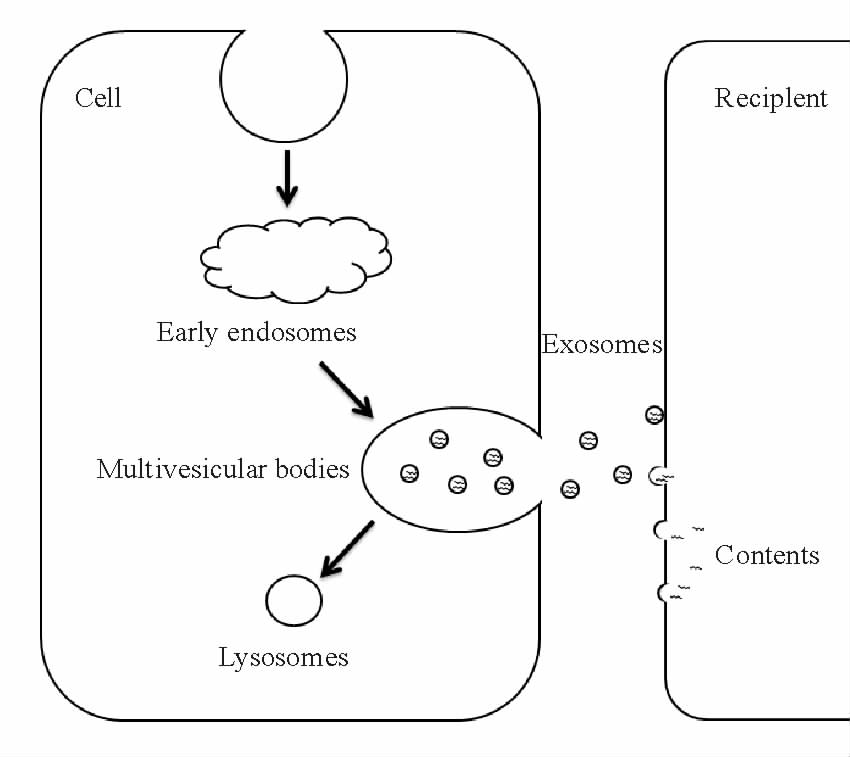
|
图 1 外泌体的分泌过程 Fig 1 The secretion process of exosomes |
Ostrowski等[4]研究发现Rab27a和Rab27b在MVBs融合质膜的过程中发挥调节作用,当Rab27a蛋白受到抑制时可以观察到MVBs数量的增多,而当Rab27b受到抑制时可以观察到MVBs在核周区域重新分布,因而Rab27蛋白的两种亚型在外泌体的分泌过程中发挥着不同作用。也有研究认为细胞内外泌体的形成不仅仅依赖于ESCRT,鞘脂神经酰胺也在其中发挥作用;纯化的外泌体中富含鞘脂神经酰胺,当中性鞘磷脂酶受到抑制后,分泌的外泌体数量明显减少[5]。对外泌体分泌调节机制的研究为阐明外泌体在中枢神经系统疾病中的作用提供了新手段。
1.2 外泌体内容物外泌体含有多种蛋白,如蛋白膜转运融合蛋白(GTPases,annexins,flotillin)、跨膜蛋白(CD9,CD63,CD81和CD82)、热休克蛋白(Hsc70,Hsp90)、源于MVBs的蛋白(Alix 和TSG101)以及脂质相关蛋白和磷脂酶[6]。尽管源于不同组织的外泌体含有多种不同蛋白,但其中部分蛋白是外泌体的特异性标志物,如TSG101、Alix、flotillin和Rab5b等,可利用蛋白质印迹法和酶联免疫吸附试验来进行检测,从而确认外泌体[7]。
外泌体也包含有丰富的脂质。起源于不同细胞的外泌体含不同的脂质成分,如磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸(PS)、神经酰胺、胆固醇和鞘磷脂等[8]。不同的脂质构成也赋予外泌体不同的生物学特性,如表达在外泌体膜的PS通过结合胞外不同的信号蛋白实现质膜的融合[9]。因此,外泌体质膜中PS活性水平的高低以及结合蛋白的不同可能影响外泌体的信息交流功能。
除了蛋白质和脂质,外泌体还包含microRNA(miRNA)、mRNA和其他非编码RNA[6]。研究表明,外泌体中含有的RNA与它们的亲代细胞并不相同[10]。然而,也有研究认为肿瘤细胞起源的外泌体含有与亲代相同的miRNA,可以作为肿瘤生物标志[11]。外泌体携带的RNA可以在受体细胞中表达,并且还能调节受体细胞的基因表达,从而发挥特定的生物学效应。
2 外泌体与神经系统疾病 2.1 外泌体与AD1978年就有研究发现AD患者的皮层神经元中存在大量MVBs[12]。其产生原因可能是细胞质膜表面β淀粉样蛋白42(Aβ42)的前体蛋白(amyloid precursor protein,APP)水解产生的肽片段被内体(endosomes)摄取,进一步形成MVBs,后者从细胞中释放形成含有淀粉样蛋白的外泌体[13]。外泌体中的淀粉样蛋白扩增集聚,并且通过外泌体扩散到其他组织中。当清除淀粉样蛋白的旁路受到抑制时,外泌体在毒性淀粉样蛋白的产生和积累过程中均具有重要作用[13]。然而,是淀粉样蛋白的聚集导致了清除机制的受损还是清除机制的受损导致了毒性淀粉样蛋白的聚集和传播,目前尚不清楚。
神经纤维缠结的主要成分为过度磷酸化的tau样蛋白。有研究认为小胶质细胞产生的tau样蛋白通过外泌体进行扩散,阻止外泌体的合成或者减少小胶质细胞均可以显著减少致病tau样蛋白的扩散[14]。这为我们治疗AD提供了潜在靶点。
2.2 外泌体与PD在神经退行性疾病中,PD的发病率仅次于AD。其特点是选择性黑质多巴胺能神经元变性坏死、纹状体多巴胺含量显著减少以及黑质残存神经元胞质内出现嗜酸性包涵体——路易氏体(Lewy body)[15]。路易氏体由可溶性蛋白聚集形成,其中α突触核蛋白(α-synuclein,α-Syn)是其主要组成成分[15]。α-Syn已被证实存在于PD患者的脑脊液、血液和唾液中,α-Syn的分泌机制尚不明确,但有研究发现α-Syn与外泌体分泌相关;存储于外泌体中的α-Syn释放、输送到相应靶细胞后,可导致细胞中α-Syn的集聚[16]。集聚的α-Syn毒样物质一般由星型胶质细胞和小胶质细胞清除,但胶质细胞过度摄取α-Syn会产生胶质包裹体,进一步加重炎症反应,导致了神经退行性改变[17]。有研究认为,来源于PD患者脑脊液中的外泌体可以诱导靶细胞中可溶性α-Syn的低聚化,促使疾病的进一步加剧[16]。另有研究发现,α-Syn可以诱导小胶质细胞分泌外泌体,并且可以激活外泌体表达较高水平的主要组织相容性复合体(MHC)和肿瘤坏死因子α(TNF-α)[18],表明激活的小胶质细胞分泌的外泌体在α-Syn诱导的PD中可能具有重要的调节作用。
2.3 外泌体与其他疾病朊病毒病是一种具有致命性且可遗传的神经退行性疾病。异常的朊病毒蛋白PrPsc可导致脑组织海绵状空泡的形成,从而引起神经元死亡[19]。 在朊病毒病的细胞和动物模型的原代培养神经元及脑脊液中分离出来的外泌体中,均可检测到丰富的朊病毒微粒[20]。在朊病毒病的发病过程中可观察到朊病毒蛋白在外泌体中蓄积,表明外泌体在朊病毒病的发病过程中发挥着一定作用[21]。
除了慢性神经退行性疾病外,外泌体也参与了神经系统的急性病变。Xin等[22]研究发现外泌体在脑卒中的恢复过程中发挥着保护作用,该研究小组通过基因工程改造间充质干细胞(MSC),使其释放富含miRNA(特别是miR133b)的外泌体,并且在脑卒中后24 h将改造后的MSC注射到大鼠的血液中,结果显示其相比对照组具有更好的神经修复和轴突可塑性。
3 外泌体与药物载体作为一种新型的药物运输载体外泌体具有非常多的优势,如低免疫原性、较高的运输效率、可穿透血脑屏障等,使得其可以成为有效的药物运输载体[23]。因此,未来的药物靶向治疗可以通过基因工程将mRNA、siRNA、蛋白质或其他药物分子封装于MVBs,使MVBs释放出含有药物分子的外泌体并输送到靶组织,从而发挥治疗作用。
Alvarez-Erviti等[24]报道静脉注射基因工程改造过的外泌体,可以将siRNA精确地运输到小鼠脑神经元细胞中。外泌体来源于自体树突状细胞,通过基因工程可使其膜表面表达与神经元细胞膜表面相融合的lamp2蛋白,再通过电穿孔的方式注入外源siRNA;膜表面表达特异性蛋白的外泌体可以将siRNA精确输送到大脑神经元,导致基因敲除[24]。另外,Zhuang等[25]报道将封装有姜黄素的外泌体通过鼻内注射的方式穿过血脑屏障送至大脑神经元,封装有姜黄素的外泌体可以显著降低脂多糖(LPS)引起的炎症和实验性自身免疫性脑脊髓炎脱髓鞘的严重程度。这些研究证实了外泌体作为药物运输载体可能具有潜在的临床应用价值,但其临床使用安全性尚需进一步的研究。
4 小 结外泌体是一种多效的生物活性载体,虽然其在神经生物研究领域中才刚刚起步,但已经越来越受到学者们的关注。进一步研究外泌体在神经系统疾病中的神经保护作用和作用机制,将利于我们系统地了解外泌体与疾病发生、发展的关系,对神经系统疾病的诊治具有重要的临床意义。
| [1] | EL ANDALOUSSI S, MÄGER I, BREAKEFIELD X O, WOOD M J. Extracellular vesicles: biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12: 347–357. DOI: 10.1038/nrd3978 |
| [2] | YUYAMA K, SUN H, MITSUTAKE S, IGARASHI Y. Sphingolipid-modulated exosome secretion promotes clearance of amyloid-β by microglia[J]. J Biol Chem, 2012, 287: 10977–10989. DOI: 10.1074/jbc.M111.324616 |
| [3] | DENZER K, KLEIJMEER M J, HEIJNEN H F, STOORVOGEL W, GEUZE H J. Exosome: from internal vesicle of the multivesicular body to intercellular signaling device[J]. J Cell Sci, 2000, 113(Pt 19): 3365–3374. |
| [4] | OSTROWSKI M, CARMO N B, KRUMEICH S, FANGET I, RAPOSO G, SAVINA A, et al. Rab27a and Rab27b control different steps of the exosome secretion pathway[J]. Nat Cell Biol, 2010, 12: 19–30. DOI: 10.1038/ncb2000 |
| [5] | TRAJKOVIC K, HSU C, CHIANTIA S, RAJENDRAN L, WENZEL D, WIELAND F, et al. Ceramide triggers budding of exosome vesicles into multivesicular endosomes[J]. Science, 2008, 319: 1244–1247. DOI: 10.1126/science.1153124 |
| [6] | VLASSOV A V, MAGDALENO S, SETTERQUIST R, CONRAD R. Exosomes: current knowledge of their composition, biological functions, and diagnostic and therapeutic potentials[J]. Biochim Biophys Acta, 2012, 1820: 940–948. DOI: 10.1016/j.bbagen.2012.03.017 |
| [7] | MATHIVANAN S, SIMPSON R J. Exocarta: a compendium of exosomal proteins and RNA[J]. Proteomics, 2009, 21: 4997–5000. |
| [8] | DARMOISE A, MASCHMEYER P, WINAU F. The immunological functions of saposins[J]. Adv Immunol, 2010: 25–62. |
| [9] | PICCIN A, MURPHY W G, SMITH O P. Circulating microparticles: pathophysiology and clinical implications[J]. Blood Rev, 2007, 21: 157–171. DOI: 10.1016/j.blre.2006.09.001 |
| [10] | MITTELBRUNN M, GUTIÉRREZ-VÁZQUEZ C, VILLARROYA-BELTRI C, GONZÁLEZ S, SÁNCHEZ-CABO F, GONZÁLEZ M A, et al. Unidirectional transfer of microrna-loaded exosomes from T cells to antigen-presenting cells[J]. Nat Commun, 2011, 2: 282. DOI: 10.1038/ncomms1285 |
| [11] | RABINOWITS G, GERÇEL-TAYLOR C, DAY J M, TAYLOR D D, KLOECKER G H. Exosomal microRNA: a diagnostic marker for lung cancer[J]. Clin Lung Cancer, 2009, 10: 42–46. DOI: 10.3816/CLC.2009.n.006 |
| [12] | PAULA-BARBOSA M M, MOTA CARDOSO R, FARIA R, CRUZ C. Multivesicular bodies in cortical dendrites of two patients with Alzheimer's disease[J]. J Neurol Sci, 1978, 36: 259–264. DOI: 10.1016/0022-510X(78)90086-2 |
| [13] | RAJENDRAN L, HONSHO M, ZAHN T R, KELLER P, GEIGER K D, VERKADE P, et al. Alzheimer's disease β-amyloid peptides are released in association with exosomes[J]. Proc Natl Acad Sci USA, 2006, 103: 11172–11177. DOI: 10.1073/pnas.0603838103 |
| [14] | GOETZL E J, BOXER A, SCHWARTZ J B, ABNER E L, PETERSEN R C, MILLER B L, et al. Altered lysosomal proteins in neural-derived plasma exosomes in preclinical Alzheimer disease[J]. Neurology, 2015, 85: 40–47. DOI: 10.1212/WNL.0000000000001702 |
| [15] | LEES A J, HARDY J, REVESZ T. Parkinson's disease[J]. Lancet, 2009, 373: 2055–2066. DOI: 10.1016/S0140-6736(09)60492-X |
| [16] | STUENDL A, KUNADT M, KRUSE N, BARTELS C, MOEBIUS W, DANZER K M, et al. Induction of α-synuclein aggregate formation by CSF exosomes from patients with Parkinson's disease and dementia with Lewy bodies[J]. Brain, 2016, 139. |
| [17] | VEKRELLIS K, XILOURI M, EMMANOUILIDOU E, RIDEOUT H J, STEFANIS L. Pathological roles of α-synuclein in neurological disorders[J]. Lancet Neurol, 2011, 10: 1015–1025. DOI: 10.1016/S1474-4422(11)70213-7 |
| [18] | CHANG C, LANG H, GENG N, WANG J, LI N, WANG X. Exosomes of Bv-2 cells induced by α-synuclein: important mediator of neurodegeneration in PD[J]. Neurosci Lett, 2013, 548: 190–195. DOI: 10.1016/j.neulet.2013.06.009 |
| [19] | DAS A S, ZOU W Q. Prions: beyond a single protein[J]. Clin Microbiol Rev, 2016, 29: 633–658. DOI: 10.1128/CMR.00046-15 |
| [20] | BERRONE E, CORONA C, MAZZA M, VALLINO COSTASSA E, FARO M L, PROPERZI F, et al. Detection of cellular prion protein in exosomes derived from ovine plasma[J]. J Gen Virol, 2015, 96: 3698–3702. DOI: 10.1099/jgv.0.000291 |
| [21] | FEVRIER B, VILETTE D, ARCHER F, LOEW D, FAIGLE W, VIDAL M, et al. Cells release prions in association with exosomes[J]. Proc Natl Acad Sci USA, 2004, 26: 9683–9688. |
| [22] | XIN H, LI Y, LIU Z, WANG X, SHANG X, CUI Y, et al. Mir-133b promotes neural plasticity and functional recovery after treatment of stroke with multipotent mesenchymal stromal cells in rats via transfer of exosome-enriched extracellular particles[J]. Stem Cells, 2013, 31: 2737–2746. DOI: 10.1002/stem.1409 |
| [23] | HA D, YANG N, NADITHE V. Exosomes as therapeutic drug carriers and delivery vehicles across biological membranes: current perspectives and future challenges[J]. Acta Pharm Sin B, 2016, 6: 287–296. DOI: 10.1016/j.apsb.2016.02.001 |
| [24] | ALVAREZ-ERVITI L, SEOW Y, YIN H, BETTS C, LAKHAL S, WOOD M J. Delivery of sirna to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29: 341–345. DOI: 10.1038/nbt.1807 |
| [25] | ZHUANG X, XIANG X, GRIZZLE W, SUN D, ZHANG S, AXTELL R C, et al. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain[J]. Mol Ther, 2011, 19: 1769–1779. DOI: 10.1038/mt.2011.164 |
 2016, Vol. 37
2016, Vol. 37


