肿瘤细胞增殖活跃,氨基酸代谢紊乱是其重要特征。氨基酸代谢依赖于氨基酸转运子的运输,大量研究显示,肿瘤细胞中氨基酸转运子的表达升高,其中钠耦合中性氨基酸转运子1 (sodium-coupled neutral amino acid transporter 1,SNAT1)负责谷氨酰胺的运输[1~3],近年来研究显示SNAT1在人类肿瘤中表达升高,与肿瘤的发生、发展和肿瘤患者的不良预后相关[4~7]。然而SNAT1在食管鳞癌中的研究较少,本研究旨在探讨SNAT1在食管鳞癌组织中的表达状况,并分析其与临床病理特点及预后的关系。
1 资料和方法 1.1 组织标本收集2002年9月到2006年8月我院病理科存档的183例食管鳞癌及对应癌旁组织石蜡标本。男性138例、女性45例;60岁及以下患者91例,60岁以上92例,中位年龄60.5岁;所有患者均未接受过任何治疗。本研究通过了医院伦理委员会审查,并获得患者的知情同意。临床病理诊断结果经两名病理科医师确认。
1.2 构建组织芯片根据文献[8]构建组织芯片。每位患者取2个肿瘤组织和1个癌旁组织,根据H-E染色切片确定代表性的病变部位,然后应用组织芯片构建仪(美国Beecher公司)制备组织芯片。
1.3 免疫组化检测采用S-P法S-P免疫组化试剂盒购自福州迈新生物技术开发有限公司,SNAT1抗体(货号:Ab59721)购自英国Abcam公司,稀释比例1∶100;磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.4 免疫组化结果判定[9]SNAT1阳性染色为淡黄色、棕黄色或棕褐色,定位于细胞质。采用二级计分法,阳性细胞数根据阳性细胞所占5个以上高倍镜视野比例计数:5%~25% 计1分;26%~50%计2分;51%~75%计3分;>75% 计4分。染色强度分类:淡黄色,计1分;黄或深黄色,计2分;褐或棕褐色,计3分。两者计分相乘大于1为阳性。
1.5 蛋白质印迹分析将2×上样缓冲液与已定量的组织样品蛋白1∶1混匀,注入上样孔,70~100 V电泳,350 mA转膜2 h,后将膜置于5%的脱脂牛奶中常温封闭1 h,加入1抗4℃过夜,β-actin抗体1∶5 000稀释,SNAT1抗体1∶500稀释。TBST洗膜3次,每次10 min,加入带有辣根过氧化物酶(HRP)标记的二抗,室温孵育2 h。TBST洗膜3次,每次10 min。根据ECL发光试剂盒操作说明曝光。
1.6 统计学处理应用SPSS 16.0软件进行统计学分析,计数资料采用χ2检验,生存分析采用Kaplan-Meier法和Cox多因素回归分析。检验水准(α)为0.05。
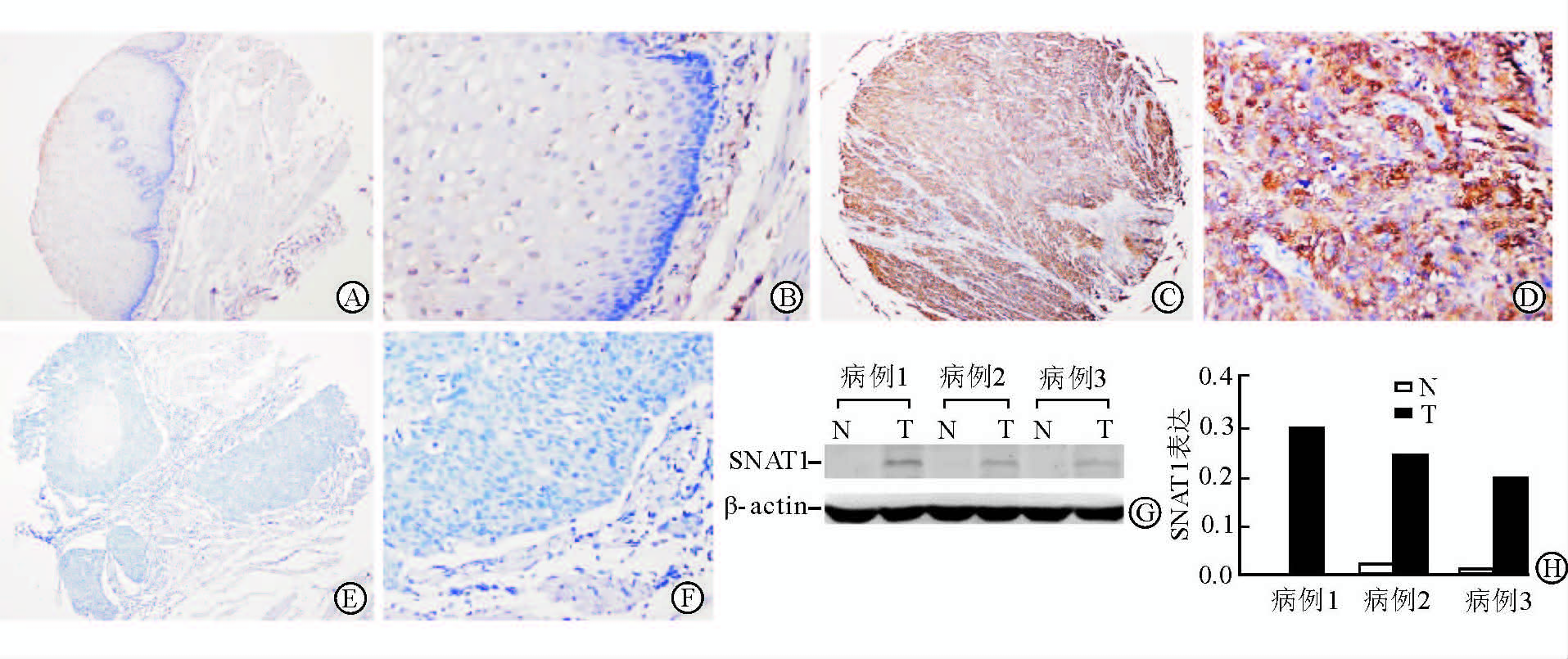
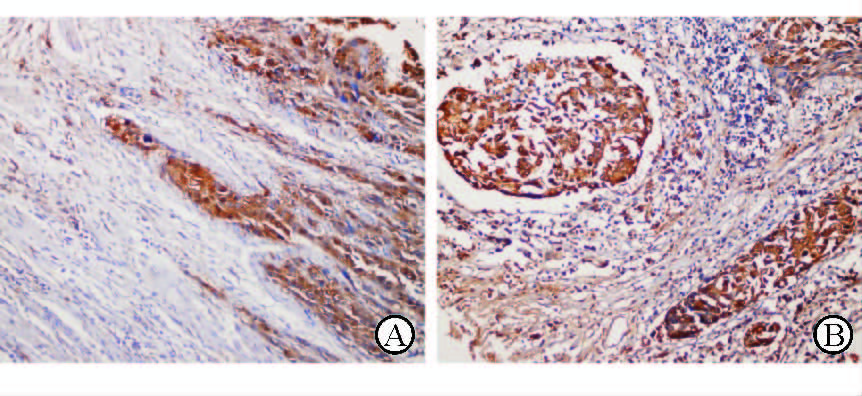
2 结 果 2.1 SNAT1在食管鳞癌组织中的表达免疫组化结果显示癌旁非肿瘤鳞状上皮组织中SNAT1不表达,肿瘤组织中SNAT1弥漫染色,呈淡黄至棕黄、棕褐色,主要定位于细胞质(图 1A~1F)。蛋白质印迹法也证实肿瘤组织中SNAT1的表达高于非肿瘤组织(图 1G~1H)。SNAT1在肿瘤组织中的表达率为45.4%(83/183)。此外,SNAT1在肿瘤侵袭的前沿和癌栓中的表达明显(图 2)。
|
图 1 SNAT1在食管鳞癌和癌旁组织中的表达 A,B: SNAT1在癌旁非肿瘤鳞状上皮组织中的表达; C,D: SNAT1在食管鳞癌组织中的阳性表达; E,F: SNAT1在食管鳞癌组织中的阴性表达; G,H: 蛋白质印迹法检测SNAT1在食管正常组织(N)和癌组织(T)中的表达. SNAT1: 钠耦合中性氨基酸转运子1. Original magnification: ×100 (A,C,E);×400 (B,D,F) |
|
图 2 SNAT1在食管鳞癌侵袭前沿(A)和癌栓(B)中的表达 SNAT1: 钠耦合中性氨基酸转运子1. Original magnification:×200 |
2.2 SNAT1过表达与临床病理参数间的关系
SNAT1的表达与性别、年龄、浸润深度和组织分化等临床参数无关,而与淋巴结转移(P=0.007)和TNM分期(P=0.003)有关,见表 1。
|
|
表 1 SNAT1与食管鳞癌临床病理参数间的关系 |
2.3 生存分析
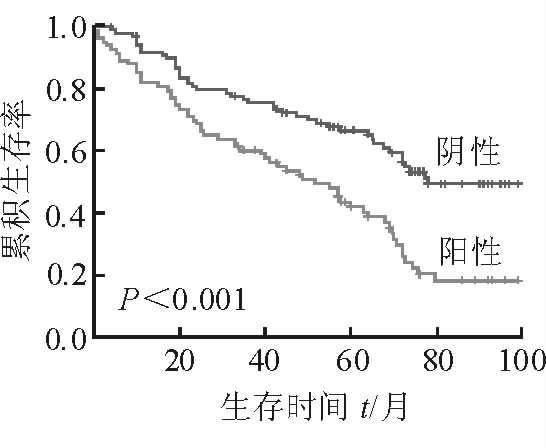
单因素分析发现,SNAT1阳性患者的总体生存期为52个月,阴性患者为78个月,两者间的差异有统计学意义(χ2=16.052,P<0.001;图 3)。Cox多因素回归分析显示,SNAT1是评估食管鳞癌患者预后的独立因素(P=0.004,表 2)。
|
图 3 SNAT1表达与食管鳞癌患者预后的关系 SNAT1: 钠耦合中性氨基酸转运子1 |
|
|
表 2 Cox多因素回归分析SNAT1表达与食管鳞癌患者预后的关系 |
3 讨 论
近年来食管癌发病率逐年上升,而且由于其侵袭性强,预后较差,其病死率占所有肿瘤的第6位[10]。食管癌的发病危险因素包括吸烟、热茶、酗酒、熏肉、口腔卫生差、水果和蔬菜摄入率低,以及社会经济地位低下等因素;此外遗传学因素在食管癌发病中的影响也逐渐受到重视[11]。目前研究显示氨基酸代谢异常是肿瘤细胞的一个重要现象,氨基酸转运子的异常活化促进了肿瘤的发生和进展[12]。其中A型氨基酸转运系统在肿瘤中的作用受到重视,尤其是SNAT1(SLC38A1/ATA1)在肝癌、胆管癌、乳腺癌和胃癌中的表达升高[4~7]。然而SNAT1在食管鳞癌中的研究少见,本研究初步研究了SNAT1蛋白在食管鳞癌中的表达,并分析了其临床意义和预后价值。
Wang等[4]研究显示,SNAT1在乳腺癌组织中的表达量高于非肿瘤组织;此外,其过表达与肿瘤大小、淋巴结转移、疾病进展以及Ki-67高表达相关。本研究发现,在食管上皮黏膜中SNAT1基本不表达,而肿瘤组织中SNAT1明显表达,而且越靠近肿瘤侵袭前沿其表达强度越高,癌栓中的表达也是明显增高,提示其过表达不仅参与了肿瘤发生,还参与了肿瘤的进展。通过分析其与临床参数的关系,发现SNAT1高表达与淋巴结转移以及疾病进展有关,进一步揭示了SNAT1具有促癌基因的功能。
食管癌侵袭性强,预后极差,即使接受手术治疗,晚期患者5年生存率也仅有30%左右[13]。临床分期和肿瘤侵犯程度是临床上判断食管癌患者预后的首选因素。近年来,生物学因素对于评估食管癌患者疾病的转归也起了重要作用,譬如NDRG2、p-mTOR、CD117 等[14~16]。前述研究显示SNAT1与食管癌恶性生物学特征高度相关,我们进一步分析了其预后价值。单因素生存分析显示SNAT1过表达的食管癌患者预后劣于SNAT1低表达的肿瘤患者;此外,多因素分析显示SNAT1过表达是判断食管癌患者预后的独立因素。此研究结果同既往在胆管癌中的研究类似,胆管癌中SNAT1是判断肿瘤患者复发和预后的独立影响因子[5]。上述结果再次表明SNAT1在食管鳞癌的发生和进展过程中具有重要作用。然而,SNAT1作用于肿瘤进展的机制还有待于深入研究,Wang等[4]研究显示SNAT1与Akt通路存在交叉,但其能否调控Akt进而促进胆管癌的增殖和转移有待于进一步研究。
综上所述,本研究结果初步阐明了SNAT1在食管鳞癌中呈过表达状态,且与食管癌的恶性生物学行为以及不良预后有关,提示SNAT1的过度活化在肿瘤发生和发展过程中发挥了重要作用,本研究结果为SNAT1作为临床潜在的治疗靶点和预后标志物提供了一定的理论依据。
| [1] | DESFORGES M, GREENWOOD S L, GLAZIER J D, WESTWOOD M, SIBLEY C P. The contribution of SNAT1 to system A amino acid transporter activity in human placental trophoblast[J]. Biochem and Biophys Res Commun, 2010, 398: 130–134. DOI: 10.1016/j.bbrc.2010.06.051 |
| [2] | KIDD M, MODLIN I M, GUSTAFSSON B I, DROZDOV I, HAUSO O, PFRAGNER R. Luminal regulation of normal and neoplastic human EC cell serotonin release is mediated by bile salts, amines, tastants, and olfactants[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 295: G260–G272. DOI: 10.1152/ajpgi.00056.2008 |
| [3] | SOLBU T T, BJØRKMO M, BERGHUIS P, HARKANY T, CHAUDHRY F A. SAT1, a glutamine transporter, is preferentially expressed in GABAergic neurons[J]. Front Neuroanat, 2010, 4: 1. |
| [4] | WANG K, CAO F, FANG W, HU Y, CHEN Y, DING H, et al. Activation of SNAT1/SLC38A1 in human breast cancer: correlation with p-Akt overexpression[J]. BMC Cancer, 2013, 13: 343. DOI: 10.1186/1471-2407-13-343 |
| [5] | YU W L, CONG W M, ZHANG Y, CHEN Y, WANG F, YU G. Overexpression of ATA1/SLC38A1 predicts future recurrence and death in Chinese patients with hilar cholangiocarcinoma[J]. J Surg Res, 2011, 171: 663–668. DOI: 10.1016/j.jss.2010.03.049 |
| [6] | XIE J, LI P, GAO H F, QIAN J X, YUAN L Y, WANG J J. Overexpression of SLC38A1 is associated with poorer prognosis in Chinese patients with gastric cancer[J]. BMC Gastroenterol, 2014, 14: 70. DOI: 10.1186/1471-230X-14-70 |
| [7] | KONDOH N, IMAZEKI N, ARAI M, HADA A, HATSUSE K, MATSUO H, et al. Activation of a system A amino acid transporter, ATA1/SLC38A1, in human hepatocellular carcinoma and preneoplastic liver tissues[J]. Int J Oncol, 2007, 31: 81–87. |
| [8] | 于观贞, 陈颖, 潘军, 王喜, 王杰军. 大规模中国人胃癌组织芯片的构建及胃癌预后因素的分析[J]. 临床肿瘤学杂志, 2008, 13: 677–681. |
| [9] | 刘海涛, 张志培, 葛忠虎, 王雪娇, 文苗苗, 汪健, 等. NOK与FGFR2在非小细胞肺癌中的表达及临床意义[J]. 临床肿瘤学杂志, 2013, 18: 1071–1075. |
| [10] | CHEN W, ZHENG R, BAADE P D, ZHANG S, ZENG H, BRAY F, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115–132. DOI: 10.3322/caac.21338 |
| [11] | 田丰, 程庆书, 于莉莉. 我国食管癌发病危险因素的Meta分析[J]. 第四军医大学学报, 2003, 24: 2196–2198. |
| [12] | MAHOUNGA D M, 顾 月清. 与肿瘤有关的氨基酸代谢缺陷及其相关药物的应用[J]. 药物生物技术, 2012, 19: 373–376. |
| [13] | |
| [14] | CAO W, YU G, LU Q, ZHANG J. Low expression of N-myc downstream-regulated gene 2 in oesophageal squamous cell carcinoma correlates with a poor prognosis[J]. BMC Cancer, 2013, 13: 305. DOI: 10.1186/1471-2407-13-305 |
| [15] | FAN H, YUAN Y, WANG J, ZHOU F, ZHANG M, GIERCKSKY K E, et al. CD117 expression in operable oesophageal squamous cell carcinomas predicts worse clinical outcome[J]. Histopathology, 2013, 62: 1028–1037. DOI: 10.1111/his.2013.62.issue-7 |
| [16] | PRINS M J, VERHAGE R J, RUURDA J P, TEN KATE F J, VAN HILLEGERSBERG R. Over-expression of phosphorylated mammalian target of rapamycin is associated with poor survival in oesophageal adenocarcinoma: a tissue microarray study[J]. J Clin Pathol, 2013, 66: 224–228. DOI: 10.1136/jclinpath-2012-201173 |
 2016, Vol. 37
2016, Vol. 37


