2. 南昌大学转化医学研究院, 南昌 330031
2. Institute of Translational Medicine, Nanchang University, Nanchang 330031, Jiangxi, China
B细胞发育是一个有序、多步骤的成熟和选择过程,成熟B细胞的主要功能是通过分泌抗体介导体液免疫,且还具有分泌细胞因子调节免疫应答的作用,B细胞发育障碍可引起体液免疫缺陷[1]、肿瘤[2]和自身免疫性疾病等。CD38在心血管疾病、肿瘤[3]及代谢性疾病[4]中具有广泛的调节作用,但关于其在调节免疫细胞发育中的报道较少,仅Rodríguez-Alba等[5]报道CD38-/-小鼠脾脏中B细胞发育障碍,而B细胞发育障碍常伴体液免疫反应的下降,因此CD38可能与自身免疫性疾病密切相关。由于CD38与去乙酰化酶1(sirtuin 1, SIRT1)共用底物烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+),二者之间存在负相关作用,即CD38基因缺陷会引起SIRT1活性升高,而SIRT1可通过去乙酰化其底物调节基因沉默,如通过抑制NF-κB的转录活性来抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎性因子的表达,在肿瘤、炎症及心血管疾病等方面有广泛调节作用[6],但SIRT1在B细胞发育中的作用尚未见报道。炎性因子的表达可影响B细胞的发育,Ueda等[7]报道,TNF-α可以模拟佐剂诱导的B淋巴细胞发育异常,TNF-α缺陷则对小鼠有保护作用。CD38-/-小鼠脾脏B细胞中炎性因子的表达如何?是否与其B细胞发育障碍相关?SIRT1在其中扮演什么角色?本研究旨在通过分析CD38-/-小鼠脾脏中B细胞的数量及其炎性因子TNF-α和白细胞介素1β(interleukin-1β,IL-1β)及SIRT1的表达水平,探讨CD38基因敲除对B细胞中炎性因子的影响及SIRT1的潜在作用机制, 为进一步研究CD38基因敲除与自身免疫性疾病的关系奠定实验基础。
1 材料和方法 1.1 主要试剂蛋白酶K、2×Taq PCR Mix、DL1000 DNA marker、ACK红细胞裂解液、TRIzol试剂、BCA蛋白定量试剂盒、ECL化学发光试剂盒、PrimeScriptTM反转录试剂盒、SYBR® Premix Ex Taq均购自TaKaRa公司,MagniSortTM小鼠B细胞分选试剂盒、PE/Cy5.5抗小鼠CD45R抗体、FITC抗小鼠CD3e抗体均购自eBioscience公司,SirT1(D1D7)兔源单克隆抗体、CD38鼠源单克隆抗体购自Cell Signaling Technology公司,GAPDH兔源多克隆抗体购自Proteintech公司,胎牛血清、RIPA裂解液购自Invitrogen公司。
1.2 仪器Thermo Lynx4000高速离心机(Thermo公司),BD FACSCantoTMⅡ流式细胞仪、BioRad S-1000 PCR仪(BD公司),ABI 7500实时定量PCR仪(ABI公司),水平电泳仪、垂直电泳仪(Bio-Rad公司),ChampGelTM 5000全自动凝胶成像分析系统、MiniChemiTM迷你型化学发光成像仪(北京赛智创业科技有限公司),超纯水仪(Millipore公司)。
1.3 动物分组10周龄的SPF级健康C57BL/6(WT)小鼠购于武汉大学动物实验中心[动物生产许可证号:SCXK (鄂)2008-0004];CD38-/-小鼠由南昌大学转化医学研究院辛洪波教授惠赠[动物使用许可证号:SYXK (赣)2015-0003];所有小鼠均在南昌大学转化医学研究院SPF动物中心按雌:雄=2:1合笼饲养,取6周雌鼠用于本研究,小鼠分为WT和CD38-/-两组。
1.4 CD38-/-小鼠的鉴定CD38基因敲除是通过同源重组导致一个1.6 kb的CD38基因组区域(第2和第3外显子)被更换,其中包括被公认的NAD水解酶位点,CD38基因的靶向载体带有新霉素(Neo)抗性片段。因此,剪长约1 cm的小鼠尾巴,经RIPA裂解液和蛋白酶K处理后提取DNA;依据CD38基因敲除的原理,通过Generunner软件对目的片段进行引物设计(CD38上游引物:CAA TGT CCC AAT CTC CCA AG,Neo上游引物:GCT GCG AAT CGG GAG CGG CGA TAC,CD38和Neo共用下游引物:AAA GGG GAG AAC AGG AAG GA),并通过PCR方法扩增CD38基因和Neo基因片段,PCR扩增产物经1.5%琼脂糖凝胶电泳后,用ChampGelTM 5000全自动凝胶成像分析系统进行扫描分析。
1.5 脾脏B细胞的磁珠阴选分别取WT和CD38-/-小鼠脾脏,用100 μm的细胞筛网进行研磨,获得单细胞悬液并对细胞进行计数,经ACK红细胞裂解液处理裂解红细胞后,稀释至细胞密度1×108 /mL,依次与MagniSortTM富集抗体混合液和MagniSortTM阴性选择磁珠进行孵育,然后用Magneto分选器除去吸附了阴选磁珠的细胞,即获得B细胞,显微镜下直接进行计数。
1.6 流式细胞术鉴定脾脏B细胞的分选纯度以分选前的脾脏B细胞做空白和单染,将分选前的脾脏B细胞和阴选出的B细胞分别用CD3e FITC和CD45R PE/Cy5.5抗体染色后,经流式细胞仪鉴定其CD3e-CD45R+的B细胞纯度,纯度>95%为达标。
1.7 总RNA的提取及反转录PCR扩增相关基因的cDNA经磁珠阴选并通过流式细胞仪鉴定后的小鼠脾脏B细胞用TRIzol法提取RNA,用Thermo NanoDrop 2000C仪器检测RNA浓度及光密度(D), 计算D260/D280的比值,以1 μg RNA为模板用PrimeScriptTM反转录试剂盒反转录出cDNA并采用反转录PCR技术进行扩增。
1.8 实时定量PCR技术检测相关基因mRNA的表达水平以cDNA为模板,加入不同的引物(CD38上游引物:TGG TGT GGA CTG GAG AGC CTA C,下游引物:GAG TGT AGA TGA GGC AGC GTC;TNF-α上游引物:AGC CGA TGG GTT GTA CCT TG,下游引物:GTG GGT GAG GAG CAC GTA GTC;IL-1β上游引物:TTT TCC TCC TTG CCT CTG AT,下游引物:GAG TGC TGC CTA ATG TCC CC;GAPDH上游引物:GAA GGT GGT GAA GCA GGC ATC,下游引物:GTG GGA GTT GCT GTT GAA GTC G),用SYBR® Premix Ex Taq扩增WT和CD38-/-小鼠脾脏B细胞中的CD38基因及炎性因子TNF-α和IL-1β,通过实时定量PCR仪进行定量扩增,比较其表达水平的差异。
1.9 脾脏B细胞蛋白的提取及相关蛋白的蛋白质印迹法鉴定经磁珠阴选并通过流式细胞仪鉴定后的小鼠脾脏B细胞用RIPA裂解法提取蛋白,用BCA蛋白定量试剂盒进行定量后,以30 μg的样本量进行垂直电泳,转膜后分别与一抗SIRT1 (D1D7)兔源单克隆抗体、CD38鼠源单克隆抗体和GAPDH兔源多克隆抗体进行杂交孵育过夜,第2天与相应的二抗进行杂交孵育,经ECL化学发光试剂显色后,用MiniChemiTM迷你型化学发光成像仪进行扫描分析。
1.10 统计学处理应用SPSS 16.0软件进行统计学分析,WT和CD38-/-小鼠脾脏中的B细胞数量、炎性因子及其相关基因的比较采用t检验。检验水准(α)为0.05。
2 结果 2.1 小鼠基因型的鉴定小鼠尾巴DNA的PCR扩增结果显示:CD38-/-小鼠为纯合子敲除鼠,与WT小鼠相比,其Neo基因阳性,而CD38基因为阴性。见图 1。

|
图 1 WT和CD38-/-小鼠的基因型鉴定 Fig 1 Identification of genotype of WT and CD38-/- mice |
2.2 小鼠脾脏B细胞分选纯度的鉴定
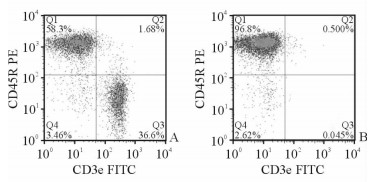
小鼠脾脏B细胞经磁珠阴选后,经CD3e FITC和CD45R PE/Cy5.5抗体染色后,获得CD3e-CD45R+的B细胞纯度为96.8%,达到分选纯度要求(>95%)。见图 2。
|
图 2 WT小鼠脾脏B细胞的分选纯度 Fig 2 Sorting purity of WT murine spleen B-cells |
2.3 小鼠脾脏发育及细胞计数
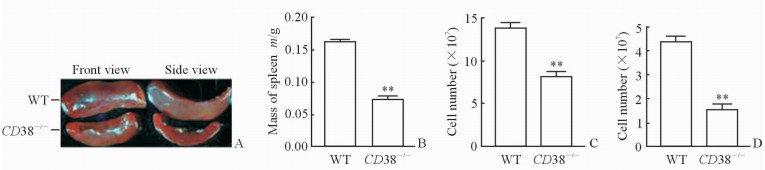
与WT小鼠相比,CD38-/-小鼠脾脏的体积和质量降低(P < 0.01,图 3A、3B),脾细胞总数(P < 0.01,图 3C)及其B细胞数量(P < 0.01,图 3D)均减少。
|
图 3 WT和CD38-/-小鼠脾脏发育及细胞数量的比较 Fig 3 Comparison of development of murine spleen and cell number between WT and CD38-/- mice |
2.4 小鼠脾脏B细胞中炎性因子的表达
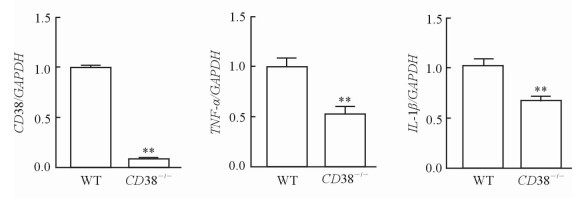
与WT小鼠相比,CD38-/-小鼠脾脏B细胞中CD38 mRNA的表达水平下降(P < 0.01),伴炎性因子TNF-α mRNA和IL-1β mRNA的表达水平也下降(P < 0.01)。见图 4。
|
图 4 WT和CD38-/-小鼠脾脏B细胞中CD38及炎性因子(TNF-α和IL-1β) mRNA的表达 Fig 4 mRNA levels of CD38 and TNF-α and IL-1β in murine spleen B-cells of WT and CD38-/- mice |
2.5 小鼠脾脏B细胞中SIRT1蛋白的表达
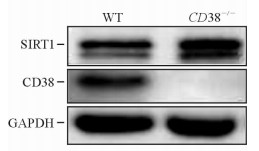
与WT小鼠相比,CD38-/-小鼠脾脏B细胞中CD38蛋白不表达,但SIRT1蛋白表达水平上升(1.60±0.09 vs 1.00±0.04, P < 0.05)。见图 5。
|
图 5 WT和CD38-/-小鼠脾脏B细胞中CD38及SIRT1蛋白的表达 Fig 5 Protein expression of CD38 and SIRT1 in murine spleen B-cells of WT and CD38-/- mice |
3 讨论
B细胞是免疫系统中的重要细胞,在外源和内源信号的严密调控下,B细胞最终分化为可合成和分泌免疫球蛋白的浆细胞,执行机体的体液免疫[8];成熟B细胞的主要功能是通过分泌抗体介导体液免疫,还具有分泌细胞因子调节免疫应答的作用。CD38是一个具有环化酶和水解酶作用,相对分子质量为42 000的双功能跨膜糖蛋白,可催化NAD+合成环腺苷二磷酸核糖(cyclic ADP-ribose, cADPR),也能水解NAD+或cADPR成ADPR (ADP-ribose);CD38分布于几乎所有的哺乳类细胞的包膜上,在多种疾病中起广泛调节作用,在慢性粒细胞白血病患者外周血单核细胞中CD38升高是预后不良的重要指标[9]。CD38在免疫系统中的作用少见报道,现有研究表明CD38-/-小鼠表现出巨噬细胞、中性粒细胞功能障碍,树突状细胞(dendritic cell, DC)的抗原提呈能力下降,脾脏中B细胞发育障碍[5],且常与不良预后相伴。本研究发现CD38-/-小鼠脾脏体积和质量显著降低,脾细胞总数及其中的B细胞数量均减少(P < 0.01),表明CD38基因敲除会影响小鼠脾脏的发育并导致B淋巴细胞减少。Rodríguez-Alba等[5]也报道CD38可通过激活PI3K途径促进B细胞的发育成熟。
炎性因子在淋巴细胞发育异常中发挥某种中介作用,但不同情况下涉及的具体因子各不相同。Ueda等[7]研究证实,IL-6直接影响多能祖细胞分化方向的选择,使其偏向于髓系。Pieper等[8]也报道,阻断TNF-α家族的BAFF基因或其受体可抑制T细胞的成熟。本研究发现CD38-/-小鼠脾脏B细胞中炎性因子TNF-α mRNA和IL-1β mRNA表达水平下降(P < 0.01),表明CD38基因敲除可抑制与脾脏B细胞发育相关的主要炎性因子TNF-α和IL-1β的表达。
SIRT1是一种以NAD+为底物的去乙酰化酶,通过使其底物,如组蛋白、p53、NF-κB[6]及FoxOs[10]等去乙酰化,调节多种细胞功能,包括基因沉默、细胞代谢、分化和存活、细胞应激反应等。在不同的状态下,SIRT1所扮演的角色不一样,如SIRT1可使p53去乙酰化, 抑制DNA与p53的结合,从而保护细胞逃避p53介导的凋亡;也可通过抑制NF-κB的转录活性来抑制TNF-α介导的凋亡[6]。由于CD38和SIRT1都存在于细胞核,因此CD38可通过调节NAD+水平影响SIRT1的活性[11]。目前对SIRT1的研究主要集中在肿瘤[12]、炎症[13]、肥胖[14]、老年化[15]、长寿及心血管疾病[6]等方面,而其在B细胞发育中的作用尚未见报道。本研究发现CD38-/-小鼠脾脏B细胞中SIRT1蛋白表达水平上升(P < 0.05),这与CD38和SIRT1共用NAD+底物相关。
综上所述,CD38及SIRT1在B细胞的发育中均有重要作用,CD38基因的缺失会引起B细胞的发育障碍,同时伴SIRT1表达升高及与B细胞发育相关的主要炎性因子TNF-α和IL-1β的表达下降。但CD38基因的缺失是否可通过激活SIRT1通路,使NF-κB去乙酰化,以抑制脾脏B细胞中炎性因子TNF-α和IL-1β的表达尚不清楚。因此,进一步探讨CD38基因缺失在引起B淋巴细胞减少及抑制自身免疫性疾病中的潜在作用及其作用通路,有助于拓宽我们对CD38及SIRT1功能的认识,为探讨自身免疫性疾病防治的新靶点奠定理论基础。
| [1] | DE WINDE C M, VEENBERGEN S, YOUNG K H, XU-MONETTE Z Y, WANG X X, XIA Y, et al. Tetraspanin CD38 protects against the development of B cell lymphoma[J]. J Clin Invest, 2016, 126: 653–666. DOI: 10.1172/JCI81041 |
| [2] | HUANG Y, LI R, CHEN X, ZHUO Y, JIN R, QIAN X P, et al. Doxycycline up-regulates the expression of IL-6 and GM-CSF via MAPK/ERK and NF-κB pathways in mouse thymic epithelial cells[J]. Int Immunopharmacol, 2011, 11: 1143–1149. DOI: 10.1016/j.intimp.2011.03.011 |
| [3] | CHINI C C, GUERRICO A M, NIN V, CAMACHO-PEREIRA J, ESCANDE C, BARBOSA M T, et al. Targeting of NAD metabolism in pancreatic cancer cells:potential novel therapy for pancreatic tumors[J]. Clin Cancer Res, 2014, 20: 120–130. DOI: 10.1158/1078-0432.CCR-13-0150 |
| [4] | ESCANDE C, NIN V, PRICE N L, CAPELLINI V, GOMES A P, BARBOSA M T, et al. Flavonoid apigenin is an inhibitor of the NAD+ase CD38:implications for cellular NAD+ metabolism, protein acetylation, and treatment of metabolic syndrome[J]. Diabetes, 2013, 62: 1084–1093. DOI: 10.2337/db12-1139 |
| [5] | RODRÍGUEZ-ALBA J C, MORENO-GARCÍA M E, SANDOVAL-MONTES C, ROSALES-GARCIA V H, SANTOS-ARGUMEDO L. CD38 induces differentiation of immature transitional 2 B lymphocytes in the spleen[J]. Blood, 2008, 111: 3644–3652. DOI: 10.1182/blood-2007-08-107714 |
| [6] | KONG S, YEUNG P, FANG D. The class Ⅲ histone deacetylase Sirtuin 1 in immune suppression and its therapeutic potential in rheumatoid arthritis[J]. J Genet Genomics, 2013, 40: 347–354. DOI: 10.1016/j.jgg.2013.04.001 |
| [7] | UEDA Y, YANG K, FOSTER S J, KONDO M, KELSOE G. Inflammation controls B lymphopoiesis by regulating chemokine CXCL12 expression[J]. J Exp Med, 2004, 199: 47–58. DOI: 10.1084/jem.20031104 |
| [8] | PIEPER K, GRIMBACHER B, EIBEL H. B-cell biology and development[J]. J Allergy Clin Immunol, 2013, 131: 959–971. DOI: 10.1016/j.jaci.2013.01.046 |
| [9] | AYDIN S, ROSSI D, BERGUI L, D'ARENA G, FERRERO E, BONELLO L, et al. CD38 gene polymorphism and chronic lymphocytic leukemia:a role in transformation to Richter syndrome?[J]. Blood, 2008, 111: 5646–5653. DOI: 10.1182/blood-2008-01-129726 |
| [10] | BUHRMANN C, BUSCH F, SHAYAN P, SHAKIBAEI M. Sirtuin-1(SIRT1) is required for promoting chondrogenic differentiation of mesenchymal stem cells[J]. J Biol Chem, 2014, 289: 22048–22062. DOI: 10.1074/jbc.M114.568790 |
| [11] | XIONG S, SALAZAR G, PATRUSHEV N, ALEXANDER R W. FoxO1 mediates an autofeedback loop regulating SIRT1 expression[J]. J Biol Chem, 2011, 286: 5289–5299. DOI: 10.1074/jbc.M110.163667 |
| [12] | WANG J C, KAFEEL M I, AVEZBAKIYEV B, CHEN C, SUN Y, RATHNASABAPATHY C, et al. Histone deacetylase in chronic lymphocytic leukemia[J]. Oncology, 2011, 81: 325–329. DOI: 10.1159/000334577 |
| [13] | YANG X, WANG Y, GAO G. High glucose induces rat mesangial cells proliferation and MCP-1 expression via ROS-mediated activation of NF-κB pathway, which is inhibited by eleutheroside E[J]. J Recept Signal Transduct Res, 2016, 36: 152–157. DOI: 10.3109/10799893.2015.1061002 |
| [14] | YI P, PANG J, ALEXANDER J S, RIVERA C. The endotoxin/toll-like receptor-4 axis mediates gut microvascular dysfunction associated with post-prandial lipidemia[J]. BMC physiol, 2013, 13: 12. DOI: 10.1186/1472-6793-13-12 |
| [15] | IMAI S, GUARENTE L. NAD+ and sirtuins in aging and disease[J]. Trends Cell Biol, 2014, 24: 464–471. DOI: 10.1016/j.tcb.2014.04.002 |
 2016, Vol. 37
2016, Vol. 37


