多发性骨髓瘤(multiple myeloma, MM)是一种恶性浆细胞增殖性疾病,其发病率居血液系统恶性肿瘤的第2位[1]。虽然近年来对其治疗取得了一定进展,如蛋白酶体抑制剂硼替佐米(bortezomib)的应用极大提高了治疗的总反应率,延长了患者的生存期[2],但MM仍不可治愈,复发率高。除初治不敏感的患者外,有近一半的初治敏感患者复发后对硼替佐米治疗的反应性降低[3],因此寻找新的治疗药物、探索联合用药方案是进一步提高MM疗效和预后的关键。布鲁顿酪氨酸激酶(Bruton’s tyrosine kinase, BTK)是一种胞质酪氨酸蛋白激酶,主要表达于各分化阶段的B细胞,在除T细胞、NK细胞和正常浆细胞之外的其他造血细胞中也有表达,对正常B细胞的分化、发育及功能有重要影响[4-5]。近年的研究表明,BTK在多种造血系统恶性肿瘤,如慢性淋巴细胞白血病、弥漫大B细胞淋巴瘤、套细胞淋巴瘤、急性髓细胞白血病及MM中的表达均升高[6]。针对BTK的选择性抑制剂依鲁替尼(ibrutinib)可通过与BTK活性位点的半胱氨酸残基(Cys-481)共价结合而抑制其磷酸化,从而不可逆地抑制其激酶活性,其对BTK的半数抑制浓度(median inhibitory concentration, IC50)为0.5 nmol/L[7],目前已在慢性淋巴细胞白血病、套细胞淋巴瘤、弥漫大B细胞淋巴瘤及急性髓细胞白血病中显示出有效的体内外抗肿瘤活性[8-11],对MM的作用也有报道[12-13]。AVL-292(CC-292)是另一种新型的BTK选择性抑制剂,其作用机制与依鲁替尼相似,对BTK的IC50<0.5 nmol/L,目前有关AVL-292的研究正处于针对某些复发难治性B细胞性非霍奇金淋巴瘤及慢性淋巴细胞白血病的临床Ⅰ期试验[14]中,但该药对MM的作用研究报道尚少。本研究通过观察比较两种BTK抑制剂依鲁替尼和AVL-292对人MM细胞系H929、RPMI8226细胞增殖和凋亡的影响,以及与硼替佐米的联合效应,探讨其可能的效应机制,以期为BTK抑制剂的临床应用提供一定的实验依据。
1 材料和方法 1.1 药物及主要试剂依鲁替尼、AVL-292(Selleck公司;目录号:S2680,S7173),硼替佐米(西安杨森制药有限公司,批号FCZTA00)。RPMI 1640培养基(HyClone公司),胎牛血清(Gibco公司),CCK-8细胞增殖及毒性检测试剂盒、AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒[东仁化学科技(上海)有限公司],p65(NF-κB p65)、p-p65(p-NF-κB p65)、p-BTK (Tyr223)、p-ERK1/2 (Thr202/Tyr204)和cleaved caspase-3单抗(Cell Signaling公司),ERK1/2单抗(巴傲得生物科技有限公司),Akt、p-Akt (Ser473)单抗(Affinity公司),Bcl-xL单抗(Santa Cruz公司),BTK多抗(Proteintech公司),β-actin单抗、辣根过氧化物酶(HRP)标记的山羊抗兔和山羊抗小鼠二抗、BCA蛋白定量检测试剂盒、SDS-PAGE凝胶制备试剂盒(武汉谷歌生物科技有限公司)。
1.2 细胞株和细胞培养人MM细胞系H929和RPMI8226购自广州吉妮欧生物科技有限公司。细胞培养于含10%胎牛血清的RPMI 1640培养液中,于37℃、5%CO2、饱和湿度孵箱中培养,2~3 d换液一次,取对数生长期细胞进行实验。
1.3 CCK-8法检测细胞增殖活性取对数生长期细胞,调整细胞密度为5×104/mL,接种于96孔板,每孔200 μL。向各孔加入不同浓度的依鲁替尼(终浓度分别为0.001、0.01、0.1、1、5、10、50、100 μmol/L)或AVL-292(终浓度分别为0.001、0.01、0.1、1、5、10、50、100 μmol/L)。以加药孔为实验孔,不加药孔为对照孔,另设空白孔,每组4个复孔。培养24 h或48 h后,每孔加入CCK-8试剂10 μL,继续培养2 h后检测450 nm处光密度(D)值。实验重复3次。细胞生存率(%)=(D实验孔-D空白孔)/(D对照孔-D空白孔)×100%,增殖抑制率(%)=100%-细胞生存率。用GraphPad Prism 5软件计算药物的IC50。药物联合实验时,将依鲁替尼(5、10 μmol/L)或AVL-292(5、10 μmol/L)分别与不同浓度的硼替佐米(5、10、20、50 nmol/L)联合处理H929和RPMI8226细胞,48 h后采用上述方法评价各组细胞的增殖活性。应用公式R=Sexp/Sobs评价两种药物的协同作用,其中R为协同系数,Sexp为两种单药作用后细胞生存率之乘积,Sobs为实际检测的联合用药的细胞生存率。当R>1.0时,两种药物具有协同作用[15]。
1.4 流式细胞术检测细胞凋亡率取对数生长期细胞,调整细胞密度为1×105/mL,接种于6孔板。实验设6组:对照组(无药物)、20 nmol/L硼替佐米组、10 μmol/L依鲁替尼组、10 μmol/L AVL-292组、20 nmol/L硼替佐米+10 μmol/L依鲁替尼组和20 nmol/L硼替佐米+10 μmol/L AVL-292组。向各孔加入上述不同浓度药物。培养48 h后收集细胞,离心去上清,磷酸盐缓冲液(PBS)洗2次,将细胞重悬于500 μL结合缓冲液中,取100 μL,加入5 μL Annexin Ⅴ-FITC及5 μL PI,混匀;室温避光反应15 min后,再加入400 μL结合缓冲液。1 h内用流式细胞仪检测细胞凋亡率,总细胞凋亡率(%)=Annexin Ⅴ-FITC单阳性细胞(早期凋亡)百分率+Annexin Ⅴ-FITC和PI双阳性细胞(晚期凋亡)百分率。实验重复3次。
1.5 蛋白质印迹法检测H929细胞内BTK信号通路蛋白及凋亡相关蛋白表达取对数生长期H929细胞,调整细胞密度为1×105/mL,接种于6孔板,实验分组同上。培养24 h后,收集各组细胞,提取总蛋白,BCA法测定蛋白含量,每孔取30 μg蛋白上样,10% SDS-PAGE分离,转膜,5%脱脂牛奶封闭1 h后,分别加入适当稀释的一抗过夜,洗膜后加入HRP标记的二抗,室温孵育2 h,洗膜后ECL显影曝光,扫描胶片。
1.6 统计学处理应用SPSS 22.0软件进行统计学分析,数据以x±s表示,两样本均数比较采用t检验,两个以上样本均数的比较采用单因素方差分析并用LSD法进行两两比较。检验水准(α)为0.05。
2 结果 2.1 依鲁替尼和AVL-292对人MM细胞系增殖活性的影响CCK-8法检测结果显示,依鲁替尼和AVL-292均可抑制H929、RPMI8226细胞增殖,其抑制作用呈浓度依赖性。对于H929细胞,当依鲁替尼浓度为10、50、100 μmol/L,AVL-292浓度为5、10、50、100 μmol/L时,24 h细胞活性与48 h细胞活性差异有统计学意义(P<0.05,P<0.01),呈现出时间依赖性。依鲁替尼对H929、RPMI8226细胞的48 h IC50分别为(10.41±3.29) μmol/L和(51.65±13.58) μmol/L,AVL-292对H929、RPMI8226细胞的48 h IC50分别为(7.77±2.99) μmol/L和(6.44±1.06) μmol/L,两药对RPMI8226细胞的IC50差异有统计学意义(P < 0.01)。见图 1。
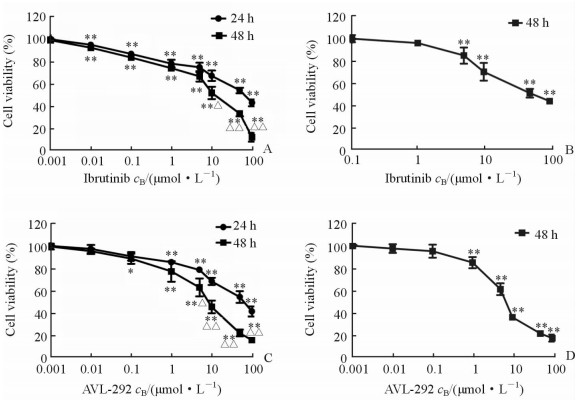
|
图 1 依鲁替尼和AVL-292对H929、RPMI8226细胞增殖的抑制作用 Fig 1 Inhibitory effect of ibrutinib and AVL-292 against proliferation of H929 and RPMI8226 cells |
2.2 依鲁替尼和AVL-292与硼替佐米联合对人MM细胞系增殖活性的影响
将不同浓度的依鲁替尼(5、10 μmol/L)和AVL-292(5、10 μmol/L)分别与不同浓度的硼替佐米(5、10、20、50 nmol/L)联合处理H929、RPMI8226细胞48 h。CCK-8法检测结果显示,随着硼替佐米作用浓度的增加,H929和RPMI8226细胞的生存率逐渐降低。联合依鲁替尼或AVL-292后,生存率下降更为明显;各联合用药组对两种MM细胞的增殖抑制作用均高于相应浓度的单药组(P<0.05,P<0.01);并且两种细胞各联合用药组的协同系数R均>1.0,表明依鲁替尼与硼替佐米、AVL-292与硼替佐米对H929、RPMI8226细胞增殖的抑制具有协同作用(图 2)。

|
图 2 依鲁替尼、AVL-292和硼替佐米对H929、RPMI8226细胞的增殖抑制作用 Fig 2 H929 and RPMI8226 cells were treated with ibrutinib and AVL-292 alone or in combination with bortezomib |
2.3 依鲁替尼和AVL-292与硼替佐米对人MM细胞系凋亡的影响
流式细胞分析结果显示,经20 nmol/L硼替佐米、10 μmol/L依鲁替尼、10 μmol/L AVL-292、20 nmol/L硼替佐米+10 μmol/L依鲁替尼和20 nmol/L硼替佐米+10 μmol/L AVL-292作用48 h后,H929细胞的凋亡率均较对照组升高(P<0.05,P<0.01);且20 nmol/L硼替佐米+10 μmol/L依鲁替尼组和20 nmol/L硼替佐米+10 μmol/L AVL-292组的细胞凋亡率均高于相应单药组,差异有统计学意义(P<0.01),说明联合用药对凋亡诱导具有协同作用。而同样的处理后,10 μ mol/L依鲁替尼组和10 μmol/L AVL-292组RPMI8226细胞的凋亡率与其对照组相比差异有统计学意义(P<0.05);20 nmol/L硼替佐米组RPMI8226细胞的凋亡与对照组相比差异无统计学意义(P>0.05);联合用药组RPMI8226细胞的凋亡率亦高于相应单药组,差异有统计学意义(P<0.01),说明联合用药对RPMI8226细胞凋亡诱导亦具有协同作用。见图 3。
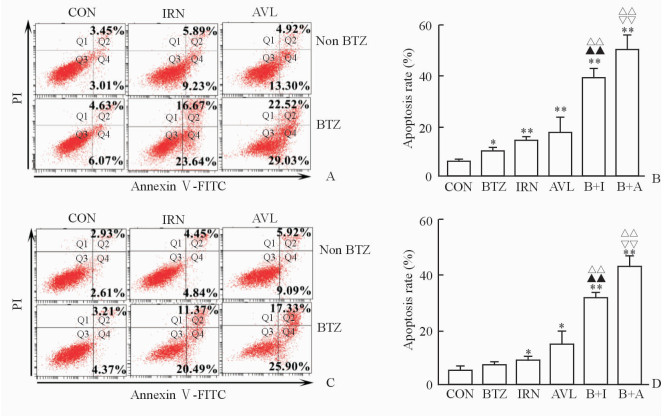
|
图 3 依鲁替尼、AVL-292和硼替佐米对H929、RPMI8226细胞凋亡的诱导作用 Fig 3 Apoptosis of H929 and RPMI8226 cells induced by ibrutinib and AVL-292 alone or in combination with bortezomib |
2.4 依鲁替尼和AVL-292与硼替佐米对人MM细胞内BTK信号通路蛋白磷酸化及凋亡相关蛋白表达的影响
蛋白质印迹分析法检测药物作用前后H929细胞内BTK信号通路蛋白BTK、NF-κB p65、Akt、ERK和磷酸化蛋白p-BTK、p-p65、p-Akt、p-ERK以及凋亡相关蛋白Bcl-xL、cleaved caspase-3表达水平,结果显示10 μmol/L依鲁替尼和10 μmol/L AVL-292作用24 h后,H929细胞内p-BTK、p-p65、p-Akt、p-ERK和Bcl-xL蛋白水平均较对照组降低(P<0.05),cleaved caspase-3蛋白水平均较对照组升高(P<0.01);两药分别联合20 nmol/L硼替佐米后,p-BTK、p-p65、p-Akt、p-ERK和Bcl-xL蛋白降低及cleaved caspase-3蛋白增加的程度均较依鲁替尼、AVL-292单独用药组进一步增强(P<0.05,P<0.01)。见图 4。
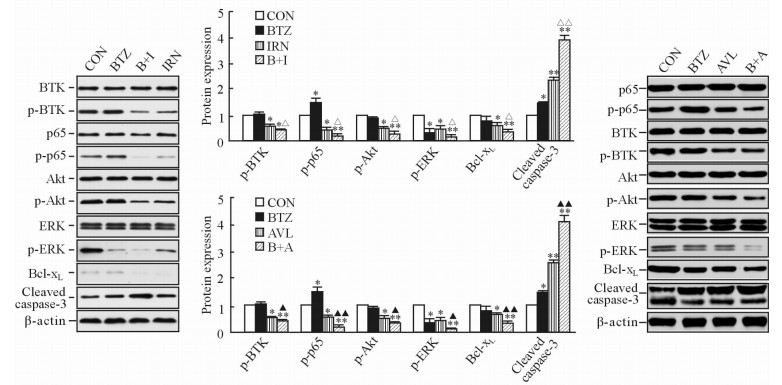
|
图 4 依鲁替尼、AVL-292和硼替佐米对H929细胞内BTK信号通路蛋白及凋亡相关蛋白的调节作用 Fig 4 Effects of ibrutinib, AVL-292 and bortezomib on expression of multiple BTK-associated signaling pathway proteins and apoptosis-associated proteins in H929 cells |
3 讨论
NF-κB是一种重要的信号转录因子,其家族由p65(RelA)、RelB、c-Rel、p50 (NF-κB 1)和p52 (NF-κB 2)5个成员组成。在未激活的细胞中,大部分NF-κB与胞质中的抑制因子IκB结合而以无活性状态存在,当细胞受到外界信号刺激后,IκB激酶复合体(IκB kinase, IKK)活化将IκB磷酸化,磷酸化的IκB经泛素-26S蛋白酶体系统降解,使得NF-κB与之分离,并进入细胞核内参与众多介导细胞增殖、抗凋亡及细胞因子分泌的基因的表达[16]。在MM中,NF-κB蛋白表达及活性水平升高,对疾病发生、发展产生重要影响[17]。蛋白酶体抑制剂硼替佐米能够抑制泛素-26S蛋白酶体对IκB的降解,逆转NF-κB活化而发挥抗肿瘤效应[18]。然而,Hideshima等[19]发现硼替佐米也可诱导MM细胞中IKK活化及IκB磷酸化降解,从而激活NF-κB信号,降低硼替佐米的疗效甚至导致耐药。
近年的研究表明,BTK在多种造血系统恶性肿瘤中的表达及活性升高[6],其选择性抑制剂依鲁替尼在抑制BTK磷酸化激活的同时,也可降低PI3K/Akt、MAPK/ERK和NF-κB信号通路活性而发挥良好的抗肿瘤效应[8-11]。Rushworth等[12]证明,MM细胞系及原代MM细胞中有BTK表达,依鲁替尼抑制RPMI8226、U266和原代MM细胞中NF-κB p65的磷酸化,而p65是NF-κB经典通路中最重要的效应元件,从而抑制NF-κB通路活性来发挥抗肿瘤效应。Tai等[13]发现,依鲁替尼能够抑制MM细胞系ANBL6、INA6和原代CD138+ MM细胞中NF-κB及ERK磷酸化激活,抑制肿瘤细胞增殖。Yu等[20]发现,在多种B淋巴细胞系和原代B细胞中,BTK可以诱导NF-κB的活化,而活化后的NF-κB又可以促进BTK的转录,这种正反馈显著地放大了BTK及NF-κB的信号强度。尤其在硼替佐米耐药的MM细胞中,NF-κB和BTK的磷酸化水平显著升高,并且硼替佐米失去了对NF-κB活化的抑制作用[21]。
本研究中,我们评估了BTK抑制剂依鲁替尼和AVL-292单药及与蛋白酶体抑制剂硼替佐米联合应用对MM细胞系H929和RPMI8226细胞增殖、凋亡的影响,并观察了对BTK、NF-κB等信号通路蛋白和凋亡相关蛋白的表达及磷酸化的调节作用。在前期实验中我们发现,RPMI8226细胞对生长环境变化较敏感,传代、铺板等操作会对细胞活性产生一定影响。即便在不加药对照组,铺板后24 h以内的细胞活性分析亦显示较大的组内差异;而于铺板后48 h检测细胞活性时,复孔间的组内差异减小至正常范围,药物作用趋势清晰,考虑细胞已适应孔板中的生长环境,细胞本身状态一致,组间结果差异主要是由药物浓度差异引起的。因此,在评估依鲁替尼和AVL-292对细胞增殖的影响时,对于H929细胞,我们选取了24 h和48 h的结果进行分析;对于RPMI8226细胞,我们仅以48 h的结果进行分析。结果显示,依鲁替尼对H929和RPMI8226细胞具显著增殖抑制作用,与硼替佐米联合应用有明显的协同增殖抑制作用。Kokabee等[22]发现前列腺癌细胞中有BTK表达,AVL-292(1、10、20、30 μmol/L)能够抑制表达BTK的前列腺癌细胞系LNCaP和DU145细胞增殖。本研究证实AVL-292亦可有效地抑制H929、RPMI8226细胞增殖,与硼替佐米也有明显的协同增殖抑制作用。依鲁替尼和AVL-292对H929细胞48 h的IC50分别为(10.41±3.29)μmol/L和(7.77±2.99)μmol/L,对RPMI8226细胞48 h的IC50分别为(51.65±13.58)μmol/L和(6.44±1.06) μmol/L,AVL-292对两株细胞的48 h IC50值均较依鲁替尼更低;在RPMI8226细胞,两药IC50值差异具有统计学意义(P<0.01)。流式细胞术分析发现,依鲁替尼和AVL-292均可诱导H929、RPMI8226细胞凋亡,相同浓度(10 μmol/L)的AVL-292对H929和RPMI8226细胞的凋亡诱导率均高于依鲁替尼,而且两药与硼替佐米都有明显的协同凋亡诱导作用,AVL-292联合硼替佐米较依鲁替尼联合硼替佐米能够更显著地诱导细胞凋亡。进一步研究发现,H929细胞有BTK蛋白及活化的BTK蛋白的表达,依鲁替尼和AVL-292作用后p-BTK、p-p65、p-Akt、p-ERK蛋白水平均下调,表明这两种BTK抑制剂可通过抑制BTK活性来抑制下游NF-κB、Akt、ERK信号通路的活性;另外检测结果显示两药分别与硼替佐米联合后,对此3条信号途径的抑制作用进一步增强。此外,依鲁替尼和AVL-292均能下调H929细胞中抗凋亡蛋白Bcl-xL表达,诱导caspase-3剪切,从而激活caspase-3依赖的凋亡;联合硼替佐米后,对Bcl-xL、cleaved caspase-3的调节作用也明显增强。
综上所述,本研究表明,依鲁替尼和AVL-292一方面通过抑制BTK激酶活性,阻断BTK下游NF-κB、Akt和ERK促生存信号通路,抑制人MM细胞增殖;另一方面,通过下调抗凋亡蛋白Bcl-xL表达、促进caspase-3酶解活化,诱导人MM细胞凋亡;与硼替佐米联合应用,对这些信号通路蛋白及凋亡相关蛋白的调节作用增强,从而发挥协同抗MM效应。因此,依鲁替尼和AVL-292作为新型的BTK抑制剂,与硼替佐米联合应用有协同作用,在治疗MM中显示出良好的应用前景,为进一步提高MM患者临床疗效、延缓耐药、改善预后提供新的治疗方案选择。
| [1] | SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65: 5–29. DOI: 10.3322/caac.21254 |
| [2] | PALUMBO A, ATTAL M, ROUSSEL M. Shifts in the therapeutic paradigm for patients newly diagnosed with multiple myeloma:maintenance therapy and overall survival[J]. Clin Cancer Res, 2011, 17: 1253–1263. DOI: 10.1158/1078-0432.CCR-10-1925 |
| [3] | LONIAL S, MITSIADES C S, RICHARDSON P G. Treatment options for relapsed and refractory multiple myeloma[J]. Clin Cancer Res, 2011, 17: 1264–1277. DOI: 10.1158/1078-0432.CCR-10-1805 |
| [4] | SATTERTHWAITE A B, WITTE O N. The role of Bruton's tyrosine kinase in B-cell development and function:a genetic perspective[J]. Immunol Rev, 2000, 175: 120–127. DOI: 10.1111/imr.2000.175.issue-1 |
| [5] | SMITH C I, BASKIN B, HUMIRE-GREIFF P, ZHOU J, OLSSON P G, MANIAR H S, et al. Expression of Bruton's agammaglobulinemia tyrosine kinase gene, BTK, is selectively down-regulated in T lymphocytes and plasma cells[J]. J Immunol, 1994, 152: 557–565. |
| [6] | HENDRIKS R W, YUVARAJ S, KIL L P. Targeting Bruton's tyrosine kinase in B cell malignancies[J]. Nat Rev Cancer, 2014, 14: 219–232. DOI: 10.1038/nrc3702 |
| [7] | PAN Z, SCHEERENS H, LI S, SCHULTZ B E, SPRENGELER P A, BURRILL L C, et al. Discovery of selective irreversible inhibitors for Bruton's tyrosine kinase[J]. ChemMedChem, 2007, 2: 58–61. DOI: 10.1002/(ISSN)1860-7187 |
| [8] | HERMAN S E, GORDON A L, HERTLEIN E, RAMANUNNI A, ZHANG X L, JAGLOWSKI S, et al. Bruton tyrosine kinase represents a promising therapeutic target for treatment of chronic lymphocytic leukemia and is effectively targeted by PCI-32765[J]. Blood, 2011, 117: 6287–6296. DOI: 10.1182/blood-2011-01-328484 |
| [9] | DASMAHAPATRA G, PATEL H, DENT P, FISHER R I, FRIEDBERG J, GRANT S. The Bruton tyrosine kinase (BTK) inhibitor PCI-32765 synergistically increases proteasome inhibitor activity in diffuse large-B cell lymphoma (DLBCL) and mantle cell lymphoma (MCL) cells sensitive or resistant to bortezomib[J]. Br J Haematol, 2013, 161: 43–56. DOI: 10.1111/bjh.2013.161.issue-1 |
| [10] | RUSHWORTH S A, MURRAY M Y, ZAITSEVA L, BOWLES K M, MACEWAN D J. Identification of Bruton's tyrosine kinase as a therapeutic target in acute myeloid leukemia[J]. Blood, 2014, 123: 1229–1238. DOI: 10.1182/blood-2013-06-511154 |
| [11] | ADVANI R H, BUGGY J J, SHARMAN J P, SMITH S M, BOYD T E, GRANT B, et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies[J]. J Clin Oncol, 2013, 31: 88–94. DOI: 10.1200/JCO.2012.42.7906 |
| [12] | RUSHWORTH S A, BOWLES K M, BARRERA L N, MURRAY M Y, ZAITSEVA L, MACEWAN D J. BTK inhibitor ibrutinib is cytotoxic to myeloma and potently enhances bortezomib and lenalidomide activities through NF-κB[J]. Cell Signal, 2013, 25: 106–112. DOI: 10.1016/j.cellsig.2012.09.008 |
| [13] | TAI Y Z, CHANG B Y, KONG S Y, FULCINITI M, YANG G, CALLE Y, et al. Bruton tyrosine kinase inhibition is a novel therapeutic strategy targeting tumor in the bone marrow microenvironment in multiple myeloma[J]. Blood, 2012, 120: 1877–1887. DOI: 10.1182/blood-2011-12-396853 |
| [14] | BURGER J A. Bruton's tyrosine kinase (BTK) inhibitors in clinical trials[J]. Curr Hematol Malig Rep, 2014, 9: 44–49. DOI: 10.1007/s11899-013-0188-8 |
| [15] | ROMANELLI S, PEREGO P, PRATESI G, CARENINI N, TORTORETO M, ZUNINO F. In vitro and in vivo interaction between cisplatin and topotecan in ovarian carcinoma systems[J]. Cancer Chemother Pharmacol, 1998, 41: 385–390. DOI: 10.1007/s002800050755 |
| [16] | PERKINS N D. The diverse and complex roles of NF-κB subunits in cancer[J]. Nat Rev Cancer, 2012, 12: 121–132. |
| [17] | ANNUNZIATA C M, DAVIS R E, DEMCHENKO Y, BELLAMY W, GABREA A, ZHAN F H, et al. Frequent engagement of the classical and alternative NF-κB pathways by diverse genetic abnormalities in multiple myeloma[J]. Cancer Cell, 2007, 12: 115–130. DOI: 10.1016/j.ccr.2007.07.004 |
| [18] | MARKOVINA S, CALLANDER N S, O'CONNOR S L, XU G, SHI Y F, LEITH C P, et al. Bone marrow stromal cells from multiple myeloma patients uniquely induce bortezomib resistant NF-κB activity in myeloma cells[J]. Mol Cancer, 2010, 9: 176. DOI: 10.1186/1476-4598-9-176 |
| [19] | HIDESHIMA T, IKEDA H, CHAUHAN D, OKAWA Y, RAJE N, PODAR K, et al. Bortezomib induces canonical nuclear factor-κB activation in multiple myeloma cells[J]. Blood, 2009, 114: 1046–1052. DOI: 10.1182/blood-2009-01-199604 |
| [20] | YU L, MOHAMED A J, SIMONSON O E, VARGAS L, BLOMBERG K E, BJ RKSTRAND B, et al. Proteasome-dependent autoregulation of Bruton tyrosine kinase (Btk) promoter via NF-κB[J]. Blood, 2008, 111: 4617–4626. DOI: 10.1182/blood-2007-10-121137 |
| [21] | MARKOVINA S, CALLANDER N S, O'CONNOR S L, KIM J, WERNDLI J E, RASCHKO M, et al. Bortezomib-resistant nuclear factor-κB activity in multiple myeloma cells[J]. Mol Cancer Res, 2008, 6: 1356–1364. DOI: 10.1158/1541-7786.MCR-08-0108 |
| [22] | KOKABEE L, WANG X H, SEVINSKY C J, WANG W L, CHEU L, CHITTUR S V, et al. Bruton's tyrosine kinase is a potential therapeutic target in prostate cancer[J]. Cancer Biol Ther, 2015, 16: 1604–1615. DOI: 10.1080/15384047.2015.1078023 |
 2016, Vol. 37
2016, Vol. 37


