抗中性粒细胞胞质抗体(anti-neutrophil cytoplasm antibody,ANCA)相关性血管炎常以急进性肾炎综合征起病,ANCA阳性,肾脏多表现为寡免疫复合物沉积的坏死性新月体肾炎[1],即ANCA相关性新月体肾炎,因其病变进展快,累及多系统,是肾脏疾病的危急重症。ANCA相关性新月体肾炎若存在明显的免疫复合物沉积(荧光强度≥2+),可能代表并存其他疾病,如IgA肾病、感染后肾炎或膜性肾病(membranous nephropathy,MN)等[2]。MN与ANCA相关性新月体肾炎同时发生十分罕见,自1993年Gaber等[3]报道首例至今,检索全球中英文文献该病仅有79例。回顾我科2 073例肾活检病例,仅于近期诊断1例MN合并ANCA相关性新月体肾炎,发病率为0.48‰。本研究结合我科确诊的1例MN合并ANCA相关性新月体肾炎病例,汇总既往此类病例的临床病理资料,总结此类疾病的临床病理特点和诊治策略,加深对该病的认识。
1 资料和方法 1.1 入选病例在MEDLINE数据库中以“membranous nephropathy”和“ANCA associated crescentic nephropathy”,以及在中国知网期刊数据库和维普中文期刊数据库中以“膜性肾病”和“ANCA相关性新月体肾炎”作为关键词进行检索,同时入选我科2016年5月收治经肾活检确诊的1例MN合并ANCA相关性新月体肾炎病例,纳入有完整临床病理数据的病例资料。
1.2 临床资料记录所有病例人口学资料;临床表现,如肾病综合征、急进性肾炎综合征、蛋白尿、血尿等;肾外症状,如发热、皮疹、关节痛、鼻窦炎、肺部受累等;实验室检查结果,包括血常规、肾功能、核周型ANCA (P-ANCA)、胞质型ANCA (C-ANCA)、髓过氧化物酶-ANCA (MPO-ANCA)、蛋白酶3-ANCA (PR3-ANCA)、24 h尿蛋白定量检测。
1.3 肾脏病理肾活检组织行光镜、免疫荧光及电镜检查。光镜检查包括苏木精-伊红(H-E)染色、过碘酸雪夫(PAS)染色、六铵银(PASM)染色和胶原纤维(Masson)染色。免疫荧光检查包括免疫球蛋白(Ig) G、IgA、IgM、纤维蛋白原(FIB), 以及补体C3、C4、C1q,部分病例包括IgG亚型和磷脂酶A2受体(PLA2R),并记录沉积部位和强度。电镜改变根据Ehrenreich-Churg分期法(Ⅰ~Ⅳ期)进行分期。
1.4 治疗方案与预后记录所有病例的治疗方案及预后情况。治疗方案主要包括单纯激素、激素联合免疫抑制、血浆置换和利妥昔单抗;预后根据存活情况、随访中是否进入终末期肾脏衰竭或肾脏替代治疗和24h尿蛋白定量水平,分为死亡、终末期肾病(end-stage renal disease,ESRD)、稳定和缓解。
1.5 统计学处理应用SPSS 18.0统计软件进行分析,计量资料以x±s表示;计数资料以百分率表示,组间比较采用χ2检验。检验水准(α)为0.05。
2 结果 2.1 病例入选情况通过检索,共收集MN合并ANCA相关性新月体肾炎79例[3-24],我院确诊的1例为第80例。所有病例均经肾组织活检确诊,病理表现为MN合并新月体肾炎,血清学检查提示ANCA阳性,并排除了抗基底膜肾炎和狼疮性肾炎。80例病例均符合入选标准,纳入本研究。具体入选病例情况见表 1。
|
|
表 1 80例MN合并ANCA相关性新月体肾炎患者临床及实验室检查特点 |
2.2 一般资料特点
80例病例中男性44例、女性36例,男女比1.22:1;年龄30~82 (56.8±13.1)岁,病程0.3~97.3 (3.2±3.6)个月;65例诊断为MN合并显微镜下多血管炎(microscopic polyangiitis,MPA),15例诊断为MN合并肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA)。95.0%(76/80)的病例MN与ANCA相关性新月体肾炎同时发生;4例(5.0%)先诊断为MN,之后再出现新月体肾炎。常见的肾外表现包括耳鼻喉受累(鼻窦炎、中耳炎等),占25.0%(20/80), 肺部受累、发热和关节痛均为23.8%(19/80),皮肤表现占11.2%(9/80),其他肾外表现有眼葡萄膜炎、虹膜炎、肝静脉炎、肌痛、胃肠道反应等,有17.5%(14/80)的病例无明显肾外表现,个别病例合并存在腺癌及桥本甲状腺炎。93.8%(75/80)的病例起病时合并肾功能不全,在53例病史资料完整的病例中,最常见的肾脏表现为肾病综合征合并急进性肾炎,占62.3%(33/53);28.3%(15/53)表现为尿检异常(蛋白尿、血尿),各有7.5%(4/53)表现为单纯肾病综合征或单纯急进性肾炎。
2.3 实验室检查所有病例均存在血清ANCA阳性,详见表 1。起病时24 h尿蛋白定量(5.3±4.3) g,血白蛋白(26.8±6.2) g/L,血肌酐(420.7±307.0)μmol/L,血红蛋白(89.6±19.5) g/L。抗基底膜抗体均阴性,个别病例抗核抗体阳性,但均无系统性红斑狼疮的临床表现。
2.4 肾脏病理所有病例均行肾穿刺活检术,光镜平均肾小球数(17.8±7.4)个、球性硬化比例(21.7±22.0)%、新月体比例(46.1±29.2)%,坏死比例(12.6±14.4)%,肾小球基底膜轻至中度增厚,52.8%(19/36)存在基底膜空泡变性,55.6%(20/36)基底膜上可见钉突形成。89.1%(57/64)的病例存在肾小管萎缩和间质纤维化,其中轻度损伤占63.2%(36/57)。64.7%(22/34)的病例存在血管病变。
免疫荧光检查显示95.0%(38/40)的病例IgG阳性,荧光强度1.96±0.63(0~4+);25.0%(10/40) IgA阳性,荧光强度0.27±0.53(0~2+);25.0%(10/40) IgM阳性,荧光强度0.21±0.39(0~1+);82.5%(33/40)补体C3阳性,荧光强度0.98±0.43(0~3+);少数病例合并补体C4和C1q阳性;免疫复合物沿毛细血管袢颗粒样沉积。
有24例病例行肾组织PLA2R检测,结果显示包括我科病例在内91.7%(22/24)的病例肾组织PLA2R阴性,仅有2例病例肾组织PLA2R阳性。所有病例电镜下均见上皮下电子致密物沉积,诊断为MNⅠ期26例(32.5%,26/80)、Ⅰ~Ⅱ期7例(8.8%,7/80)、Ⅱ期28例(35.0%,28/80)、Ⅱ~Ⅲ期10例(12.5%,10/80)、Ⅲ期6例(7.5%,6/80)、Ⅲ~Ⅳ期1例(1.3%,1/80)、未分期2例(2.5%, 2/80)。我科病例肾脏病理结果见图 1。
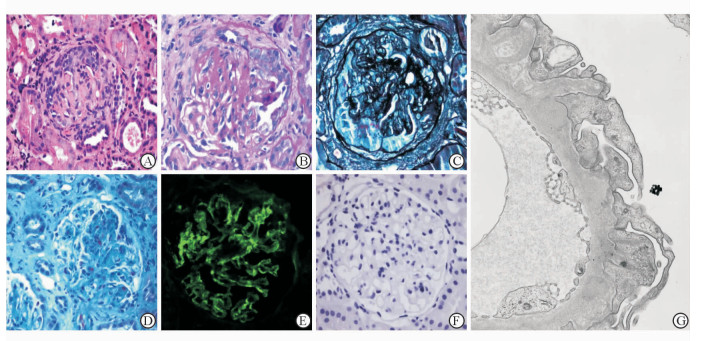
|
图 1 肾穿刺活检病理检查结果 A: H-E染色见肾小球内大细胞性新月体形成伴毛细血管袢受压;B:过碘酸雪夫(PAS)染色见基底膜不规则增厚和轻度系膜增生;C:六铵银(PASM)染色见肾小球内大新月体形成;D: Masson染色见肾小球内小新月体形成和节段硬化;E:免疫荧光检查见IgG沿毛细血管袢颗粒样沉积;F:免疫组化染色示磷脂酶A2受体(PLA2R)阴性;G:电镜下见上皮下沉积物. Original magnification: × 400 (A-F); ×8 000 (G) |
2.5 治疗与预后
80例患者中67例(83.8%)采用激素联合环磷酰胺(CTX)治疗,其中14例联用血浆置换,2例联用利妥昔单抗;7例(8.8%)单用激素治疗,1例激素联合利妥昔单抗和血浆置换;5例未治疗。51例病例有完整随访数据,随访时间1周至10年,死亡4例(7.8%,4/51),进入ESRD 8例(15.7%, 8/51),肾功能进展7例(13.7%, 7/51),肾功能稳定或缓解32例(62.7%, 32/51)。肾功能稳定或缓解的病例组与死亡/ESRD/肾功能进展的病例组相比,应用激素联合CTX治疗的比例增加[93.8%(30/32) vs 63.2%(12/19),P=0.006],提示激素联合CTX治疗可改善MN合并ANCA相关性新月体肾炎的预后。
3 讨论MN是中老年人肾病综合征最常见的病因,大多数患者临床表现为肾病综合征,起病时合并肾功能不全较少见,1/3可发展为ESRD;MN病理上以肾小球毛细血管袢上皮侧弥漫性免疫复合物沉积为特点,分为特发性和继发性两类;PLA2R是导致特发性MN的重要抗原之一[25-26]。
MN合并坏死性新月体肾炎十分罕见。在肾活检中发现MN的典型表现,同时有纤维素样坏死和新月体形成,需考虑的诊断包括伴有新月体形成的局灶性或弥漫性增生合并MN的狼疮性肾炎(Ⅲ+Ⅴ型或Ⅳ+Ⅴ型)、MN合并抗基底膜肾病或MN合并ANCA相关性新月体肾炎以及MN合并血清阴性的新月体肾炎[22]。
MN合并ANCA相关性新月体肾炎至今仅有小样本的回顾性分析和零散的病例报告。目前,最大宗的病例回顾为北京大学第一医院报道的27例,占该研究227例初发ANCA相关性血管炎行肾活检患者的11.9%(27/227),所有病例均同时诊断MN和ANCA相关性血管炎[19]。Nasr等[11]报道14例,占其医院所有MN (1 149例)的1.2%,90%的病例两者同时发生。
本研究总结了已报道的79例和我科1例MN合并ANCA相关性新月体肾炎,95%的病例MN与ACNA相关性新月体肾炎同时出现,其余5%的病例均先诊断MN,提示这两种病变可能在发病机制上存在某种联系。有学者推测肾小球基底膜的损害可能来源于MN的免疫沉积物,抗原释放到循环中形成自身抗体,但是临床上MN作为一种非常常见的疾病很少合并ANCA相关性肾炎,因此支持这一理论的临床证据有限;此外,目前没有表现为MN损害的实验动物模型导致继发的血管炎样肾小球损害,所以支持这一理论的实验证据也缺乏。本研究发现,88.2%(60/68)的病例MPO-ANCA阳性,在正常肾小球,MPO不仅可以产生氧化损伤,还可能结合于毛细血管壁形成种植抗原。Hanamura等[27]发现在MPO相关性肾炎中,MPO沿上皮侧分布类似MN损害。Kawashima等[28]也证实,在MPO-ANCA相关性血管炎中存在肾小球IgG、补体C3和MPO共沉积。在血管炎小鼠模型中发现免疫复合物沉积可加重ANCA诱导的肾小球损伤[29]。PLA2R是特发性MN引起原位免疫复合物形成的典型抗原,在行肾组织PLA2R检测的24例病例中,91.7%肾组织PLA2R阴性,远低于特发性MN肾组织PLA2R的阳性率(75%~80%)[30],虽病例数较少,但也提示此类疾病中MN以继发性为主。
本研究发现,MN合并ANCA相关性新月体肾炎兼具MN和新月体肾炎的特点,发病率男性略多于女性,中老年多发。最常见的临床表现为肾病综合征合并急进性肾炎,蛋白尿多且均合并血尿,大多数患者存在肾功能不全。患者肾外表现形式多样,以耳鼻喉受累最常见,肺部受累的比例低于单纯ANCA相关性新月体肾炎;少数病例表现为眼葡萄膜炎和虹膜炎,这是系统性血管炎眼部受累的表现。肾脏病理最常见的表现为新月体形成和基底膜增厚,本研究中约半数的病例可见基底膜空泡变性(52.8%)和钉突形成(55.6%),89.1%的病例存在小管萎缩和间质纤维化,以轻度损伤为主(63.2%)。免疫荧光以IgG和补体C3沿毛细血管袢颗粒样沉积为主,也可见IgM、IgA、补体C1q沉积,但荧光强度弱于IgG;个别病例IgG阴性,需靠电镜诊断。电镜观察可见上皮下电子致密物沉积,MN的分期主要为Ⅰ期和Ⅱ期。因部分病例MN的光镜改变不甚典型,免疫荧光和电镜检查对于避免漏诊很重要。
此类疾病的治疗还是以新月体肾炎的治疗策略为主,激素联合CTX最常用,疗效优于其他方案。本研究显示激素联合CTX治疗可改善患者预后,治疗后62.7%(32/51)的病例可达到肾功能稳定或缓解。近期也有采用激素联合CTX基础上加用利妥昔单抗治疗的报道,但病例数少,仍需进一步随访其疗效。
综上所述,本研究总结了包括我科病例在内的全球80例MN合并ANCA相关性新月体肾炎的临床病理特点。对于以肾病综合征合并急进性肾炎为主要表现的病例,应考虑到此诊断。此类疾病发病率极低,发病机制尚不明确,临床上常表现为大量蛋白尿、活动性尿沉渣和快速进展性肾功能不全,病理上以免疫复合物性新月体肾炎和上皮下免疫复合物沉积为主的MN为突出表现,积极的免疫抑制治疗可改善预后。
| [1] | KAMESH L, HARPER L, SAVAGE C O. ANCA-positive vasculitis[J]. J Am Soc Nephrol, 2002, 13: 1953–1960. DOI: 10.1097/01.ASN.0000016442.33680.3E |
| [2] | HAAS M, EUSTACE J A. Immune complex deposits in ANCA-associated crescentic glomerulonephritis:a study of 126 cases[J]. Kidney Int, 2004, 65: 2145–2152. DOI: 10.1111/j.1523-1755.2004.00632.x |
| [3] | GABER L W, WALL B M, COOKE C R. Coexistence of anti-neutrophil cytoplasmic antibody-associated glomerulonephritis and membranous glomerulopathy[J]. Am J Clin Pathol, 1993, 99: 211–215. DOI: 10.1093/ajcp/99.2.211 |
| [4] | TSE W Y, HOWIE A J, ADU D, SAVAGE C O, RICHARDS N T, WHEELER D C, et al. Association of vasculitic glomerulonephritis with membranous nephropathy:a report of 10 cases[J]. Nephrol Dial Transplant, 1997, 12: 1017–1027. DOI: 10.1093/ndt/12.5.1017 |
| [5] | KANAHARA K, YORIOKA N, NAKAMURA C, KYUDEN Y, OGATA S, TAGUCHI T, et al. Myeloperoxidase-antineutrophil cytoplasmic antibody-associated glomerulonephritis with membranous nephropathy in remission[J]. Intern Med, 1997, 36: 841–846. DOI: 10.2169/internalmedicine.36.841 |
| [6] | TANIGUCHI Y, YORIOKA N, KUMAGAI J, ITO T, YAMAKIDO M, TAGUCHI T. Myeloperoxidase antineutrophil cytoplasmic antibody-positive necrotizing crescentic glomerulonephritis and membranous glomerulonephropathy[J]. Clin Nephrol, 1999, 52: 253–255. |
| [7] | DWYER K M, AGAR J W, HILL P A, MURPHY B F. Membranous nephropathy and anti-neutrophil cytoplasmic antibody-associated glomerulonephritis:a report of 2 cases[J]. Clin Nephrol, 2001, 56: 394–397. |
| [8] | SUWABE T, UBARA Y, TAGAMI T, SAWA N, HOSHINO J, KATORI H, et al. Membranous glomerulopathy induced by myeloperoxidase-anti-neutrophil cytoplasmic antibody-related crescentic glomerulonephritis[J]. Intern Med, 2005, 44: 853–858. DOI: 10.2169/internalmedicine.44.853 |
| [9] | 占永立, 王丽, 赵宇, 柳丛, 李秀英. Ⅱ~Ⅲ期膜性肾病合并Ⅲ型新月体肾炎1例[J]. 中国中西医结合肾病杂志, 2006, 7: 665–666. |
| [10] | MATSUMOTO K, HONDA H, SHIBATA T, SANADA D, WADA Y, ASHIKAGA E, et al. MPO-ANCA crescentic glomerulonephritis complicated by membranous nephropathy:MPO demonstrated in epimembranous deposits[J]. NDT Plus, 2009, 2: 461–465. |
| [11] | NASR S H, SAID S M, VALERI A M, STOKES M B, MASANI N N, D'AGATI V D, et al. Membranous glomerulonephritis with ANCA-associated necrotizing and crescentic glomerulonephritis[J]. Clin J Am Soc Nephrol, 2009, 4: 299–308. DOI: 10.2215/CJN.04060808 |
| [12] | 周广宇, 金玲, 梁文昭, 徐明珠. 膜性肾病并发抗中性白细胞胞质抗体相关性小血管炎四例临床病理分析[J]. 中华肾脏病杂志, 2011, 27: 694–695. |
| [13] | SURINDRAN S, AYALON R, HASAN N, BECK L H, SALANT D J, BARISONI L, et al. Coexistence of ANCA-associated glomerulonephritis and anti-phospholipase A2 receptor antibody-positive membranous nephropathy[J]. Clin Kidney J, 2012, 5: 162–165. DOI: 10.1093/ckj/sfr149 |
| [14] | SHIMADA M, FUJITA T, NAKAMURA N, NARITA I, SHIMAYA Y, MURAKAMI R, et al. A case of myeloperoxidase anti-neutrophil cytoplasmic antibody (MPO-ANCA)-associated glomerulonephritis and concurrent membranous nephropathy[J]. BMC Nephrol, 2013, 14: 73. DOI: 10.1186/1471-2369-14-73 |
| [15] | HU Z J, NIU K, LIU B, SHI Y N. A case of membranous nephropathy and myeloperoxidase anti-neutrophil cytoplasmic antibody-associated glomerulonephritis[J]. Exp Ther Med, 2014, 8: 1170–1172. |
| [16] | KANODIA K, VANIKAR A, PATEL R, SUTHAR K, NIGAM L, KUTE V, et al. Membranous nephropathy with MPO-ANCA-associated crescentic GN[J/OL]. Nephrourol Mon, 2014, 6:e20701. doi:10.5812/numonthly.20701.eCollection2014. https://www.ncbi.nlm.nih.gov/pubmed/25738112 |
| [17] | THAJUDEEN B, JOHN S G, OSSAI N O, RIAZ I B, BRACAMONTE E, SUSSMAN A N. Membranous nephropathy with crescents in a patient with Hashimoto's thyroiditis:a case report[J/OL]. Medicine (Baltimore), 2014, 93:e63. doi:10.1097/MD.0000000000000063. http://www.ncbi.nlm.nih.gov/pmc/articles/pmid/25121358/ |
| [18] | 金玲, 周广宇, 张文龙, 张博, 庄振起. 老年特发性膜性肾病合并新月体坏死性肾小球肾炎的临床特点[J]. 中国老年学杂志, 2014, 34: 5034–5036. |
| [19] | ZOU R, LIU G, CUI Z, CHEN M, ZHAO M H. Clinical and immunologic characteristics of patients with ANCA-associated glomerulonephritis combined with membranous nephropathy:a retrospective cohort study in a single Chinese center[J/OL]. Medicine (Baltimore), 2015, 94:e1472. doi:10.1097/MD.0000000000001472. https://www.ncbi.nlm.nih.gov/pubmed/26376387 |
| [20] | BALAFA O, KALAITZIDIS R, LIAPIS G, XIROMERITI S, ZARZOULAS F, BALTATZIS G, et al. Crescentic glomerulonephritis and membranous nephropathy:a rare coexistence[J]. Int Urol Nephrol, 2015, 47: 1373–1377. DOI: 10.1007/s11255-015-1031-z |
| [21] | MOINUDDIN I, MADHRIRA M, BRACAMONTE E, THAJUDEEN B, SUSSMAN A. Membranous nephropathy with crescents associated with levamisole-induced MPO-ANCA vasculitis[J]. Pathol Res Pract, 2016, 212: 650–653. DOI: 10.1016/j.prp.2016.03.008 |
| [22] | CARRARA C, EMILI S, LIN M, ALPERS C E. Necrotizing and crescentic glomerulonephritis with membranous nephropathy in a patient exposed to levamisole-adulterated cocaine[J]. Clin Kidney J, 2016, 9: 234–238. DOI: 10.1093/ckj/sfv141 |
| [23] | BARRETT C M, TROXELL M L, LARSEN C P, HOUGHTON D C. Membranous glomerulonephritis with crescents[J]. Int Urol Nephrol, 2014, 46: 963–971. DOI: 10.1007/s11255-013-0593-x |
| [24] | WATANABE S, ARIMURA Y, NOMURA K, KAWASHIMA S, YOSHIHARA K, KANAME S, et al. Case of MPO-ANCA-associated vasculitis with membranous nephropathy[J]. Nihon Jinzo Gakkai Shi, 2011, 53: 46–52. |
| [25] | BECK L H, BONEGIO R G, LAMBEAU G, BECK D M, POWELL D W, CUMMINS T D, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J]. N Engl J Med, 2009, 361: 11–21. DOI: 10.1056/NEJMoa0810457 |
| [26] | BECK L H Jr, SALANT D J. Membranous nephropathy:from models to man[J]. J Clin Invest, 2014, 124: 2307–2314. DOI: 10.1172/JCI72270 |
| [27] | HANAMURA K, TOJO A, KINUGASA S, ASABA K, ONOZATO M L, UOZAKI H, et al. Detection of myeloperoxidase in membranous nephropathy-like deposits in patients with anti-neutrophil cytoplasmic antibody-associated glomerulonephritis[J]. Hum Pathol, 2011, 42: 649–658. DOI: 10.1016/j.humpath.2010.08.020 |
| [28] | KAWASHIMA S, ARIMURA Y, SANO K, KUDO A, KOMAGATA Y, KANAME S, et al. Immunopathologic co-localization of MPO, IgG, and C3 in glomeruli in human MPO-ANCA-associated glomerulonephritis[J]. Clin Nephrol, 2013, 79: 292–301. DOI: 10.5414/CN107675 |
| [29] | JENNETTE J C, XIAO H, FALK R J. Pathogenesis of vascular inflammation by anti-neutrophil cytoplasmic antibodies[J]. J Am Soc Nephrol, 2006, 17: 1235–1242. DOI: 10.1681/ASN.2005101048 |
| [30] | SLARSEN C P, MESSIAS N C, SILVA F G, MESSIAS E, WALKER P D. Determination of primary versus secondary membranous glomerulopathy utilizing phospholipase A2 receptor staining in renal biopsies[J]. Mod Pathol, 2013, 26: 709–715. DOI: 10.1038/modpathol.2012.207 |
 2016, Vol. 37
2016, Vol. 37


